AroG的突变体及其在产氨基酸基因工程菌中的应用的制作方法
 2021-02-02 08:02:38|
2021-02-02 08:02:38| 290|
290| 起点商标网
起点商标网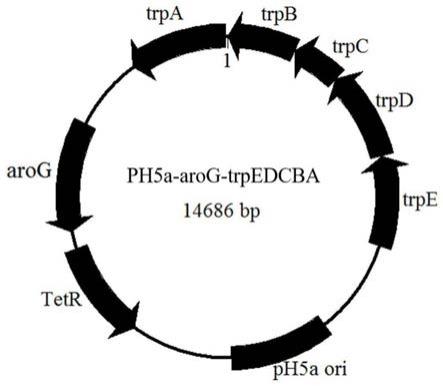
arog的突变体及其在产氨基酸基因工程菌中的应用
技术领域
[0001]
本发明属于基因工程和微生物领域,具体涉及arog的突变体和调控因子rpos的失活在产色氨酸的基因工程菌的构建中的应用,以及使用其发酵生产色氨酸中的应用。
背景技术:
[0002]
l-色氨酸作为人体内的一种必需氨基酸,可以合成色素、5-羟基色胺、吲哚等重要的生物活性物质,于医药、食品、饲料等行业有广泛的应用。目前,世界市场色氨酸的年需求量在万吨以上,并以每年10%的速度增长。在医学领域,l-色氨酸广泛应用于氨基酸注射液、必需氨基酸药品及水解蛋白质的添加剂等。l-色氨酸的转化产物5-羟色胺,具有抗抑郁症、提高睡眠质量、抗高血压及镇痛作用。作为食品添加剂,l-色氨酸可以强化机体对植物蛋白的利用效率。在饲料中添加l-色氨酸,可以调节饲料中氨基酸的平衡,促进家禽家畜的生长。
[0003]
l-色氨酸的生产方法有化学合成法、转化法和微生物发酵法。化学合成法由于存在工艺复杂、产品成分复杂等原因,已逐渐被淘汰。而酶转化法和微生物转化法虽然已经实现了工业化,但仍然存在原料昂贵、低转化率等问题。通过葡萄糖等廉价原料来生产l-色氨酸的微生物发酵法是最早开发的l-色氨酸生产方式,但这种方法在很长的一段时期内都无法实现工业化。究其原因,主要是在早起的研究中,研究者单一依靠传统的化学或物理诱变方式选育l-色氨酸生产菌株,而经过多轮的化学或物理诱变以后,很难确认诱变过程中次级突变对菌株的影响,背景相对不清晰,进而阻碍了菌种的进一步改良。90年代以来,随着dna重组技术的快速发展,特别是代谢工程育种方式的兴起,研究者逐渐选育出一批高产的l-色氨酸生产菌株,大幅提高了微生物发酵法生产l-色氨酸的效率,使其成为工业上主要的l-色氨酸生产方法。
[0004]
近年来,随着代谢工程、转录组学和合成生物学的发展,人们通过分析代谢途径,过量表达内源基因或引入外源基因,消除竞争支路,成功构建了合成特定目标化合物并用于工业化生产的工程菌株。目前代谢工程在微生物合成氨基酸、有机酸、萜类化合物、聚羟基脂肪酸酯、生物燃料等领域得到了广泛的应用。大肠杆菌因其易于培养、遗传背景清楚、遗传操作简便等优点被大规模应用于代谢工程改造用于合成各种有价值的化合物。
[0005]
由于具有原料廉价、产物纯度高、易提取等优点,微生物发酵法生产l-色氨酸受到了越来越多的关注。随着基因重组技术的发展,利用基因工程手段改造l-色氨酸合成途径逐步发展起来。在不涉及化学诱变的情况下,赵志军等运用代谢工程的研究策略,在不产l-色氨酸的e.coli w3110的基础上,通过一系列的基因操作,使l-色氨酸的产量提高至17.7g/l(赵志军.l-色氨酸生产菌株的构建及代谢调控研究[d].无锡:江南大学,2011.)。2017年,chen等通过基因工程纯理性改造的方法得到高产l-色氨酸菌株s028,通过发酵61h,l-色氨酸产量达到了40.3g/l(chen l et al.,applied microbiology and biotechnology,2017,101(2):559-568.)。而在1993年,syoji azuma等在发酵培养时添加pluronic l-61使l-色氨酸结晶,从而使l-色氨酸产量达到了54.5g/l(azuma s et al.,
applied microbiology and biotechnology,1993,39(4-5):471-476.)。
技术实现要素:
[0006]
本发明的目的在于通过基因工程的方法对细菌尤其大肠杆菌中氨基酸相关代谢途径基因进行改造,从而获得色氨酸生产菌株。
[0007]
本发明的目的在于通过基因工程的方法对细菌(尤其大肠杆菌)的氨基酸相关代谢途径基因进行改造,从而获得提高色氨酸产量的生产菌株。
[0008]
本发明的提供产色氨酸的基因工程细菌的制备方法,其是通过定点突变将出发细菌中3-脱氧-α-阿拉伯庚酮糖酸-7-磷酸合酶arog进行突变,以解除苯丙氨酸对arog的抑制作用,优选地是将arog的第211位氨基酸残基由s突变成f;同时,将出发细菌中的调控因子rpos进行失活或敲除,最终得到产色氨酸的基因工程细菌。由此可以的提高细菌的色氨酸的产量提高。这是由于arog本身是这些氨基酸代谢生产共同途径中的关键一步,同时研究发现将调控因子rpos失活,能够有效提高细菌的色氨酸的产量。其中,所述出发细菌是大肠杆菌。
[0009]
在具体的实施方式中,通过构建含有编码所述突变的arog的基因的表达载体导入出发细菌中实现,或者通过基因编辑方法等对细菌中本来的arog编码基因进行定点突变,以使得编码的蛋白的第211位氨基酸残基由突变为f。
[0010]
上述方法中,所述对调控因子rpos进行失活,其是通过基因编辑方法实现,在一个具体实施方式中,是将其中氨基酸序列第33位残基进行无义突变。
[0011]
在优选的实施方式中,所述出发细菌中,通过基因工程方法以使其过表达ppsa基因和/或同时敲除或失活trpr基因。其中过表达ppsa基因可以通过导入含有ppsa基因的表达载体实现,或通过基因编辑的方法在出发细菌的基因组上引入tac启动子以过表达ppsa基因;失活或敲除trpr基因是通过基因编辑,干扰rna等技术来实现。
[0012]
在进一步的优选实施方式中,在所述基因工程细菌中进一步敲除或失活色氨酸降解途径色氨酸酶tnaa,降低l-色氨酸的分解代谢,达到富集终产物l-色氨酸的目的。所述敲除或失知是通过基因编辑,干扰rna等技术来实现。
[0013]
本发明进一步提供由上述方法获得的基因工程细菌。优选地,其中大肠杆菌。
[0014]
本发明还提供上述基因工程细菌在制备色氨酸中的应用。
[0015]
在具体实施方式中,通过对所述基因工程菌进行发酵,然后收集色氨酸的步骤,具体是从发酵上清液中收集色氨酸。其中将所述基因工程菌经过38-42h发酵培养后,从酵液上清中收集色氨酸。更优选地,还包括纯化色氨酸的步骤。
[0016]
利用本发明获得的基因工程菌进行发酵,可以获得色氨酸的有效积累,为它们的产业化生产奠定了基础。
附图说明
[0017]
图1:ph5a-arog-trpedcba质粒图谱。
[0018]
图2:l-色氨酸生产菌株摇瓶发酵结果。
[0019]
图3:l-色氨酸生产菌株摇瓶发酵od
600
结果。
具体实施方式
[0020]
以下的实施例便于更好地理解本发明,但并不限定本发明。
[0021]
下述实施例中的实验方法,如无特殊说明,均为常规方法。
[0022]
下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
[0023]
以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
[0024]
突变体arog(s211f)的氨基酸序列如seq id no:1所示,实施例中采用的所述突变体的核苷酸序列如seq id no:2所示。
[0025]
kw菌株记载于如下文献中:chen,y.et al.rational design and analysis of an escherichia coli strain for high-efficiency tryptophan production.journal of industrial microbiol&biotechnology,45(5),357-367(2018).
[0026]
实施例1、构建菌株bdz1
[0027]
本实施例中涉及的野生型基因及其在genbank中的登录号分别是:arog的id:945605,rpos的id:947210,ppsa的id:946209,trpr的id:948917,tnaa的id:948221。
[0028]
ph5a-arog-trpedcba质粒构建:以野生型大肠杆菌mg1655为模板,用引物arog-f、arog-r扩增带接头的arog片段。以ph5a质粒做模板,ph5a-m-f、ph5a-m-r扩增带接头的ph5a-m片段。以arog片段和ph5a-m片段为模板,arog-f、ph5a-m-r引物扩增得到用于gibson assembly的arog-m-gibson片段。以mg1655为模板,用引物trpedcba-f、trpedcba-r扩增带接头的trpedcba-gibson片段。以ph5a-ver-f、ph5a-ver-r扩增带接头的质粒骨架,与上面的arog-m-gibson片段、trpedcba-gibson片段通过gibson assembly得到ph5a-arog-trpedcba质粒,质粒图谱如图1所示。
[0029]
cas9-ppsa质粒构建:以野生型大肠杆菌mg1655为模板,用引物ppsa-up-f、ppsa-up-r扩增带接头的ppsa-up片段,用引物ppsa-down-f、ppsa-down-r扩增带接头的ppsa-down片段。ppsa-up片段和ppsa-down片段通过组装成ppsa-ud片段。以cas9质粒为模板,用引物ppsa-n20-f、ppsa-ver-r扩增质粒骨架ppsa-ver1片段,用引物ppsa-ver-f、ppsa-n20-r扩增质粒骨架tnaa-ver2片段。质粒骨架ppsa-ver1、ppsa-ver2与上面的片段ppsa-ud通过gibson assembly(gibson assembly方法是gibson等发明的将多个dna片段在1次反应中实现分子间连接)得到cas9-ppsa质粒。
[0030]
cas9-trpr质粒构建:以野生型大肠杆菌mg1655为模板,用引物trpr-up-f、trpr-up-r扩增带接头的trpr-up片段,用引物trpr-down-f、trpr-down-r扩增带接头的trpr-down片段。trpr-up片段和trpr-down片段通过组装成trpr-ud片段。以cas9质粒为模板,用引物trpr-n20-f、trpr-ver-r扩增质粒骨架trpr-ver1片段,用引物trpr-ver-f、trpr-n20-r扩增质粒骨架trpr-ver2片段。质粒骨架trpr-ver1、trpr-ver2与上面的片段trpr-ud通过gibson assembly(gibson assembly方法是gibson等发明的将多个dna片段在1次反应中实现分子间连接)得到cas9-trpr质粒。
[0031]
cas9-tnaa质粒构建:以mg1655为模板,用引物tnaa-up-f、tnaa-up-r扩增带接头的tana-up片段,用引物tnaa-down-f、tnaa-down-r扩增带接头的tnaa-down片段。tnaa-up片段和tnaa-down片段通过组装成tnaa-ud片段。以cas9质粒为模板,用引物tnaa-n20-f、tnaa-ver-r扩增质粒骨架tnaa-ver1片段,用引物tnaa-ver-f、tnaa-n20-r扩增质粒骨架
tnaa-ver2片段。质粒骨架tnaa-ver1、tnaa-ver2与上面的片段tnaa-ud通过gibson assembly(gibson assembly方法是gibson等发明的将多个dna片段在1次反应中实现分子间连接)得到cas9-tnaa质粒。本部分所用引物如下:
[0032]
表1构建l-色氨酸生产菌株bdz1所用到的引物
[0033]
[0034][0035]
把质粒ph5a-arog-trpedcba化转入菌株kw,并在其基因组上通过引入tac启动子过表达ppsa基因,敲除调控因子trpr和tnaa后,构建成菌株bdz1。本部分所用到的菌株及质粒如下:
[0036]
表2构建l-色氨酸生产菌株bdz1所用菌株和质粒
[0037][0038][0039]
实施例2、构建菌株bdz2
[0040]
dahp合酶arog催化两个重要前体物磷酸烯醇式丙酮酸(pep)和赤藓糖-4-磷酸(e4p)生成dahp,从而进入莽草酸途径。arog在色氨酸合成途径中占有关键位点,但是,arog受到l-苯丙氨酸的反馈抑制作用,因此解除苯丙氨酸对arog的抑制作用,对扩大莽草酸途径代谢流十分关键。针对l-苯丙氨酸对arog的抑制作用,对l-苯丙氨酸和arog蛋白(pdb:5cks)进行了对接后发现,arog蛋白中的第180位氨基酸(s)和第6位氨基酸(q)与l-苯丙氨酸之间直接形成了氢键相互作用。为了解除苯丙氨酸的抑制作用,将arog的s211位残基替换为了f,突变后的f中的苯环直接占据了抑制剂l-苯丙氨酸在arog蛋白中的部分结合位置,从而阻止了抑制剂l-苯丙氨酸在arog蛋白中的结合。在此基础上,解除了l-苯丙氨酸对arog的抑制作用。
[0041]
ph5a-arog
fbr-trpedcba质粒构建:以质粒ph5a-arog-trpedcba为模板,用引物arog-m1-f、arog-m1-r扩增带接头的arog1-gibson片段。以质粒ph5a-arog-trpedcba为模板,用引物arog-m2-f、arog-m2-r扩增带接头的arog2-gibson片段,与上面的arog1-gibson片段通过gibson assembly得到ph5a-arog
fbr-trpedcba质粒。
[0042]
本部分所用引物如下:
[0043]
表3构建l-色氨酸生产菌株bdz2所用到的引物
[0044]
引物名称核苷酸序列(5
’-3’
)引物arog-m1-f(seq id no.27)caactgaccgaagccgcgccgccgctgccag引物arog-m1-r(seq id no.28)catttcgttacgaacaggaagcagtgcggc引物arog-m2-f(seq id no.29)actgcttcctgttcgtaacgaaatgggggc引物arog-m2-r(seq id no.30)ggcagcggcggcgcggcttcggtcagttgctg
[0045]
把质粒ph5a-arog
fbr-trpedcba替换掉菌株bdz1中的ph5a-arog-trpedcba质粒,得到菌株bdz2。本部分所用到的菌株及质粒如下:
[0046]
表4构建l-色氨酸生产菌株bdz2所用菌株和质粒
[0047][0048][0049]
实施例3、构建l-色氨酸生产菌株bdz3
[0050]
rpos编码σ
s
,是rna聚合酶的亚基,在大肠杆菌中充当许多稳定期基因适应营养缺乏和其它压力的主要调控因子。对rpos依赖性基因表达的全基因组分析显示出,大肠杆菌中高达10%的基因受到rpos的直接或间接调控。虽然rpos调节因子是一个巨大的保守系统,对适应各种压力胁迫至关重要,但它在特定代谢途径中的调控机制仍然不完全清楚,如l-色氨酸合成途径。因此,本发明引入突变位点q33*将rpos失活,从而确定rpos对l-色氨酸合成途径的影响。
[0051]
cas9-rpos质粒构建:以mg1655为模板,用引物rpos-up-f,rpos-up-r扩增带接头的rpos-up片段,用引物rpos-down-f,rpos-down-r扩增带接头的rpos-down片段。以rpos-up片段和rpos-down片段为模板,用引物rpos-up-f,rpos-down-r扩增得到用于gibson assembly的rpos-ud片段。以cas9质粒为模板,用引物rpos-ver-f,rpos-n20-r扩增带接头的质粒骨架rpos-ver1,用引物rpos-n20-f,rpos-ver-r扩增带接头的质粒骨架rpos-ver2。质粒骨架rpos-ver1和rpos-ver2与上面的rpos-ud片段通过gibson assembly得到质粒cas9-rpos。
[0052]
本部分所用引物如下:
[0053]
表5构建l-色氨酸生产菌株bdz3所用到的引物
[0054]
引物名称核苷酸序列(5
’-3’
)引物rpos-up-fcgaagaatccatgggcctgtcaagaagttaaggcggggca引物rpos-up-rgctaaatcgttatcactgggttcctattctactaaggccttttcgt引物rpos-down-fgaataggaacccagtgataacgatttagccgaagaggaactgttatc引物rpos-down-ragaatccaagcttccattcaccgggtcaaacttctctacc引物rpos-ver-fggtagagaagtttgacccggtgaatggaagcttggattct引物rpos-ver-rtgccccgccttaacttcttgacaggcccatggattcttcg引物rpos-n20-fggaacccagtgataacgattgttttagagctagaaatagc引物rpos-n20-raatcgttatcactgggttccgctaagatctgactccataa
[0055]
把质粒cas9-rpos导入到菌株bdz2中。通过在培养基中添加阿拉伯糖进行诱导,最终构建含有无义突变rpos(q33*)的菌株bdz3。本部分所用到的菌株及质粒如下:
[0056]
表6构建l-色氨酸生产菌株bdz3所用菌株和质粒
[0057][0058][0059]
实施例4、基因工程菌株的产氨基酸实验
[0060]
1、基因工程菌株的发酵
[0061]
大肠杆菌菌株bdz1-bdz3摇瓶发酵工艺如下:
[0062]
(1)斜面活化培养:从-80℃冰箱取出保藏菌种划线于含有四环素抗性的固体培养基,37℃培养12-18h。
[0063]
(2)种子培养:用接种环从新鲜活化斜面上挑取单菌落于种子基本培养基中(500ml三角瓶中装50ml lb培养基,封口膜封口),37℃、220r/min振荡培养6-8h至od
600
约为2-3。
[0064]
(3)摇瓶分批发酵培养:将种子培养液按10%的接种量接入含有四环素抗性发酵基本培养基中(500ml三角瓶,装液量为50ml,封口膜封口),37℃、220r/min振荡培养进行l-色氨酸分批发酵36-42h。摇瓶发酵培养基表7:
[0065]
表7 l-色氨酸发酵培养基配方
[0066]
培养基成分含量葡萄糖20g/l(nh4)2so410g/lkh2po45g/lyeast2g/lmops0.4mmgso45g/lfeso47h2o15mg/lsodium citrate0.5g/lvb1100mg/lcuso4·
5h2o4mg/lznso4·
7h2o4mg/lmnso4h2o15mg/l
[0067]
2、发酵菌株高效液相色谱法(hplc)检测
[0068]
将发酵液在冷冻离心机中5500rpm/min离心15-20min,收集上清,上清经0.22μm滤膜过滤后做hplc检测。
[0069]
hplc条件为:色谱柱为zorbax eclipse aaa(氨基酸分析)色谱柱,流动相a:40mm na2hpo4,ph 7.8,流动相b:甲醇:乙腈:水=45:45:10,v/v/v。洗脱梯度为0-1min,100%a;9.8min:43%a+57%b;10min:100%b;12min:100%b;12.5min:100%a。流速2.0ml/min,串联连接rid、vwd检测器,检测池温度控制在40℃,进样量为10μl,分析时间26min,紫外检测
波长338nm。
[0070]
3、发酵结果及分析
[0071]
菌株kw、bdz1-bdz3在经过36-42h发酵培养后,对发酵液上清进行了hplc检测,结果如图2所示。由发酵结果可以看出,在菌株kw的基础上,引入dahp合酶突变体arog(s211f),菌株bdz2生产色氨酸的能力相对于kw菌株提高了1.69倍,l-色氨酸产量达到了0.65g/l,但是由图3可以看出,相比对照菌株kw,菌株bdz2的生长受到抑制。在此基础上,通过引入rpos(q33*),构建的bdz3恢复了菌株的生长(图3),并且l-色氨酸的产量提高到0.73g/l,相比对照菌株kw,提升了2.04倍。
[0072]
表8 l-色氨酸生产菌株摇瓶发酵结果
[0073]
菌株l-色氨酸(g/l)kw0.24
±
0.011g/lbdz10.44
±
0.048g/lbdz20.65
±
0.025g/lbdz30.73
±
0.035g/l
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



