一种用于检测艰难梭菌的核酸适配体及应用的制作方法
 2021-02-02 08:02:01|
2021-02-02 08:02:01| 360|
360| 起点商标网
起点商标网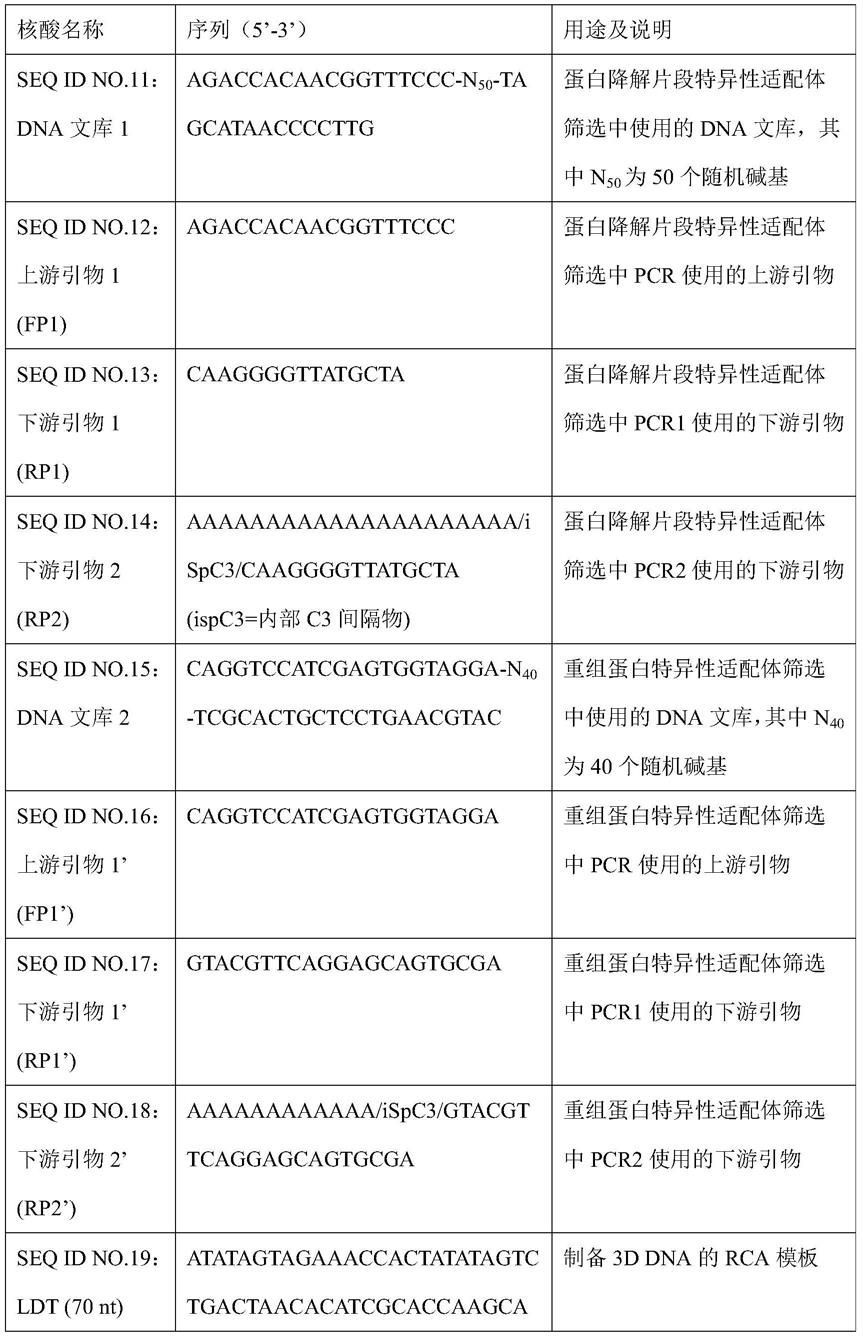
[0001]
本发明属于分析检测领域,具体涉及一种用于检测艰难梭菌(clostridium difficile)的核酸适配体及应用。
背景技术:
[0002]
核酸适配体(aptamers)是一种通过体外筛选技术(selex)从随机序列文库中获得的具有特异性识别和结合功能的核酸片段。由于具有化学稳定性高、亲和力高和生产成本低等特点,适配体已成为当前生物分析检测和生物医学研究中重要的智能生物识别工具。适配体可结合的靶标分子范围广泛,包括小分子、蛋白质和细胞等。
[0003]
体外筛选中往往使用具有天然稳定构象的高纯度蛋白质作为靶标分子来获得可特异性结合蛋白质的适配体。而在临床诊断领域,临床样品(血液、尿液或粪便)中的蛋白质生物标志物由于受到水解、氧化和ph变化等影响可能发生降解,因此使用常规方法得到的适配体在实际样品中的特异性识别能力会大大降低,这极大限制了适配体在临床诊断方面的应用。
[0004]
艰难梭菌是一种具有产毒素能力的芽孢杆菌,是引起抗生素相关性腹泻的主要原因,其生物标志物为毒素b(tcdb)。当毒素b排出体外后,由于生理条件的改变,会自发降解成小蛋白质片段或肽段,使现有的以天然稳定构象蛋白为检测目标的方法难以发挥作用,给临床诊断艰难梭菌感染带来了巨大的挑战。因此,通过体外筛选获得特异性识别毒素b降解片段的适配体,建立准确、快速的诊断方法对于控制艰难梭菌感染至关重要。
技术实现要素:
[0005]
本发明为了解决现有的技术问题,利用体外筛选技术获得对蛋白降解片段具有特异性识别能力的核酸适配体,并提供一种利用识别蛋白降解片段的核酸适配体检测艰难梭菌的方法。该核酸适配体可以识别人体粪便样本中的降解毒素b和天然毒素b。利用上述核酸适配体制作一种简单的纸基分析器件,通过比色法检测粪便样本中的毒素b和艰难梭菌菌株。将具有特异性识别蛋白降解片段的核酸适配体与纸基传感器件相结合,可扩大核酸适配体在临床诊断中的实用价值。
[0006]
本发明为解决上述技术问题,本发明提供了一种用于检测艰难梭菌的核酸适配体,包括如seq id no.1所示的核苷酸序列。
[0007]
本发明还提供了一种用于检测艰难梭菌的核酸适配体,包括如seq id no.10所示的核苷酸序列。
[0008]
进一步地,上述技术方案中,所述核酸适配体的二级结构包含一个稳定的茎s1和位于两个单链区j1/2一侧的弱稳定茎环结构s2-l1。
[0009]
进一步地,上述技术方案中,所述核酸适配体的二级结构包含位于两个单链区j1/2一侧的弱稳定茎环结构s2-l1。
[0010]
进一步地,上述技术方案中,所述核酸适配体可以特异性识别艰难梭菌毒素b、毒
素b降解片段或肽段以及经热处理后的毒素b。
[0011]
进一步地,上述技术方案中,所述毒素b蛋白降解片段或肽段的大小为50kda。
[0012]
进一步地,上述技术方案中,所述热处理后的毒素b为90℃加热15min后的毒素b。
[0013]
本发明还提供了一种纸基传感器件,一种纸基传感器件,其特征在于,利用所述的核酸适配体制备而成的用于检测艰难梭菌或毒素b蛋白及降解片段或肽段的传感器,所述纸基传感器具有一层硝化纤维膜和一层滤纸层结构,并通过滤纸开放通道将滤纸层上的y型开放通道与硝化纤维膜上的通道连接;所述硝化纤维膜上用蜡印机打印圆形传感区s,滤纸层结构上用蜡印法打印圆形控制区c和圆形测试区t;控制区和测试区的直径之和与传感区直径相同,且控制区和测试区不相通;
[0014]
传感区s上打印3d dna/dp1杂交体,测试区t上打印φ29聚合酶,环状模板cdt1,dntps,血红素,普鲁兰糖混合物,控制区c上打印φ29聚合酶,环状模板cdt2,dp2,dntps,血红素,普鲁兰糖混合物。
[0015]
进一步地,上述技术方案中,s区上打印的3d dna/dp1与加入的毒素b结合后,释放dp1,被t区捕获作为引物开始rca反应。
[0016]
进一步地,上述技术方案中,所述rca反应的rca产物由类过氧化物酶脱氧核酶pw17的重复单元组成;滴加h2o2和氧化底物tmb后启动比色反应产生信号,c区产生颜色变化作为对照,当s区识别到毒素b时,t区产生信号。
[0017]
与现有技术相比,本发明的有益效果是:
[0018]
本发明以经筛选获得的艰难梭菌毒素b降解片段特异性适配体为识别元件构建纸基分析器件,通过被测蛋白浓度与比色信号呈线性关系实现对毒素b和艰难梭菌菌株的定量检测。该方法特异性好,灵敏度高,抗干扰性强,可以有效避免传统免疫检测法在使用中由于毒素b降解造成的检测困难,实现对粪便样品中目标物的测量,该方法对毒素b检测的检出限为60pm,对艰难梭菌菌株的检出限为104个/ml(rca反应时间为30min)。当rca反应的时间为15min时,纸基传感器件对降解毒素b检出限为600pm;当rca时间达到30min时,纸基传感器件对天然毒素b和降解毒素b的检出限分别为600pm和60pm,而用gdh和毒素a检测时未见明显信号变化。
附图说明
[0019]
图1为实施例2所述特异性识别蛋白降解片段适配体筛选的流程图。
[0020]
图2为实施例2所述核酸适配体dapt1的程序预测二级结构图。
[0021]
图3为实施例2所制备的核酸适配体dapt1的结合活性测试图。
[0022]
图4为实施例2所制备的核酸适配体dapt1对降解毒素b和天然毒素b的解离常数图;图中,a为降解毒素b,b为天然毒素b。
[0023]
图5为本发明中重组蛋白特异性适配体筛选策略图。
[0024]
图6为通过实施例3获得的核酸适配体rapt1和rapt2对不同种蛋白的结合活性图;图中,a为重组毒素b,b为天然毒素b,c为降解毒素b。
[0025]
图7为实施例2所制备的核酸适配体结合蛋白降解片段大小分析图;图中,a为通过不同截留分子量的超滤管分析结合片段分子量,b为通过印记实验分析结合片段分子量。
[0026]
图8为实施例2所制备的核酸适配体结构优化图;图中,a为优化后的适配体dapt1t
预测二级结构,b为置换s1,j1/2和s2-l1中的部分碱基获得的突变dapt1t结合活性测定。
[0027]
图9为利用实施例3方法优化后的核酸适配体构建1d报告dna图;图中a为两种不同双链设计的报告系统,b为1d报告dna对谷氨酸脱氢酶、毒素a和降解毒素b的响应,c为1d报告dna对不同浓度降解毒素的响应。
[0028]
图10为利用实施例3方法优化后的核酸适配体构建3d dna的透射电镜图。
[0029]
图11为利用实施例3方法优化后的核酸适配体构建纸基分析器件工作原理图。
[0030]
图12为实施例4所述纸基分析器件s区设计原理图。
[0031]
图13为实施例4所述纸基分析器件t区设计原理图。
[0032]
图14为实施例4所述纸基分析器件c区设计原理图。
[0033]
图15为实施例4所述纸基分析器件使用时的折叠方式。
[0034]
图16为实施例4所述纸基分析器件对毒素b的检测图。
[0035]
图17为实施例4所述纸基分析器件选择性分析图。
[0036]
图18为实施例4所述纸基分析器件对艰难梭菌菌株的检测图。
具体实施方式
[0037]
为了使本领域的技术人员更好地理解本发明的技术方案,下面结合实施例对本发明的具体实施方式作进一步详细说明,实施例包括适配体的筛选、表征和纸基分析器件的构建等。
[0038]
表1:本发明中使用的核酸序列
[0039]
mgcl2,1mm dtt,0.05%tween-20,ph 7.5。
[0046]
下述实施例中的洗脱缓冲液:50mm tris-hcl,ph 8.3,4m硫氰酸胍,1mm ddt。
[0047]
实施例的具体实施步骤如下:
[0048]
实施例1利用selex和高通量测序技术筛选降解蛋白片段的dna核酸适配体并构建纸基分析器件的技术路线
[0049]
(1)特异性识别艰难梭菌毒素b降解蛋白适配体的体外筛选;(2)适配体的表征。测试适配体与目标蛋白的结合能力及选择性,分析与目标物结合的关键碱基,优化适配体结构,并与重组毒素b特异性识别适配体对比;(3)纸基分析器件的构建。将反应试剂喷墨打印到纸表面,通过滚环扩增技术(rca)获得3d dna,3d dna识别目标产生结构转换从而释放探针,探针诱发rca,rca产物氧化底物产生比色信号。分析测试纸基器件的检测能力。
[0050]
实施例2特异性识别蛋白降解片段适配体的体外筛选。
[0051]
特异性识别蛋白降解片段适配体筛选的具体步骤(图1),包括蛋白降解片段制备,适配体筛选,pcr扩增等详细过程,具体操作如下:
[0052]
(1)蛋白降解片段制备:将天然毒素b在4℃放置一周使其自然降解,取1μl降解产物(170ng/μl)点样于圆纸片(孔径0.45μm,直径13mm)中间,氮吹干燥。纸上加120μl封闭缓冲液,室温孵育30min。2ml洗涤缓冲液浸洗后,氮吹干燥备用。
[0053]
(2)筛选:在含有蛋白降解片段的纸上加入100μl含20μm dna文库1的毒素b结合缓冲液,95℃5min变性,冷却至室温孵育30min。用洗涤缓冲液洗涤3次后,用300μl洗脱缓冲液将与蛋白降解片段结合的dna进行洗脱。
[0054]
(3)pcr扩增:将步骤(2)中洗脱下来的溶液进行pcr1扩增,每50μl体积含5u taq聚合酶,1μm fp1,1μm rp1,200μm dntps,1
×
pcr反应缓冲液(75mm tris-hcl,ph 9.0,2mm mgcl2,50mm kcl,20mm(nh4)2so4)。pcr循环:94℃1min,52℃45s,72℃30s,最终72℃延伸5min。扩增产物进行pcr2扩增,pcr2使用有内部c3间隔物的rp2作为下游引物,使用fp1作为上游引物,进一步从pcr双链产物中分离单链dna。
[0055]
(4)重复步骤(1)~(3)至第12轮筛选。
[0056]
(5)miseq(illumina)测序平台对100mm第12轮筛选得到的pcr扩增产物进行深度测序。
[0057]
分析测序结果中占比前五序列的结合能力,mfold程序(http://mfold.rna.albany.edu/?q=mfold/dna-folding-form)在线预测结合能力最强序列dapt1的二级结构。dapt1的序列如seq id no.1所示。
[0058]
预测结果如图2所示,该序列的二级结构包含一个稳定的茎(s1)和位于两条单链区(j1/2)一侧的弱茎环结构(s2-l1)。
[0059]
表2:本发明中通过深度测序获得的出现频率最高的前5条dapt核酸序列
[0060][0061]
实施例3适配体的表征
[0062]
(1)点印迹法分析核酸适配体dapt1的选择性
[0063]
硝化纤维滤膜上分别固定1μl降解后毒素b(170ng/μl)、天然毒素b(170ng/μl)、热处理毒素b(170ng/μl)、重组毒素b(160ng/μl)、毒素a(160ng/μl)和谷氨酸脱氢酶(160ng/μl)。与10μl 100nm 5
’-
32
p标记的实施例2中dapt1孵育20min,洗涤后进行磷光成像。设置对照组,对照组为不含毒素。
[0064]
图3显示dapt1可以与降解毒素b、天然毒素b、热处理毒素b结合,但不与重组毒素b、毒素a、谷氨酸脱氢酶结合。
[0065]
(2)膜结合法分析核酸适配体dapt1的结合能力
[0066]
蜡印96微区硝化纤维纸板,每个测试微区直径4mm。将10nm 5
’-
32
p标记的dapt1与不同浓度的毒素b进行结合反应测试。混合物在毒素b结合缓冲液中室温孵育30min,洗涤干燥后利用荧光成像仪扫描成像。
[0067]
dapt1对降解毒素b和天然毒素b的解离常数(图4)分别为5.3nm和3.4nm。
[0068]
(3)与特异性识别重组毒素b核酸适配体的对比分析
[0069]
参照实施例2特异性识别蛋白降解片段适配体筛选的步骤,以dna文库2作为筛选文库,以包被在磁珠(购自sigma-aldrich)上的重组毒素b为适配体筛选的目标物,利用磁铁分离有结合作用的核酸。洗脱溶液用fp1
’
、rp1
’
和rp2
’
进行pcr1和pcr2扩增。通过12轮筛选得到pcr扩增产物进行深度测序。(筛选方式流程图如图5所示,其中重组毒素b为重组表达分离用his标签分离的毒素b,购自pro-lab diagnostics)
[0070]
分析测序结果中占比前四序列的结合能力,mfold程序(http://mfold.rna.albany.edu/?q=mfold/dna-folding-form)在线预测结合能力最强序列的二级结构。分离出特异性识别重组毒素b的核酸适配体,记为rapt。并对比dapt、rapt与天然毒素b、重组毒素b及降解毒素b的识别能力。
[0071]
表3:本发明中通过深度测序获得的出现频率最高的前4条rapt核酸序列
[0072][0073][0074]
通过与dapt结合能力测试的实验方法分析rapt的结合能力。结果表明,rapt1和rapt2对重组毒素b和天然毒素b均有良好的亲和力,但与降解毒素b的结合能力较差(图6)。其中,rapt2与重组毒素b和天然毒素b的k
d
值分别为5.0nm和9.5nm,与降解毒素b的k
d
值大于1000nm。rapt2与4℃保存1d的天然毒素b粪便样本有很强结合能力,但样本保存5d和10d后,结合能力逐渐降低。而dapt1与保存10d样品几乎完全结合,表明dapt1与自然降解毒素b的结合能力更强。
[0075]
(4)印迹法分析核酸适配体dapt1结合蛋白片段
[0076]
利用8%聚丙烯酰胺凝胶电泳分离连续稀释的降解毒素b样品。pvdf膜在使用前先于甲醇中活化5min。利用300ma电流将蛋白由凝胶电转至膜。电转缓冲液中含有25mm tris、192mm甘氨酸和2%(v/v)甲醇。利用含5%(w/v)bsa的磷酸盐缓冲液封闭膜上的非特异性结合位点。洗涤后将膜与100nm fam标记的dapt1在毒素b结合缓冲液中孵育20min,再次洗涤后进行荧光成像。
[0077]
图7显示适配体结合的蛋白降解片段大小约50kda。
[0078]
(5)核酸适配体dapt1的结构优化
[0079]
分析dapt1片段序列的结合活性。dapt1前端21个和尾端23个核苷酸可删除,得到39nt适配体(图8),记为dapt1t,序列如seq id no.10所示。其s2-l1和j1/2结构中的核苷酸对靶标结合至关重要。
[0080]
seq id no.10:agtctggttcggtgcttggtgcgatgtgttagtcagact。
[0081]
实施例4纸基分析器件
[0082]
(1)1d报告dna系统的构建
[0083]
5μl f-dapt1t1或f-dapt1t2(1μm)和10μl qdna1或qdna2(1μm)于100μl 1
×
毒素b结合缓冲液中混合,90℃加热10min。室温孵育15min,加入100nm gdh(谷氨酸脱氢酶)、毒素a或降解毒素b,孵育20min后,在cary eclipse荧光分光光度计(varian)上测定荧光强度,激发490nm,发射520nm。
[0084]
1d报告dna的选择性测试结果显示,两种模式的报告系统(f-dapt1t1/qdna1和f-dapt1t2/qdna2)均对降解毒素b有很强的响应,而对谷氨酸脱氢酶和毒素a基本无响应。且
该报道系统对降解毒素b的响应随毒素浓度增大而增大。
[0085]
(2)3d dna对毒素b的检测
[0086]
1μl含dapt1t互补序列的ldt(10μm)、10μm模板引物(tp)、5μl 10
×
rca缓冲液、2μl dntps(10mm)和10uφ29酶,在30℃孵育30min,90℃10min使聚合酶失活。rca产物室温孵育12h自组装为3d dna。利用3k滤膜对3d dna进行清洗回收后,加入1μl fdna(200μm),90℃10min,冷却,室温孵育12h,组装成3d报告dna,用3k滤膜收集。
[0087]
结构转换反应:4μl 3d dna、6μl毒素b结合缓冲液、100nm蛋白质(降解毒素b、天然毒素b、热处理毒素b、毒素a或谷氨酸脱氢酶),室温孵育30min,用0.6%琼脂糖电泳检测反应结果。
[0088]
透视电镜(图10)显示3d dna平均直径为2μm,可以结合fdna探针形成3d报告dna。当3d报告dna中最小单元的适配体部分识别并结合靶标,发生结构转变,3d报告dna内的fdna探针被释放。电泳结果显示,fdna可被天然毒素b、降解毒素b、热处理毒素b释放,但不能被毒素a和谷氨酸脱氢酶释放,表明3d报告dna具有良好的选择性。
[0089]
(3)纸基分析器件的制作
[0090]
纸基分析器件由两层组成,以实现多重反应(结构如图11所示)。第一层,通过喷蜡打印机(xerox colourqube 8570n)在硝化纤维膜(millipore hf120)上打印直径为1cm的圆形传感区(s),120℃加热2min使蜡融进膜,形成疏水屏障,并用biodot xyz3060自动剂量分配装置在圆形区域内打印3d dna/dp1配对复合物(图12)。第二层用上述方法在滤纸(whatman grade 1)上并排打印直径为0.5cm的圆形控制区(c)和测试区(t)。在t区(图13)打印含有10uφ29聚合酶,1μl cdt1(10μm),1μl dntps(10mm),1μl血红素(100μm),5μl普鲁兰糖(10%,w/v)的反应试剂混合物。当s区的适配体与毒素b结合后,释放dp1,被t区捕获作为引物开始rca反应。在c区(图14)打印10uφ29聚合酶,1μl cdt2(10μm),1μl dp2(1μm),1μl dntps(10mm),1μl血红素(100μm),5μl普鲁兰糖(10%,w/v)的反应试剂混合物,利用由s区释放的mg
2+
启动rca反应。这两层通过一张有疏水膜的卡片作为支撑物组装在一起,两层之间由滤纸开放通道(长0.5cm,宽0.3cm)连接。
[0091]
两个区域的rca产物被设计为由类过氧化物酶脱氧核酶pw17的重复单元组成,能够在h2o2存在时氧化tmb产生比色信号。c区为对照区,总会产生比色信号,而t区只有在样品中检测到毒素b时才会产生信号。
[0092]
(4)毒素b的检测。
[0093]
将纸基分析器件的两层反向对折(折叠方式如图15左1图所示,折叠后两层的圆形区域朝向相同方向),在s区加入50μl含降解毒素b(0.6-60nm)的毒素b结合缓冲液,孵育15min,展开纸装置(如图15左2图),两层由滤纸开放通道连接,液体沿滤纸开放通道流动,进入t区和c区(如图15左3图),5min后区域中反应试剂包被的普鲁兰糖膜被溶解。将纸装置折回至原样,使t区和c区位于上层,滤纸开放通道断开(如图15左4图),室温下进行15min rca反应后,加入1μl 40mm h2o2和1μl 20mm四甲基联苯胺(tmb)启动比色反应。用相机记录1min内比色结果,用imagej进行分析。
[0094]
分析结果证明t区颜色强度与降解毒素b的浓度成正比。可以通过测定θ值进行定量,定义θ=it/ic(it和ic分别是t区和c区测量到的颜色强度)。rca时间为15min时,检出限为600pm。当rca时间达到30min时,设备检出限为60pm(图16)。而用gdh(谷氨酸脱氢酶)和毒
素a检测时未见明显信号变化(图17)。
[0095]
(5)粪便样本中b毒素的检测
[0096]
50μl未成形的粪便样本(来自人类,未成形粪便指的是粪便粘稠,糊状)与100μl样本稀释液(simple diluent购自pro-lab diagnostics)混合,涡旋30s至完全乳化,经0.45μm孔径滤膜过滤后,4℃储存备用。将50μl含有不同浓度毒素b的2
×
毒素b结合缓冲液与等体积上述处理后的粪便样品混合,按照(3)中方法进行检测。
[0097]
用纸基器件分别对天然毒素b和降解毒素b进行检测。经30min rca反应,该器件对两种毒素的检出限分别为600pm和60pm。
[0098]
(6)艰难梭菌菌株的检测
[0099]
以枯草芽孢杆菌168菌株(atcc 23857)作为对照,对艰难梭菌nap1菌株(atcc baa-1803)进行检测。枯草芽孢杆菌在lb培养基中培养,艰难梭菌在碎肉葡萄糖肉汤培养基中培养,37℃培养至od
600
=1。11000g离心5min收集胞外粗提液,90℃加热10min,经0.45μm孔径滤膜浓缩至1ml,-20℃保存。按照步骤(3)中的方法进行检测。
[0100]
每毫升含104个艰难梭菌样品在rca处理30min后,与每毫升含106个枯草芽孢杆菌的缓冲液对照相比,颜色发生了明显的变化(图18)。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


