一类具有标记功能用于超分辨成像的亚硝基笼化罗丹明衍生物及应用的制作方法
 2021-02-02 07:02:34|
2021-02-02 07:02:34| 275|
275| 起点商标网
起点商标网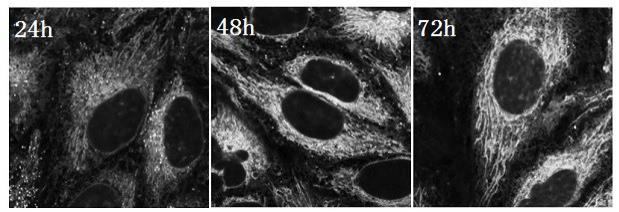
[0001]
本发明涉及一类具有标记功能用于超分辨成像的亚硝基笼化罗丹明衍生物及应用,属于精细化工领域。
背景技术:
[0002]
超分辨成像技术由于其在细胞成像上打破了传统光学显微镜的光学衍射极限(200nm),因此被科学家广泛的关注并应用其观察更多的细胞内各细胞器结构及了解生理活动过程的更多细节。超分辨成像对荧光染料有着较高的要求,不仅要求染料具有较高的荧光亮度、稳定性、膜通透性,还要求染料具有优异的特异性。因此,目前能真正用于超分辨成像上的染料仍较为匮乏。在已应用于超分辨成像上的染料中,笼化罗丹明可作为一类具有突出性能的优异染料,科学家们也在不断的对笼化罗丹明进行改进以进一步提高笼化罗丹明的成像性能。常用的笼化基团为邻硝基苄基基团,该基团可连接到罗丹明母体上并使罗丹明处于螺环形式无荧光发射,当被光照射或生理条件刺激下可将邻硝基苄基基团脱落释放出荧光,实现从无荧光发射到有荧光发射的一个转变,这种差异对于超分辨成像是有利的。但邻硝基苄基笼化的罗丹明通常需要紫外光来对其进行激活,紫外光的应用增加了光毒性以及成像时细胞的自发荧光信号,因此如何避免使用紫外光激活笼化型罗丹明也是一项挑战。
[0003]
杨有军课题组第一次将亚硝基笼化策略应用到罗丹明染料上。该策略简化了笼化基团并可实现超分辨成像。但其只能对罗丹明染料在细胞内本身所聚集的结构进行标记成像,无法对细胞内其他结构进行标记及成像。
技术实现要素:
[0004]
本发明利用亚硝基笼化罗丹明可进行超分辨成像的优点,通过羧基、溴取代增加其衍生位点,通过羧基与氨基的缩合反应或偶联反应将对细胞结构有特定靶向的分子连接到罗丹明上,可以实现对细胞内线粒体、内质网、细胞核、微管等不同亚细胞器的特定标记以及超分辨成像,实现了在纳米级上观察细胞内各细胞器的结构及生理过程。
[0005]
本发明提供一类具有标记功能用于超分辨成像的亚硝基笼化罗丹明衍生物,该衍生物具有如下结构通式:
[0006][0007]
其中,x=o、c(ch3)2或者si(ch3)2。
[0008]
r1各自独立的为
--
c
n
h
2n+1
、
--
c
n
h
2n
cooh、
--
c
n
h
2n
so3h或与同侧n原子、r2和苯环上碳
原子构成的六元环状结构。
[0009]
r2各自独立的为h或ch3。
[0010]
r3为为其中:x-为阴离子,所述阴离子为bf
4-、cl-、br-、i-、no
3-、so
42-、clo
4-、ch3coo-、ch3so
3-或cf3so
3-,所带正电荷总数等于阴离子x-所带负电荷总数。
[0011]
r4为
--
c
n
h
2n+1
或与同侧n原子及苯环上碳原子构成的六元环状结构。
[0012]
其中:n各自独立的为0-18的整数,m各自独立的为0-18的整数。
[0013]
r5各自独立的为各自独立的为各自独立的为r5各自独立的取代苯环上4位或5位的碳原子。
[0014]
所述的一类具有标记功能用于超分辨成像的亚硝基笼化罗丹明衍生物用于特异性标记亚细胞结构并对所标记的亚细胞结构进行超分辨成像;
[0015]
时,该衍生物可通过免疫标记方法标记到细胞内各特异性蛋白结构上,实现相应蛋白结构的成像。
[0016]
时,该衍生物可标记通过融合蛋白技术转染表达
halo蛋白的细胞,实现相应蛋白结构的成像。
[0017]
时,该衍生物可标记通过融合蛋白技术转染表达snap蛋白的细胞,实现相应蛋白结构的成像。
[0018]
时,该衍生物可标记通过融合蛋白技术转染表达clip蛋白的细胞,实现相应蛋白结构的成像。
[0019]
时,该衍生物可通过生物正交技术,与相应的具有标记底物的环辛炔/环辛烯反应进而标记到相应的亚细胞器上,实现相应结构的成像。
[0020]
时,该衍生物可通过生物正交技术,与相应的具有标记底物的环辛炔/环辛烯反应进而标记到相应的亚细胞器上,实现相应结构的成像。
[0021]
时,该衍生物用于活细胞线粒体成像。
[0022]
时,该衍生物用于活细胞溶酶体成像。
[0023]
时,该衍生物用于细胞核成像。
[0024]
时,该衍生物用于细胞肌动蛋白成像。
[0025]
时,该衍生物用于细胞膜成像。
[0026]
时,该衍生物用于细胞内质网成像。
[0027]
时,该衍生物用于细胞高尔基体成像。
[0028]
时,该衍生物用于细胞微管成像。
[0029]
本发明中,所述一类具有标记功能用于超分辨成像的亚硝基笼化罗丹明衍生物的制备流程如下:
[0030]
根据文献报道方法,首先合成具有羧基、溴等衍生基团的罗丹明,将羧基取代罗丹明笼化成亚硝基罗丹明,再将亚硝基笼化罗丹明与对细胞结构有特定靶向的分子连接,或者将溴代罗丹明与对细胞结构有特定靶向的分子连接再将该分子笼化成亚硝基罗丹明,最终获得对细胞内各细胞器具有特异性标记能力的亚硝基笼化罗丹明。合成方法如下式所示:
[0031][0032]
其中,r1、r2、r3、r4和r5的定义同结构通式中的定义,羧基和溴取代苯环上4位或5位上的碳原子,
[0033]
本发明中的亚硝基笼化罗丹明在超分辨成像上的应用流程如下:培养细胞:先将细胞转移至玻片上,待细胞繁殖至玻片面积的80%左右进行染色。细胞染色过程:将亚硝基笼化罗丹明母液用培养基稀释至1um,替换原细胞培养基,染色30min后,pbs洗去多余染料,替换成无酚红培养基,进行超分辨成像。
[0034]
本发明的有益效果:一类具有标记功能用于超分辨成像的亚硝基笼化罗丹明衍生物及应用,该类亚硝基笼化罗丹明衍生物由于其本身为无荧光状态,只有在被光照射后才能释放出罗丹明母体荧光,因此其在进行单分子定位超分辨成像时,无需提前对其进行漂白,可直接进行成像以最大程度收集染料分子所发出的光子,提高了染料的利用率。并且,通过连接具有不同标记功能的基团r5实现对不同细胞微结构进行特异性的标记,对其进行可视化研究,例如,通过羧基对特性抗体进行标记,通过四嗪基团与相应环辛炔/环辛炔底
物反应实现不同的标记目的。该类亚硝基笼化罗丹明的超分辨成像效果优异,分辨率高,适用于不同结构成像,对细胞内各结构的生理过程研究有重要的应用前景。这类亚硝基笼化罗丹明衍生物提供三种罗丹明母体结构,将羧基或溴等可进行进一步衍生的基团连接到了亚硝基笼化罗丹明上,再通过羧基与氨基的缩合反应或偶联反应将对细胞结构有特定靶向的分子连接的罗丹明上,通过改变对细胞结构有特定靶向的分子的结构能够实现对细胞内线粒体、内质网、细胞核、微管等不同亚细胞器的特定标记以及超分辨成像。通过特定的靶向标记实现对细胞内不同细胞器的标记,通过超分辨成像获得高分辨率的超分辨图像,更为细致、完整的重构出细胞内各个细胞器的结构细节及生理过程,为在纳米级上观察细胞内各细胞器的结构及生理过程提供一类工具。
附图说明
[0035]
图1是亚硝基罗丹明标记bcn-ac4mann在细胞内不同时间的分布成像图。
[0036]
图2是亚硝基罗丹明标记细胞线粒体成像图。
[0037]
图3是亚硝基罗丹明标记bcn-ac4mann在细胞膜上分布成像图。
具体实施方式
[0038]
以下结合技术方案和附图详细叙述本发明的具体实施例。本发明用以下实例加以说明但不局限于此,其中除非另有说明,所有的份数和百分数均以重量计。
[0039]
实施例1
[0040][0041]
合成4-羧基罗丹明和5-羧基罗丹明:按照文献报道的方法合成4、5-羧基取代罗丹明混合物,将4、5-羧基取代罗丹明混合物溶于甲醇中,通过液相色谱仪分离出4-羧基罗丹明和5-羧基罗丹明两个异构体。
[0042]
实施例2
[0043][0044]
合成4-溴罗丹明和5-溴罗丹明:按照文献报道的方法合成4、5-溴取代罗丹明混合物,将4、5-溴取代罗丹明混合物溶于甲醇中,通过液相色谱仪分离出4-溴罗丹明和5-溴罗丹明两个异构体。
[0045]
实施例3
[0046][0047]
合成方法:称取4-羧基罗丹明(250mg,581umol)于反应瓶中,加入冰醋酸,使罗丹明溶解,加入亚硝酸钠(120mg,1.74mmol),室温反应。tlc监测,待反应完全后加入水,用二氯甲烷萃取水相,合并有机相,减压蒸馏除去溶剂,硅胶柱色谱分离提纯得产物255mg,产率90%。产物结构通过hrms鉴定,m/z=487.1254。
[0048]
实施例4
[0049][0050]
合成方法:称取5-羧基罗丹明(250mg,581umol)于反应瓶中,加入冰醋酸,使罗丹明溶解,加入亚硝酸钠(120mg,1.74mmol),室温反应。tlc监测,待反应完全后加入水,用二氯甲烷萃取水相,合并有机相,减压蒸馏除去溶剂,硅胶柱色谱分离提纯得产物245mg,产率86%。产物结构通过hrms鉴定,m/z=487.1254。
[0051]
实施例5
[0052][0053]
合成方法:称取4-羧基罗丹明(200mg,431umol)于反应瓶中,加入冰醋酸,使罗丹明溶解,加入亚硝酸钠(91mg,1.31mmol),室温反应。tlc监测,待反应完全后加入水,用二氯甲烷萃取水相,合并有机相,减压蒸馏除去溶剂,硅胶柱色谱分离提纯得产物189mg,产率85%。产物结构通过hrms鉴定,m/z=516.1645。
[0054]
实施例6
[0055][0056]
合成方法:称取4-羧基罗丹明(200mg,309umol)于反应瓶中,加入冰醋酸,使罗丹
明溶解,加入亚硝酸钠,室温反应。tlc监测,反应完全加入水,用二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得产物172mg,产率86%。产物结构通过hrms,m/z=648.0468。
[0057]
实施例7
[0058][0059]
合成方法:称取4-羧基罗丹明(30mg,55umol)于反应瓶中,加入冰醋酸,使罗丹明溶解,加入亚硝酸钠,室温反应。tlc监测,反应完全加入水,用二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得产物28mg,产率85%。产物结构通过hrms鉴定,m/z=880.5714。
[0060]
实施例8
[0061][0062]
合成方法参照实施例3。产物结构通过hrms鉴定,m/z=527.1488。
[0063]
实施例9
[0064][0065]
合成方法参照实施例3。产物结构通过hrms鉴定,m/z=527.1488。
[0066]
实施例10
[0067][0068]
合成方法:称取罗丹明(50mg,96umol)于反应瓶中,加入冰醋酸,充分搅拌使罗丹明溶解,加入亚硝酸钠,室温反应。tlc监测,反应完全加入水,用二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得产物44mg,产率80%。产物结构通过hrms鉴定,m/z=595.1135。
[0069]
实施例11
[0070][0071]
合成方法参照实施例11。产物结构通过hrms鉴定,m/z=595.1135。
[0072]
实施例12
[0073][0074]
合成方法参照实施例3。产物结构通过hrms鉴定,m/z=526.1978。
[0075]
实施例13
[0076][0077]
合成方法参照实施例3。产物结构通过hrms鉴定,m/z=526.1978。
[0078]
实施例14
[0079][0080]
合成方法:称取4-羧基罗丹明(100mg,178umol)于反应瓶中,加入冰醋酸,使罗丹明充分溶解后,分批加入亚硝酸钠,室温反应。通过tlc监测,待反应完全后加入水,用二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得产物91mg,产率86%。产物结构通过hrms鉴定,m/z=606.1546。
[0081]
实施例15
[0082][0083]
合成方法参照实施例3。产物结构通过hrms鉴定,m/z=545.1856。
[0084]
实施例16
[0085][0086]
合成方法参照实施例3。产物结构通过hrms鉴定,m/z=573.2169。
[0087]
实施例17
[0088][0089]
合成方法参照实施例3。产物结构通过hrms鉴定,m/z=582.2424。
[0090]
实施例18
[0091][0092]
合成方法参照实施例3。产物结构通过hrms鉴定,m/z=529.2087。
[0093]
实施例19
[0094][0095]
合成方法参照实施例6。产物结构通过hrms鉴定,m/z=689.1223。
[0096]
实施例20
[0097][0098]
将亚硝基笼化的罗丹明(30mg,61umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(6mg),n,n-二异丙基乙胺,室温反应。tlc监测,反应完全。加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物25mg,产率70%。产物结构通过hrms鉴定,m/z=585.1496。该目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0099]
实施例21
[0100][0101]
合成方法参照实施例20,产物结构通过hrms鉴定,m/z=613.1809。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0102]
实施例22
[0103][0104]
将亚硝基笼化的罗丹明(20mg,30umol)于反应瓶中,加入dmf中充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(5mg),n,n-二异丙基乙胺,室温反应。tlc监测,反应完全。加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物
17mg,产率75%。产物结构通过hrms鉴定,m/z=745.0632。得到的目标化合物通过增加两个磺酸基使得其水溶性大大增加,该目标化合物能够很好的在水溶液中与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0105]
实施例23
[0106][0107]
将亚硝基笼化的罗丹明(20mg,33umol)于反应瓶中,加入dmso中充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(5mg),n,n-二异丙基乙胺,室温反应。tlc监测,反应完全。加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物16.7mg,产率72%。产物结构通过hrms鉴定,m/z=697.2748。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0108]
实施例24
[0109][0110]
将亚硝基笼化的罗丹明(40mg,80mg)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(8mg),n,n-二异丙基乙胺,室温反应。tlc监测,反应完全。加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物39mg,产率39%。产物结构通过hrms鉴定,m/z=608.1907。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0111]
实施例25
[0112][0113]
合成方法参照实施例20。产物结构通过hrms鉴定,m/z=627.1785。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0114]
实施例26
[0115][0116]
合成方法参照实施例20。产物结构通过hrms鉴定,m/z=627.1785。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0117]
实施例27
[0118][0119]
合成方法参照实施例20。产物结构通过hrms鉴定,m/z=655.2098。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0120]
实施例28
[0121][0122]
合成方法参照实施例20。产物结构通过hrms鉴定,m/z=655.2098。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0123]
实施例29
[0124][0125]
合成方法参照实施例20。产物结构通过hrms鉴定,m/z=611.2016。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0126]
实施例30
[0127][0128]
合成方法参照实施例20。产物结构通过hrms鉴定,m/z=611.2016。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0129]
实施例31
[0130][0131]
将亚硝基笼化的罗丹明(20mg,59umol)于反应瓶中,加入dmf中充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(5mg),n,n-二异丙基乙胺,室温反应。tlc监测,反应完全。加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物32mg,产率70%。产物结构通过hrms鉴定,m/z=771.1152。得到的目标化合物能够与蛋白上的氨基基团反应后标记到相应蛋白结构上,通过超分辨成像可观察到相应蛋白结构的分布。
[0132]
实施例32
[0133][0134]
将亚硝基笼化的罗丹明(15mg,30mg)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将halo-nh2(文献已报道的已知产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物14.6mg,产率70%。产物结构通过hrms鉴定,m/z=693.2565。所得目标化合物能够对表达halo蛋白的细胞进行特定标记,实现对halo蛋白所在位置进行超分辨成像。
[0135]
实施例33
[0136][0137]
合成方法参照实施例32。产物结构通过hrms鉴定,m/z=693.2565。所得目标化合物能够对表达halo蛋白的细胞进行特定标记,实现对halo蛋白所在位置进行超分辨成像.
[0138]
实施例34
[0139][0140]
将亚硝基笼化的罗丹明(20mg,39mg)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3.5mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将halo-nh2(文献已报道的已知产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物20.6mg,产率75%。产物结构通过hrms鉴定,m/z=716.2977。所得目标化合物能够对表达halo蛋白的细胞进行特定标记,实现对halo蛋白所在位置进行超分辨成像。
[0141]
实施例35
[0142][0143]
将亚硝基笼化的罗丹明(10mg,18.8umol)于反应瓶中,加入二氯甲烷充分搅拌,加
入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将halo-nh2(文献已报道的已知产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标物9.4mg,产率72%。产物结构通过hrms鉴定,m/z=735.2855。所得目标物能够对表达halo蛋白的细胞进行特定标记,实现对halo蛋白所在位置进行超分辨成像。
[0144]
实施例36
[0145][0146]
合成方法参照实施例32。产物结构通过hrms鉴定,m/z=735.2855。通过将罗丹明和halo-nh2缩合获得的目标化合物能够对表达halo蛋白的细胞进行特定标记,实现对halo蛋白所在位置进行超分辨成像。
[0147]
实施例37
[0148][0149]
合成方法参照实施例32。产物结构通过hrms鉴定,m/z=719.3086。通过将罗丹明和halo-nh2缩合获得的目标化合物能够对表达halo蛋白的细胞进行特定标记,实现对halo蛋白所在位置进行超分辨成像。
[0150]
实施例38
[0151][0152]
合成方法参照实施例32。产物结构通过hrms鉴定,m/z=719.3086。通过将罗丹明和halo-nh2缩合获得的目标化合物能够对表达halo蛋白的细胞进行特定标记,实现对halo蛋白所在位置进行超分辨成像。
[0153]
实施例39
[0154][0155]
将亚硝基笼化的罗丹明(15mg,30.7umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将snap-nh2(文献已报道的已知产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物17mg,产率75%。产物结构通过hrms鉴定,m/z=740.2455。所得目标化合物可对表达snap蛋白的细胞进行特定标记,实现对snap蛋白所在位置进行超分辨成像。
[0156]
实施例40
[0157][0158]
合成方法参照实施例39。产物结构通过hrms鉴定,m/z=740.2455。通过将罗丹明和snap-nh2缩合获得的目标化合物能够对表达snap蛋白的细胞进行特定标记,实现对snap蛋白所在位置进行超分辨成像。
[0159]
实施例41
[0160][0161]
合成方法参照实施例39。产物结构通过hrms鉴定,m/z=766.2976。通过将罗丹明和snap-nh2缩合获得的目标化合物能够对表达snap蛋白的细胞进行特定标记,实现对snap蛋白所在位置进行超分辨成像。
[0162]
实施例42
[0163][0164]
合成方法参照实施例39。产物结构通过hrms鉴定,m/z=766.2976。通过将罗丹明
和snap-nh2缩合获得的目标化合物能够对表达snap蛋白的细胞进行特定标记,实现对snap蛋白所在位置进行超分辨成像。
[0165]
实施例43
[0166][0167]
将亚硝基笼化的罗丹明(6mg,11.3umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(2mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将snap-nh2(文献已报道的已知产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标产物7mg,产率80%。产物结构通过hrms鉴定,m/z=782.2745。所得目标产物能够对表达snap蛋白的细胞进行特定标记,实现对snap蛋白所在位置进行超分辨成像。
[0168]
实施例44
[0169][0170]
合成方法参照实施例39。产物结构通过hrms鉴定,m/z=782.2745。通过将罗丹明和snap-nh2缩合获得的目标化合物能够对表达snap蛋白的细胞进行特定标记,实现对snap蛋白所在位置进行超分辨成像。
[0171]
实施例45
[0172][0173]
合成方法参照实施例39。产物结构通过hrms鉴定,m/z=810.3058。通过将罗丹明和snap-nh2缩合获得的目标化合物能够对表达snap蛋白的细胞进行特定标记,实现对snap蛋白所在位置进行超分辨成像。
[0174]
实施例46
[0175][0176]
将亚硝基笼化的罗丹明(15mg,30.7umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将hoechst-nh2(文献已报道的已知产品)溶于dmso中,加入到反应液中,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物21mg,产率70%。产物结构通过hrms鉴定,m/z=907.3554。所得目标化合物能够通过hoechst对细胞核进行靶向标记,实现对细胞核的超分辨成像。
[0177]
实施例47
[0178][0179]
合成方法参照实施例46。产物结构通过hrms鉴定,m/z=907.3554。通过将罗丹明和hoechst-nh2缩合获得的目标化合物能够对细胞核进行特定标记,实现对细胞核的超分辨成像。
[0180]
实施例48
[0181][0182]
合成方法参照实施例46。产物结构通过hrms鉴定,m/z=933.4075。通过将罗丹明和hoechst-nh2缩合获得的目标化合物能够对细胞核进行特定标记,实现对细胞核的超分辨成像。
[0183]
实施例49
[0184][0185]
合成方法参照实施例46。产物结构通过hrms鉴定,m/z=933.4075。通过将罗丹明和hoechst-nh2缩合获得的目标化合物能够对细胞核进行特定标记,实现对细胞核的超分辨成像。
[0186]
实施例50
[0187][0188]
合成方法参照实施例46。产物结构通过hrms鉴定,m/z=977.4157。通过将罗丹明和hoechst-nh2缩合获得的目标化合物能够对细胞核进行特定标记,实现对细胞核的超分辨成像。
[0189]
实施例51
[0190][0191]
合成方法参照实施例46。产物结构通过hrms鉴定,m/z=949.3844。通过将罗丹明和hoechst-nh2缩合获得的目标化合物能够对细胞核进行特定标记,实现对细胞核的超分辨成像。
[0192]
实施例52
[0193][0194]
合成方法参照实施例46。产物结构通过hrms鉴定,m/z=949.3844。通过将罗丹明和hoechst-nh2缩合获得的目标化合物能够对细胞核进行特定标记,实现对细胞核的超分辨成像。
[0195]
实施例53
[0196][0197]
将亚硝基笼化的罗丹明(15mg)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二
甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将紫杉醇(商品化产品)溶于dmso中,加入到反应液中,室温反应。tlc监测反应完全,减压蒸馏除去溶剂,硅胶柱色谱提纯得目标化合物。产物结构通过hrms鉴定,m/z=1177.4168。所得目标化合物能够通过紫杉醇对细胞微管结构进行靶向标记,实现对细胞微管的超分辨成像。
[0198]
实施例54
[0199][0200]
合成方法参照实施例53。产物结构通过hrms鉴定,m/z=1177.4168。通过将罗丹明和紫杉醇缩合获得的目标化合物能够对细胞微管结构进行靶向标记,实现对细胞微管的超分辨成像。
[0201]
实施例55
[0202][0203]
将亚硝基笼化的罗丹明(8mg)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将紫杉醇(商品化产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全,减压蒸馏除去溶剂,硅胶柱色谱分离提纯得目标产物。产物结构通过hrms鉴定,m/z=1203.4688。所得目标产物能够通过紫杉醇对细胞微管结构进行靶向标记,实现对微管的超分辨成像。
[0204]
实施例56
[0205][0206]
合成方法参照实施例55。产物结构通过hrms鉴定,m/z=1177.4168。通过将罗丹明和紫杉醇缩合获得的目标化合物能够对细胞微管结构进行靶向标记,实现对细胞微管的超分辨成像。
[0207]
实施例57
[0208][0209]
合成方法参照实施例55。产物结构通过hrms鉴定,m/z=1219.4458。通过将罗丹明和紫杉醇缩合获得的目标化合物能够对细胞微管结构进行靶向标记,实现对细胞微管的超分辨成像。
[0210]
实施例58
[0211][0212]
合成方法参照实施例55。产物结构通过hrms鉴定,m/z=1247.4771。通过将罗丹明和紫杉醇缩合获得的目标化合物能够对细胞微管结构进行靶向标记,实现对细胞微管的超分辨成像。
[0213]
实施例59
[0214][0215]
将亚硝基笼化的罗丹明(15mg,30.7umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将鬼笔环肽(商品化产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全,减压蒸馏除去溶剂,硅胶柱色谱分离提纯得目标化合物29.4mg,产率76%。产物结构通过hrms鉴定,m/z=1159.5379。所得目标化合物能够通过鬼笔环肽对细胞机动蛋白结构进行靶向标记,实现对机动蛋白的超分辨成像。
[0216]
实施例60
[0217][0218]
合成方法参照实施例59。产物结构通过hrms鉴定,m/z=1159.5379。通过将罗丹明和鬼笔环肽缩合获得的目标化合物能够对细胞中肌动蛋白进行特定标记,实现对细胞肌动蛋白的超分辨成像。
[0219]
实施例61
[0220][0221]
将亚硝基笼化的罗丹明(8mg,15.5umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将鬼笔环肽(商品化产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全,减压蒸馏出去溶剂,硅胶柱色谱分离提纯得目标产物16mg,产率80%。产物结构通过hrms鉴定,m/z=1185.5899。所得目标产物能够通过鬼笔环肽对细胞机动蛋白结构进行靶向标记,实现对机动蛋白的超分辨成像。
[0222]
实施例62
[0223]
[0224]
合成方法参照实施例59。产物结构通过hrms鉴定,m/z=1185.5899。通过将罗丹明和鬼笔环肽缩合获得的目标化合物能够对细胞中肌动蛋白进行特定标记,实现对细胞肌动蛋白的超分辨成像。
[0225]
实施例63
[0226][0227]
合成方法参照实施例59。产物结构通过hrms鉴定,m/z=1213.6212。通过将罗丹明和鬼笔环肽缩合获得的目标化合物能够对细胞中肌动蛋白进行特定标记,实现对细胞肌动蛋白的超分辨成像。
[0228]
实施例64
[0229][0230]
合成方法参照实施例59。产物结构通过hrms鉴定,m/z=1201.5668。通过将罗丹明和鬼笔环肽缩合获得的目标化合物能够对细胞中肌动蛋白进行特定标记,实现对细胞肌动蛋白的超分辨成像。
[0231]
实施例65
[0232][0233]
合成方法参照实施例59。产物结构通过hrms鉴定,m/z=1201.5668。通过将罗丹明和鬼笔环肽缩合获得的目标化合物能够对细胞中肌动蛋白进行特定标记,实现对细胞肌动蛋白的超分辨成像。
[0234]
实施例66
[0235][0236]
将亚硝基笼化的罗丹明(8mg,16.4umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将五氟苯甲酸(商品化产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全,减压蒸馏出去溶剂,硅胶柱色谱分离提纯得目标产物9.4mg,产率78%。产物结构通过hrms鉴定,m/z=738.1861。所得目标产物能够通过五氟苯基对细胞内质网结构进行靶向标记,实现对内质网的超分辨成像。
[0237]
实施例67
[0238][0239]
合成方法参照实施例66。产物结构通过hrms鉴定,m/z=738.1861。所得目标产物能够通过五氟苯基对细胞内质网结构进行靶向标记,实现对内质网的超分辨成像。
[0240]
实施例68
[0241][0242]
合成方法参照实施例66。产物结构通过hrms鉴定,m/z=764.2382。所得目标产物能够通过五氟苯基对细胞内质网结构进行靶向标记,实现对内质网的超分辨成像。
[0243]
实施例69
[0244][0245]
合成方法参照实施例66。产物结构通过hrms鉴定,m/z=764.2382。所得目标产物能够通过五氟苯基对细胞内质网结构进行靶向标记,实现对内质网的超分辨成像。
[0246]
实施例70
[0247][0248]
将亚硝基笼化的罗丹明(8mg,15.5umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。
tlc监测,反应完全。将五氟苯甲酸(商品化产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全,减压蒸馏出去溶剂,硅胶柱色谱分离提纯得目标产物10.6mg,产率75%。产物结构通过hrms鉴定,m/z=909.3253。所得目标产物能够通过五氟苯基对细胞内质网结构进行靶向标记,实现对内质网的超分辨成像。
[0249]
实施例71
[0250][0251]
合成方法参照实施例70。产物结构通过hrms鉴定,m/z=909.3253。所得目标产物能够通过吲哚美西对细胞高尔基体结构进行靶向标记,实现对高尔基体的超分辨成像。
[0252]
实施例72
[0253][0254]
合成方法参照实施例70。产物结构通过hrms鉴定,m/z=925.3022。所得目标产物能够通过吲哚美西对细胞高尔基体结构进行靶向标记,实现对高尔基体的超分辨成像。
[0255]
实施例73
[0256][0257]
合成方法参照实施例70。产物结构通过hrms鉴定,m/z=953.3335。所得目标产物能够通过吲哚美西对细胞高尔基体结构进行靶向标记,实现对高尔基体的超分辨成像。
[0258]
实施例74
[0259][0260]
将亚硝基笼化的罗丹明(8mg,15umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将多肽(商品化产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全,减压蒸馏出去溶剂,硅胶柱色谱分离提纯得目标产物13mg,产率70%。产物结构通过hrms鉴定,m/z=1283.7350。所得目标产物能够通过多肽对细胞溶酶体结构进行靶向标记,实现对溶酶体的超分辨成像。
[0261]
实施例75
[0262]
[0263]
将亚硝基笼化的罗丹明(6mg,11.3umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(2mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将snap-nh2(文献已报道的已知产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标产物5mg,产率60%。产物结构通过hrms鉴定,m/z=742.2684。通过将罗丹明和clip-nh2缩合获得的目标化合物能够对表达clip蛋白的细胞进行特定标记,实现对clip蛋白所在位置进行超分辨成像。
[0264]
实施例76
[0265][0266]
合成方法参照实施例75。产物结构通过hrms鉴定,m/z=742.2684。通过将罗丹明和clip-nh2缩合获得的目标化合物能够对表达clip蛋白的细胞进行特定标记,实现对clip蛋白所在位置进行超分辨成像。
[0267]
实施例77
[0268][0269]
合成方法参照实施例75。产物结构通过hrms鉴定,m/z=726.2914。通过将罗丹明和clip-nh2缩合获得的目标化合物能够对表达clip蛋白的细胞进行特定标记,实现对clip蛋白所在位置进行超分辨成像。
[0270]
实施例78
[0271][0272]
合成方法参照实施例75。产物结构通过hrms鉴定,m/z=726.2914。通过将罗丹明和clip-nh2缩合获得的目标化合物能够对表达clip蛋白的细胞进行特定标记,实现对clip蛋白所在位置进行超分辨成像。
[0273]
实施例79
[0274][0275]
合成方法参照实施例75。产物结构通过hrms鉴定,m/z=700.2394。通过将罗丹明和clip-nh2缩合获得的目标化合物能够对表达clip蛋白的细胞进行特定标记,实现对clip蛋白所在位置进行超分辨成像。
[0276]
实施例80
[0277][0278]
合成方法参照实施例75。产物结构通过hrms鉴定,m/z=700.2394。通过将罗丹明和clip-nh2缩合获得的目标化合物能够对表达clip蛋白的细胞进行特定标记,实现对clip蛋白所在位置进行超分辨成像。
[0279]
实施例81
[0280][0281]
将亚硝基笼化的罗丹明(6mg,11.3umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(2mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将三苯基磷-nh2(文献已报道的已知产品)溶于dmso中,加入到反应液,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标产物7mg,产率80%。产物结构通过hrms鉴定,m/z=790.2789。所得目标产物能够通过三苯基磷对细胞线粒体结构进行靶向标记,实现对线粒体的超分辨成像。
[0282]
实施例82
[0283][0284]
合成方法参照实施例81。产物结构通过hrms鉴定,m/z=790.2789。所得目标产物能够通过三苯基磷对细胞线粒体结构进行靶向标记,实现对线粒体的超分辨成像。
[0285]
实施例83
[0286][0287]
合成方法参照实施例81。产物结构通过hrms鉴定,m/z=816.3309。所得目标产物能够通过三苯基磷对细胞线粒体结构进行靶向标记,实现对线粒体的超分辨成像。
[0288]
实施例84
[0289][0290]
合成方法参照实施例81。产物结构通过hrms鉴定,m/z=816.3309。所得目标产物能够通过三苯基磷对细胞线粒体结构进行靶向标记,实现对线粒体的超分辨成像。
[0291]
实施例85
[0292][0293]
合成方法参照实施例81。产物结构通过hrms鉴定,m/z=832.3079。所得目标产物能够通过三苯基磷对细胞线粒体结构进行靶向标记,实现对线粒体的超分辨成像。
[0294]
实施例86
[0295][0296]
合成方法参照实施例81。产物结构通过hrms鉴定,m/z=832.3079。所得目标产物能够通过三苯基磷对细胞线粒体结构进行靶向标记,实现对线粒体的超分辨成像。
[0297]
实施例87
[0298][0299]
将亚硝基笼化的罗丹明(30mg,61umol)于反应瓶中,加入二氯甲烷充分搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(8mg),n,n-二异丙基乙胺,室温反应1h。tlc监测,反应完全。将tz-nh2(文献已报道的已知产品)加入到反应液,室温反应。tlc监测反应完全后加入水,二氯甲烷萃取水相,合并有机相,硅胶柱色谱分离提纯得目标化合物32.5mg,产率79%。产物结构通过hrms鉴定,m/z=671.2241。所得目标化合物能够通过生物正交反应对细胞内各目标结构进行标记,并能够实现超分辨成像。
[0300]
实施例88
[0301][0302]
合成方法参照实施例87。产物结构通过hrms鉴定,m/z=699.2554。通过将罗丹明和tz-nh2缩合获得的目标化合物能够通过与带有标记底物(如:线粒体、内质网等)的环辛烯或环辛炔进行生物正交反应而实现对细胞内各目标结构(如:线粒体、内质网等)的标记,并能够实现超分辨成像。
[0303]
实施例89
[0304][0305]
合成方法参照实施例87。产物结构通过hrms鉴定,m/z=713.2530。通过将罗丹明和tz-nh2缩合获得的目标化合物能够通过与带有标记底物(如:线粒体、内质网等)的环辛烯或环辛炔进行生物正交反应而实现对细胞内各目标结构(如:线粒体、内质网等)的标记,并能够实现超分辨成像。
[0306]
实施例90
[0307][0308]
合成方法参照实施例87。产物结构通过hrms鉴定,m/z=697.2761。通过将罗丹明和tz-nh2缩合获得的目标化合物能够通过与带有标记底物(如:线粒体、内质网等)的环辛烯或环辛炔进行生物正交反应而实现对细胞内各目标结构(如:线粒体、内质网等)的标记,并能够实现超分辨成像。
[0309]
实施例91
[0310][0311]
将溴代罗丹明(52.2mg,100umol)、四嗪硼酸酯(44.7mg,150umol)、1,1'-双二苯基膦二茂铁二氯化钯(14.6mg,20umol)、碳酸钾加入反应瓶中,抽真空置换氩气三次,加入二氧六环,90度回流反应。tlc监测反应,待反应完全,停止反应降至室温,加入水,用二氯甲烷萃取,合并有机相,硅胶柱色谱分离提纯得四嗪罗丹明。将四嗪罗丹明溶于冰醋酸中,加入亚硝酸钠,室温反应,待反应完全,加入水,二氯甲烷萃取,硅胶柱色谱分离提纯得产物39.9mg,产率65%。产物结构通过hrms鉴定,m/z=614.2026。所得目标化合物通过与带有标记底物(如:线粒体、内质网等)的环辛烯或环辛炔进行生物正交反应而实现对细胞内各目标结构(如:线粒体、内质网等)的标记,并能够实现超分辨成像。
[0312]
实施例92
[0313][0314]
合成方法参照实施例91。产物结构通过hrms鉴定,m/z=640.2547。所得目标化合物通过与带有标记底物(如:线粒体、内质网等)的环辛烯或环辛炔进行生物正交反应而实现对细胞内各目标结构(如:线粒体、内质网等)的标记,并能够实现超分辨成像。
[0315]
实施例93
[0316][0317]
合成方法参照实施例91。产物结构通过hrms鉴定,m/z=656.2316。所得目标化合物通过与带有标记底物(如:线粒体、内质网等)的环辛烯或环辛炔进行生物正交反应而实现对细胞内各目标结构(如:线粒体、内质网等)的标记,并能够实现超分辨成像。
[0318]
实施例94
[0319]
合成方法参照实施例91。产物结构通过hrms鉴定,m/z=640.2547。所得目标化合物通过与带有标记底物(如:线粒体、内质网等)的环辛烯或环辛炔进行生物正交反应而实
现对细胞内各目标结构(如:线粒体、内质网等)的标记,并能够实现超分辨成像。
[0320]
实施例95
[0321]
对实施例91所得到的目标化合物进行染色及超分辨成像:
[0322]
细胞培养:将细胞转移至玻璃片上培养,分别在三个玻片上培养12小时后,将bcn-ac4mann加入至细胞培养基中,分别继续培养细胞24小时、48小时、72小时后,用pbs换洗培养基。将亚硝基罗丹明加入至细胞培养基配制成2um浓度对细胞进行染色,染色30min后。用pbs换洗培养基,加入无酚红培养基成像。亚硝基罗丹明可与bcn-ac4mann进行反应(生物正交标记),将亚硝基笼化罗丹明染入细胞,标记bcn-ac4mann在细胞内的分布,成像结果如图1所示。从图1可观察到通过用含有bcn-ac4mann的培养基孵育细胞的时间不同,bcn-ac4mann的分布也有所不同。孵育24小时的成像结果表明bcn-ac4mann主要分布于线粒体和内质网结构上,当孵育48小时时线粒体和内质网的结构仍存在但信噪比有所下降,而孵育72小时成像时细胞膜结构逐渐显现出来。通过该类成像可追踪bcn-ac4mann在细胞代谢过程中不同时间段的分布。
[0323]
实施例84
[0324]
对实施例91所得到的目标化合物进行染色及超分辨成像:
[0325]
细胞培养:将细胞转移至玻璃片上培养,培养12小时后,将bcn-tpp(线粒体靶向标记物)加入至细胞培养基中,染色30分钟,用pbs换洗培养基。将亚硝基罗丹明加入细胞培养基配制成500nm浓度对细胞进行染色,染色30min后。用pbs换洗培养基,加入无酚红培养基成像,亚硝基罗丹明可与bcn-tpp进行反应(生物正交标记),将亚硝基笼化罗丹明染入细胞,标记到细胞的线粒体,成像结果如图2所示。超分辨重构图展示出了线粒体棒状的结构特征,可对活细胞线粒体实现高分辨率的超分辨并探究线粒体更为细致的结构。
[0326]
实施例85
[0327]
对实施例91所得到的目标化合物进行染色及超分辨成像:
[0328]
细胞培养:将细胞转移至玻璃片上培养,在玻片上培养12小时后,将bcn-ac4mann加入至细胞培养基中,分别继续培养细胞72小时后,用pbs换洗培养基。将亚硝基罗丹明加入至细胞培养基配制成2um浓度对细胞进行染色,染色30min后。用pbs换洗培养基,加入无酚红培养基成像。亚硝基罗丹明可与bcn-ac4mann进行反应(生物正交标记),将亚硝基笼化罗丹明染入细胞,标记到bcn-ac4mann在细胞内的分部,成像结果如图3所示。通过tirf场对细胞膜进行成像,重构出了bcn-ac4mann通过细胞代谢在细胞膜上的分布及聚集。
[0329]
实施例86
[0330]
本发明其它目标化合物的测试结果以如下表格的形式列出:
[0331][0332]
[0333]
[0334]
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


