一种用于鉴别DHAV-1野毒和疫苗弱毒的鉴别诊断方法与流程
 2021-02-02 06:02:52|
2021-02-02 06:02:52| 329|
329| 起点商标网
起点商标网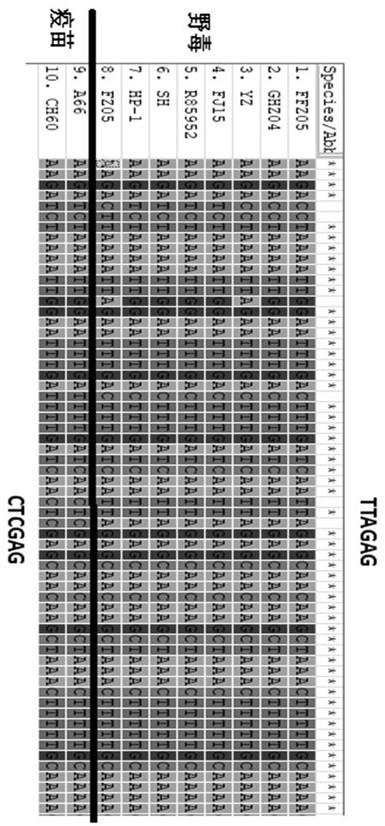
一种用于鉴别dhav-1野毒和疫苗弱毒的鉴别诊断方法
技术领域
[0001]
本发明属于动物传染病学领域,具体涉及一种用于鉴别dhav-1野毒和疫苗弱毒的鉴别诊断方法。
背景技术:
[0002]
当前,引起雏鸭病毒性肝炎的病原为鸭甲肝病毒(duck hepatitis a virus,dhav),属小rna病毒科(picornaviridae)禽肝病毒属(avihepatovirus)成员,分为三种基因型:dhav-1,dhav-2和dhav-3。dhav病毒完整基因组长约7.7kb,单股正链rna。基因组rna由5
’
非编码区(untranslated region, utr)、一个开放阅读框(orf)、3
’
utr 和 poly(a)尾巴组成,它作为遗传物质稳定传代的同时还可以直接作为mrna指导合成一条完整的病毒多肽链(polyprotein)(即开放阅读框orf)。5
’-
utr长626nt,含有丰富的二级结构。dhav 的 3
′-
utr 长为 314~317nt,为已知小 rna 病毒科成员中3
′-
utr 最长的病毒。dhav的orf可进一步切割形成l-vp0-vp3-vp1-2a1-2a2-2b-2c-3a-3b-3c-3d。
[0003]
关于dhav各地的流行病学数据存在较大差异,1945年,第一株鸭病毒性肝炎病毒(即dhav-1)发现于美国纽约长岛鸭场。1950年,levine和fabricant从鸡胚中首次分离到鸭病毒性肝炎病原,随后世界上很多国家相继报道了dhav-1的流行。在我国,1963年上海畜牧研究所的黄均建首次报道了鸭病毒性肝炎发现于上海;1980年,王平等在北京地区分离到了第一株dhav-1。随后,浙江、福建等地都先后报道了dhav-1的发生和流行。dhav-1 病毒主要由衣壳和核酸组成。生物信息学分析表明,基因组由5
’
端非编码 区、一个大的开放阅读框、及 3
’
端非编码区组成。orf 编码含 2249 个氨基酸的多聚蛋白,编码的多聚蛋白在病毒包装过程中,先进行自我切割,最终裂解为3种结构蛋白 (vp0、vp3和vp1) 和7种非结构蛋白 (2a、2b、2c、3a、3b、3c和3d)。其中,vp1 全长 714bp,编码238个氨基酸,是dhav-1最重要的结构蛋白之一。对其他小 rna 病毒的研究表明,vp1 蛋白位于病毒最外部,是病毒中占有优势的表面结构蛋白,含有多个抗原表位和关键的抗原决定簇,能诱导机体产生中和抗体,从而产生免疫反应,因而被认为是检测感染该病毒的最可靠的指示器。
[0004]
目前我国研制的鸭肝炎鸡胚化弱毒疫苗,在全国应用推广,对种鸭、雏鸭进行免疫预防,取得很好的效果。但当前国内外尚未见鸭1型甲肝病毒野毒和疫苗弱毒的检测试剂盒及其检测方法相关研究报道,本发明的建立可填补国内外相关领域空白。
技术实现要素:
[0005]
本发明的目的在于提供一种用于鉴别dhav-1野毒和疫苗弱毒的鉴别诊断引物及试剂盒,具有很高的特异性和灵敏度。建立的方法能够对鸭群中鸭1型甲肝病毒野毒和疫苗弱毒感染情况进行检测,简化操作程序、节约成本。
[0006]
为实现上述目的,本发明采用如下技术方案:一种用于鉴别dhav-1野毒和疫苗弱毒的鉴别诊断引物,所述引物为:dhav-1wv-f1:5
’-
ccttgaatgttggaatcctata-3
’
,
information,ncbi)数据库genbank上dhav-1强毒株(ffz05、ghz04、yz、fj15、r85952、sh、hp-1和fz05)和dhav-1疫苗弱毒(a66株和ch60株)基因组序列进行分析,利用引物设计软件oligo 7.0设计一套引物,如下:dhav-1wv-f1:5
’-
ccttgaatgttggaatcctata-3
’
,dhav-1wv-r1:5
’-
cttcatcctcattactcacatt-3
’
。上述引物均由生工生物工程(上海)股份有限公司合成。
[0018]
需要指出的是,在使用dhav-1wv-f1/ dhav-1wv-r1均可对dhav-1强毒和dhav-1疫苗弱毒进行扩增,dhav-1强毒和dhav-1疫苗弱毒的pcr产物目的条带大小为542bp。但是在dhav-1强毒和dhav-1疫苗弱毒的扩增区域内存在特征性的xho
ꢀⅰ
酶酶切位点差异,其中dhav-1强毒为ttagag(不可被xho
ꢀⅰ
酶识别),而dhav-1疫苗弱毒在扩增区域为ctcgag(可被xho
ꢀⅰ
酶识别),大小分别为179bp和363bp,序列比对结果见图1。
[0019]
1.3 试验方法的建立1.3.1 rna的提取和cdna的制备使用病毒核酸提取试剂盒easypure viral dna/rna kit 提取dhav-1强毒、dhav-1疫苗毒、dhav-3、aiv、mdrv、n-drv、apmv-1和atmv的核酸rna,利用反转录试剂盒transscript all-in-one first-strand cdna synthesis supermix for qpcr(one-step gdna removal)制备相应的cdna,-80℃冻存备用。
[0020]
1.3.2 反应液的配置和退火温度的优化按照dreamtaq green pcr master mix(2
×
)试剂盒推荐的50μl体系进行扩增,其中2
×
pcr master mix扩增反应液25 μl、引物dhav-1wv-f1/ dhav-1wv-r1(10μm)分别为1.0 μl、制备的核酸cdna模板(dhav-1强毒、dhav-1疫苗毒)各1.0 μl、补充灭菌去离子水至终体积50μl,混匀后进行pcr扩增。
[0021]
扩增条件为95 ℃预变性5 min后进入循环,95 ℃变性30 s 、
△
t(52 ℃-62 ℃)退火30 s、72 ℃延伸35s,40个循环结束后,72℃终延伸10 min,反应结束后按照常规琼脂糖凝胶电泳鉴定。
△
t(52 ℃-62 ℃)表示退火温度在此区间进行优化,经优化后的最佳退火温度为54℃。
[0022]
结果可见(图2),当模板仅加入dhav-1强毒时,出现大小为542 bp的条带(第1泳道);当模板仅加入dhav-1疫苗毒时,出现大小为542 bp的条带(第2泳道)。
[0023]
1.3.3 特异性试验将优化后的pcr体系和扩增条件,对dhav-3、aiv、mdrv、n-drv、apmv-1、atmv以及灭菌去离子水对照进行扩增,均未见扩增条带,表明建立的方法特异性强,对常见水禽病原均无交叉反应(见图2)。
[0024]
1.3.4 酶切鉴定将pcr产物利用xho
ꢀⅰ
酶进行酶切鉴定,酶切体系为30μl体系:其中10
×
quickcut green buffer 3μl、quickcut
™ꢀ
xho
ꢀⅰ
酶3μl、pcr产物20μl,补充灭菌去离子水至终体积30μl。轻轻混匀后瞬时离心,37℃水浴反应10 min。结果可见(图3),dhav-1疫苗毒产物有两条,大小分别为179bp和363bp;dhav-1强毒产物大小不变,仍然是542bp。
[0025]
1.4 临床应用对675份临床送检鸭源病料进行dhav-1强毒和疫苗毒感染的检测,按照优化后的体系
和条件分别进行反转录和pcr扩增检测。结果发现,使用引物组(dhav-1wv-f1/ dhav-1wv-r1)扩增时,有86份阳性,阳性率为12.74%。对86份阳性pcr产物进行rflp分析可见,82份为dhav-1强毒,4份为dhav-1疫苗弱毒。将相关目的片段经克隆后序列测定分析可见,82份为dhav-1强毒在此处序列均为ttagag,符合率为100%;4份为dhav-1疫苗弱毒在此处序列均为ctcgag,符合率为100%。
[0026]
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



