OsKEAP1基因在调控水稻农艺性状和产量中的应用的制作方法
 2021-02-02 05:02:53|
2021-02-02 05:02:53| 430|
430| 起点商标网
起点商标网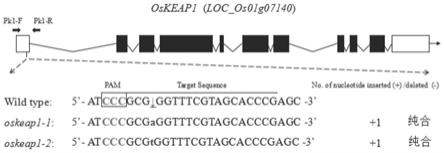
oskeap1基因在调控水稻农艺性状和产量中的应用
技术领域
[0001]
本发明涉及植物基因工程和水稻分子育种技术领域,主要涉及oskeap1基因在 调控水稻农艺性状和产量中的应用。
背景技术:
[0002]
活性氧自由基(reactive oxygen species,ros)是具有强氧化活性的含氧分子或离 子的总称,是动植物细胞中氧相关的新陈代谢的天然副产物。ros的积累与清除它们 的抗氧化剂系统之间存在的微妙平衡被称为氧化还原稳态(redox homeostasis)。在高 等植物中,ros也是盐和干旱相关胁迫中重要信号分子。ros积累和抗氧化剂清除 系统之间的不平衡可以造成氧化应激胁迫(oxidative stress,os),这将导致细胞内生 物大分子的破坏,生物组织中炎症浸润等一系列胁迫反应。
[0003]
细胞已经形成多种经典抗氧化机制用于氧化应激反应的细胞保护。作为关键的抗 氧化途径,keap1(kelch-like epichlorohydrin(ech)-associated protein1)-nrf2(nuclearfactor e2 related factor 2,nrf2)在调节细胞内氧化应激中发挥重要作用。keap1是 keap1-nrf2系统中对ros和亲电子试剂敏感的生物传感器,调控nrf2实现对其 下游细胞保护性基因主要编码应激蛋白,代谢酶,抗氧化酶,氧化还原平衡因子,异 源生物转运蛋白和ii期解毒酶的调控。在氧化还原稳态调节中发挥着不可或缺的重要 作用。尽管keap1-nrf2系统在动物系统广泛研究,但植物中是否存在相关系统尤 其是对水稻生长发育及水稻生理特征的影响却未有报导。
[0004]
由于crispr/cas9产生突变体的准确性高和效率高,因此可用于研究非常规靶 位点(如基因组中utr和内含子序列),从而使研究人员能够研究已部分调节的基因 功能,而不是致命的敲除编码区产生无义突变。keap1作为动物氧化应激反应途径 中必不可少的功能蛋白,具有重要的氧化应激调控作用,但在植物中很少进行研究。 utr区域编辑能够有效地实现基因转录和翻译的部分调节,这一特点可用于研究基因 功能的部分调整并避免重要基因敲除致死带来的研究不便。考虑到上述背景研究,本 申请利用crispr/cas9系统对oskeap1 5'utr区进行了靶向编辑,以研究其在水 稻生长发育中的生物学功能。
技术实现要素:
[0005]
本发明提供了oskeap1基因在调控水稻农艺性状中的新用途,为培育具有优良 农艺性状的水稻品种提供依据。
[0006]
具体技术方案如下:
[0007]
本发明提供了oskeap1基因在调控水稻产量中的应用,所述oskeap1基因的核 苷酸序列如seq id no.1所示;该基因全长5658bp,编码700个氨基酸的蛋白,该 蛋白含有一个植物中特有的dcd结构域,同时含有5个kelch结构。
[0008]
进一步地,所述oskeap1基因通过控制水稻结实率来调控水稻产量。
[0009]
本发明提供了oskeap1基因在调控水稻农艺性状中的应用,所述oskeap1基因 的
核苷酸序列如seq id no.1所示;
[0010]
所述农艺性状为株高、株型、水稻结实率、平均穗长和籽粒数。
[0011]
本发明利用crispr/cas9基因编辑技术获得了oskeap1基因表达水平下调的突 变体,并通过农艺性状检测发现突变体植株明显较野生型矮,育性较差,但单株穗数 相仿,单株籽粒数显著减少,仅为野生型的35.4%和58.6%,结实率分别为45.13%和 61.76%,显著低于野生型的93.60%。可能受结实率下降的影响,oskeap1-1和oskeap1-2 的小区产量相比野生型下降了62.2%和39.3%。两个突变体的平均穗长分别相比野生 型下降了22.9%和7.7%。
[0012]
进一步地,所述oskeap1基因通过控制水稻花粉育性来调控水稻结实率。
[0013]
本发明对突变系及野生型花粉育性进行分析,发现:突变体中的花粉中出现了较 高比例的不育花粉,在碘染色下显示无淀粉粒,只有黄色花粉外壳,为典败花粉,分 别占总花粉粒的15.54%和12.26%,而野生型植株的不育花粉率仅为3.86%。
[0014]
与现有技术相比,本发明具有以下有益效果:
[0015]
本发明利用crispr/cas9基因编辑技术获得了oskeap1基因表达水平下调的突 变体,发现该oskeap1基因与水稻的株高、株型、水稻结实率、平均穗长和籽粒数 等农艺性状以及产量有关,能够为培育具有优良农艺性状的水稻品种提供依据。
附图说明
[0016]
图1为人keap1和水稻同源基因信息;
[0017]
其中,a:人类keap1和水稻中同源基因的信息;b:人类keap1和水稻中同源 基因的基因结构图;c:人类keap1和水稻中同源基因的蛋白保守结构域分布,btb 结构域(蛋白结合,胁迫响应),back结构域,kelch结构域,dcd结构域(植物 特异性胁迫响应结构域)。
[0018]
图2为靶向编辑oskeap1 5'utr区域的crispr sgrna序列及突变体在编辑后 靶位点的核苷酸序列示意图。
[0019]
图3为xidao#1(wt)及其oskeap1突变体的植株形态图。
[0020]
图4为oskeap1在水稻品种xidao#1及其两个突变体幼苗(a)和抽穗期(b) 叶片组织中的相对表达;
[0021]
其中,以osactin为内参;数据为3次生物重复的平均值;不同的字母代表0.05 水平的显著性。
[0022]
图5为xidao#1(wt)及其oskeap1突变体的农艺性状与产量性状;其中,*表示 p<0.05;**表示p<0.01;student's t-test。
[0023]
图6为xidao#1(wt)及其oskeap1突变体的花粉育性。
[0024]
具体实施方式
[0025]
下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施 例,但本发明的保护范围不仅限于此。
[0026]
实施例1
[0027]
1、keap1同源基因在水稻中的鉴定与表征
[0028]
从ncbi查找获得人类keap1的基因信息及其编码的氨基酸序列,以其作为索引 序列在gramene数据库中与水稻基因组进行比对,获取水稻基因组中keap1同源基 因。在kegg数据库和rapdb数据库中对水稻keap1基因的结构及其编码蛋白的 特性进行分析,并在unipro数据库和smart数据库中分析氨基酸保守结构域。在 ricexpro软件中分析它们在植物不同组织和激素处理后表达水平的变化。
[0029]
从gramene数据库,orthodb数据库下载玉米,人类和其他10个相关物种的氨 基酸序列,以bootstrp重复数集1000为最小进化标准的nj方法,采用mega7软件 构建keap1直系同源基因系统进化树,采用泊松校正法计算进化距离。
[0030]
结果:在覆盖度较高的水稻基因组(c.v.nipponbare)中鉴定了两个keap1同源 基因:os01g0162500(序列一致性54%)和os05g0164900(序列一致性46%)。在 ncbi数据库中,前者被注释为编码一个假设的含有kelch型β螺旋桨结构域的蛋白 质,而后者则是含有kelch repeat type 1结构域的蛋白质,因此kelch域均为 keap1。然而,水稻蛋白对keap1的氨基酸鉴定得分仅为25.82%和33.46%(图1a)。
[0031]
与keap1相比,两种水稻同源基因的长度都短得多,但有更多的外显子和内含 子;keap1及其水稻同源基因在其3'端都有较长的未翻译区(utr)(图1b)。稻米 keap1同源物有5个kelch重复,而keap1有6个kelch重复。在n端,keap1 有一个btb-back结构域,而水稻同源物有一个发育和程序化细胞死亡(dcd)结 构域(图1c)。
[0032]
这些特征表明,keap1及其水稻同源基因可能保持着相似的基本功能,但对不同 的发育和环境刺激有不同的反应。
[0033]
2、oskeap1突变体的创建
[0034]
(1)基因编辑载体构建
[0035]
本发明使用的基因编辑载体为基于crispr/cas9的phun4c12。以oskeap1 5'utr的第一外显子为靶向编辑区域,利用crispr-p 2.0(http://crispr.hzau.edu.cn /crispr2/)设计编辑靶点,选择特异性和编辑效率最好的靶点序列,两端添加bsai识 别位点序列,合成正向和反向互补dna单链寡合苷酸p1和p2。
[0036]
靶向oskeap1 5'utr的正反链为:
[0037]
keap1-p1:5
’-
ggcagggtgctacgaaacccgc-3
’
(p1);
[0038]
keap1-p2:5
’-
aaacgcgggtttcgtagcaccc-3
’
(p2);
[0039]
dna正向链f和反向链r寡核苷酸稀释至100μm,在退火缓冲液(碧云天, 上海)中完成退火,形成双链。退火反应体系如下:
[0040][0041]
退火程序为:95℃2min,之后温度下降到4℃,每8sec下降0.1℃。
[0042]
退火后,用axygen dna凝胶提取试剂盒纯化dna寡合苷酸双链,具体方法 如下:
[0043]
(a)加300μl缓冲液a到100μl退火产品并轻轻混匀;
[0044]
(b)加入150μl缓冲b轻轻混匀;
[0045]
(c)将溶液转移到试剂盒提供的dna制备管,置于另一个2ml离心管中, 12,000rpm离心1min;
[0046]
(d)dna制备管转移到一个新的2ml离心管,并加入500μl w1缓冲液, 离心12,000rpm 30sec,弃上清;
[0047]
(e)加入700μl w2缓冲液,离心12,000rpm 30sec,弃上清;
[0048]
(f)重复步骤5;
[0049]
(g)再次以12,000rpm离心1min;
[0050]
(h)将dna制备管转移至新的1.5ml离心管中,置于室温;
[0051]
(i)加10μl-20μl洗脱液离心12,000rpm 30s,检测核酸浓度。
[0052]
phun4c12载体用限制性内切酶bsai(neb,北京)酶切形成线性化双链,反应 体系如下:
[0053][0054][0055]
在37℃下孵育6-8h后,用axygen dna凝胶提取试剂盒回收载体片段(回收 步骤同上)。
[0056]
将纯化后的dna寡核苷酸双链与线性化的phun4c12载体用t4连接酶 (takara,上海)连接。连接反应体系如下:
[0057][0058]
在4℃下孵育约10h完成连接后,反应液直接转化dh5α大肠杆菌感受态。在 含有卡那霉素的lb平板上获得单克隆,挑取单克隆在lb液体培养基上培养,测序 验证、获得目标载体phun4c12-oskeap1-utr。
[0059]
上述载体利用热激法将phun4c12-oskeap1-utr分别导入农杆菌 (agrobacterium tumefaciens strain)菌株eha105。
[0060]
(2)农杆菌介导法培育转基因水稻
[0061]
xidao#1(粳稻品种)种子用70%乙醇浸泡30-60s后,在无菌的50ml离心管 中,用1%naclo消毒液振荡消毒30-40min(期间若溶液变浊,可更换一次消毒液) 后,在超净工作台用无菌水洗涤3-4次,转移至吸水滤纸上晾干30-60min,在2n6 愈伤组织诱导培养基上培养。
[0062]
选取4mm左右大小的愈伤组织用于农杆菌转化,具体方法如下:农杆菌菌液 od 600为0.8-1.0时取500μl取上清,用200μmol/l as的30ml aam感菌液制 成菌浮液,使菌液od 600为0.01。
[0063]
将上述水稻愈伤组织颗粒50-100粒放入农杆菌感菌液5-10min,取出置于无菌 滤纸沥干30-40min,共培养培养基(表1)上25℃暗培养2.5天。然后,将愈伤组 织转入添加了潮霉素(50mg/l)和头孢拉定(500mg/l)的选择培养基s1(表2) 上培养14天,新长出的愈伤组织转入第二轮筛选培养基s2(潮霉素:80mg/l;头 孢拉定:500mg/l)上继续培养获得新的愈伤。长出新的愈伤颗粒转入粳稻分化培养 基(表3)。待分化出的小苗长至1cm左右,转移至生根培养基(表4)中生根成苗。 待小苗长至7cm左右,打开瓶盖加自来水炼苗3-5天,再在1/4ms液体培养基中 生长1周,移植到土壤中长成植株。
[0064]
表1.共培养培养基/升
[0065][0066]
注:mes为乙磺酸 as为乙酰丁香酮
[0067]
表2.选择培养基/升
[0068][0069]
第一轮筛选:头孢拉定(cef,500mg/l)和潮霉素(hyg,50mg/l);
[0070]
第二轮筛选:头孢拉定(cef,500mg/l)和潮霉素(hyg,80mg/l),灭菌后加入。
[0071]
表3.分化培养基/升
[0072][0073]
表4.生根培养基/升
[0074]
[0075]
结果:经潮霉素抗性基因检测获得12株阳性t0植株。取代表样品sanger测序确 定突变单株突变基因型。在t1群体中检测到2类单碱基纯合插入突变体,分别命名为 oskeap1-1和oskeap1-2(图2)。
[0076]
3、oskeap1在幼苗叶片组织中的相对表达
[0077]
为了评估oskeap1-1和oskeap1-2这两个插入突变是否影响oskeap1的表达,以 及如何影响oskeap1的表达,采用qrt-pcr方法检测突变体及其野生型亲本xidao#1 中oskeap1转录本的丰度。
[0078]
其中,将水稻品种xidao#1种子30℃浸种48h后在潮湿滤纸上萌发,出芽后转 移到生长室中培养。生长条件为:昼/夜温度24/16℃,光周期16h,辐照度300μmol ·
m-2
·
s-1
,相对湿度60-70%。采用tiangen多糖多酚植物总rna提取试剂盒 (天根,北京),从10天龄的幼苗中提取总rna,具体操作步骤如下:
[0079]
(a)将rna提取过程中所需的研钵,药匙,装有破碎振荡小钢珠的2ml离 心管等用锡箔纸包裹,灭菌锅121℃30min高温高压灭菌2次;
[0080]
(b)称取植物组织约100mg置于装有破碎振荡小钢珠的离心管中,液氮中快速 冷却后研磨机60hz,30s低温研磨充分;
[0081]
(c)叶片研磨充分后,装有水稻组织的离心管中加入500μl sl缓冲液(已加 入β-巯基乙醇),漩涡混匀,12,000rpm离心90s;
[0082]
(d)将离心后上清液转移至过滤柱cs柱中,12,000rpm离心90s,转移收集 管中滤液到新的1.5ml rnase-free离心管中(吸取过程中尽量不要碰到细胞碎片沉 淀);
[0083]
(e)加入0.4倍上清体积无水乙醇,混匀后将所得体系转移至吸附柱cr3, 12,000rpm离心90s,弃滤液,吸附柱放回收集管;
[0084]
(f)吸附柱中加入去蛋白液cw1,12,000rpm离心30s,弃废液。吸附柱放回 收集管;
[0085]
(g)dnase i工作液去除基因组dna;
[0086]
(h)已加入推荐体积无水乙醇的洗涤液rw1取500μl加入离心管中,12,000
[0087]
rpm离心30s,弃滤液;
[0088]
(i)重复步骤8一次;
[0089]
12,000rpm离心2min,取吸附柱cr3置于新的1.5ml rnase-free离心管中, 向吸附膜中间部位滴加40μl rnase-free ddh2o,室温放置2min,12,000rpm离心 90s,弃吸附柱,收集rna溶液。
[0090]
cdna合成采用takara(上海)的反转录试剂盒,现在含gdna eraser的缓冲 液中去除剩余基因组dna,合成cdna。
[0091]
反转录体系如下:
[0092][0093]
[0094]
pcr程序为37℃,15min;85℃,5sec。反应结束后4℃保存备用。
[0095]
结果表明,无论在苗期还是开花期,这两个突变体的oskeap1转录量都明显低 于xidao#1(图4)。相比之下,oskeap1-1的突变效应比oskeap1-2更为显著,oskeap1 在苗期的转录丰度仅为xidao#1的41.09%(oskeap1-1)和77.39%(oskeap1-2)(图4a)。 突变效应在开花期更为显著,oskeap1转录水平仅为野生型亲本xidao#1的29.77% 和50.46%(图4b)。
[0096]
4、oskeap1突变对农艺性状的影响
[0097]
在杭州之豇水稻育种站,从无转基因t1植株中选育出无转基因纯合突变体t2系, 并与其野生型亲本xidao#1在田间进行农艺性状检测。这两个突变系及其亲本xidao#1 在随机设计的三次重复中生长。每个复制小区各株系48株(6
×
8)。在籽粒成熟期收 集分蘖数、株高、千粒重、结实率等农艺性状。用碘染色法研究花粉育性,并在显微 镜下观察。小区产量是每个重复的粮食总产量。
[0098]
oskeap1的2个突变体在抽穗前与野生型亲本没有显著差异。抽穗后,突变体植株 明显较野生型矮(图3),育性较差,但单株穗数相仿。oskeap1-1和oskeap1-2的单株 穗数与野生型相仿(图5a),但株高分别下降11.8%和10.0%,差异均达显著水平(图 5b)。两个突变体的单株籽粒数显著减少,仅为野生型的35.4%和58.6%(图5c),结 实率分别为45.13%和61.76%,显著低于野生型的93.60%(图5d)。可能受结实率下 降的影响,oskeap1-1和oskeap1-2的小区产量相比野生型下降了62.2%和39.3%(图 5e)。两个突变体的平均穗长分别相比野生型下降了22.9%和7.7%(图5f)。
[0099]
5、oskeap1突变对花粉发育的影响
[0100]
为明确oskeap1-1和oskeap1-2结实率下降的原因,进一步对突变系及野生型花粉 育性进行了分析。
[0101]
花粉育性采用碘染色法调查,具体方法如下:
[0102]
(a)配制1%碘-碘化钾溶液:在100ml烧杯中加入ddh2o约70ml,加入 8g碘化钾,常温下搅拌溶解后,加入1g碘,将溶液转移至100ml容量瓶中,烧 杯用ddh2o涮洗两次,涮洗水倒入容量瓶,定容溶液体积至100ml,摇匀。溶液避 光储存,置于避光处。
[0103]
(b)利用1%碘-碘化钾溶液考察花粉育性:采集花药实验:取水稻抽穗期的开花 材料,一般取稻穗即将第二天开花的颖花置于faa固定液(生工,上海)内,分别 取稻穗上、中、下三个部位的长势均一的颖花,成熟花药的取样标准为花药生长长度 超过颖壳内部上下长度的2/3。
[0104]
(c)显微镜观察花粉育性:在载玻片上放置稻穗上、中、下各一朵颖花的花药, 在载玻片的花药上滴加20-40μl 1%碘-碘化钾溶液,用镊子尖端轻轻捣碎花药,将花 粉粒释放到碘-碘化钾溶液,盖上盖玻片,轻轻用镊子压紧盖玻片,观察花粉形状和染 色情况。10倍显微镜可用于计数花药育性观察统计。随机选择视野观测,每个视野统 计的可见花粉粒须不少于200。
[0105]
结果发现,两个突变体中的花粉中出现了较高比例的不育花粉,在碘染色下显示 无淀粉粒,只有黄色花粉外壳,为典败花粉,分别占总花粉粒的15.54%和12.26%, 而野生型植株的不育花粉率仅为3.86%(图6)。
[0106]
对oskeap1的蛋白结构分析发现,与人类keap1含有一个btb和back结构 域不同,它含有一个植物中特有的dcd结构域,同时含有5个kelch结构(图1b)。
[0107]
为了分析植物中keap1的保守性,进一步鉴定了玉米等9种植物的keap1同源 基因。结果发现,这些同源基因编码的蛋白与oskeap1的氨基酸数目相仿,都具有 一个dcd结构域和5-6个kelch结构(图1)。由此表明,keap1同源基因在植物 中高度保守。
[0108]
oskeap1水稻突变体对于水稻的生长发育有重要影响,主要表现为影响水稻花粉 育性及一系列相关农艺性状。oskeap1-1和oskeap1-2对水稻生长发育都造成了负面影 响,但前者的效应又显著大于后者,这与前者表达下调的程度大于后者相一致。这些 结果说明,本实验观察到的两个突变体的性状劣变是oskeap1突变效应在表型水平的 体现,而不是由于其它变异如无性系变异等因素造成。5'utr区域的crispr/cas9编 辑为我们在研究重要(敲除致死)基因生物学功能中通过基因编辑实现基因表达水平 部分下调而不完全敲除以部分调节调控水稻相关生长和产量性状提供了有效途径。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



