1-环己基吡唑啉酮类羧酸酯酶1抑制剂、其制备及应用的制作方法
 2021-02-02 05:02:37|
2021-02-02 05:02:37| 365|
365| 起点商标网
起点商标网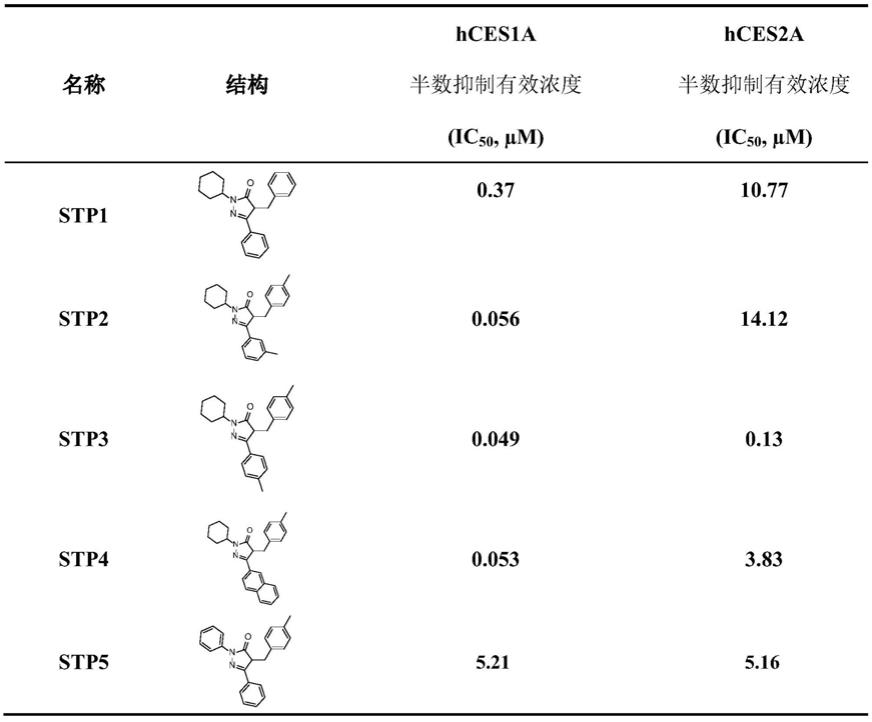
[0001]
本发明属于生物医药技术领域,涉及一种1-环己基吡唑啉酮类羧酸酯酶抑制剂、其制备及应用。
背景技术:
[0002]
羧酸酯酶1(hces1a,ec 3.1.1.1)是在肝脏、小肠、肾、肺、睾丸、心脏、单核细胞、巨噬细胞和循环血浆中发现的丝氨酸水解酶。但是hces1a主要分布于肝脏中,并表现出显著的组织特异性分布,hces1a在亚细胞中定位于内质网,其c-端负责将hces1a蛋白固定于内质网,而其活性中心位于蛋白的n-端。因此,hces1a外泌至胞浆或胞外仍保持水解活性。hces1a作为一种重要的肝药物代谢酶,可水解含有酯键的药物或酯类前药,例如血管转化酶抑制剂(咪达普利、地拉普利),抗癌药(卡培他滨、伊立替康),麻醉剂(哌替啶、可卡因)。氯吡格雷是冠心病患者常用抗血小板药物,但临床上仍4%~30%的患者常规服用氯吡格雷不能有效抑制血小板活性,将复发心脑血管事件,称之为“氯吡格雷抵抗”(clopidogrel resistance,cr)(am j ther 2010;17(2):210-215)。氯吡格雷作为一种羧酸酯前药,约85%的氯吡格雷被hce1水解为非活性的代谢产物,仅有15%的前药被细胞色素p450代谢。因此,通过抑制hces1a水解活性,减少氯吡格雷非活性代谢产物的生成,可以起到增强氯吡格雷药效的作用。近年来国内外研究表明,肥胖和ii型糖尿病患者脂肪组织中的hces1a的活性明显提升,且其与肌肉、肝脏中胰岛素抵抗的发病机制有密切关系(hepatology,2012;56:2188-2198;nat chem biol,2014;10:113-121)。抑制脂肪细胞中的hces1a,不仅可减少血浆游离胆固醇和脂肪酸的水平,同时还可通过调控脂类代谢并提高胰岛素的敏感度,进而缓解肥胖和2型糖尿病等代谢病的症状。此外,多数羧酸酯类、酰胺类、硫酯类、氨甲酸酯类的前体药物在胃肠道分布的羧酸酯酶水解代谢,在吸收入血之前就被水解成水溶性较大的产物,降低了吸收入血的药物的浓度,影响的生物利用度。若与酯类药物共服羧酸酯酶抑制剂,可大大降低酯类药物的非活性水解代谢,从而提高生物利用度。
[0003]
综上所述,安全强效的hces1a抑制剂,一方面可用于缓解脂质异位沉积诱导的胰岛素抵抗发展至糖耐量受损,另一方面可将其与酯类药物共服,进而降低酯类药物的首过代谢或非活性水解代谢,从而提高生物利用度并改善其体内治疗效果。
[0004]
因此,开发一种安全强效的hces1a抑制剂极具现实意义。
技术实现要素:
[0005]
本发明的目的在于提供一种羧酸酯酶1(hces1a)强效抑制剂及其应用,该类化合物具有1-环己基吡唑啉酮骨架结构,其可以强效地抑制人羧酸酯酶亚型1的活性。利用该抑制剂具有良好的生物学应用前景。
[0006]
为实现上述目的,本发明提供如下技术方案:
[0007]
1-环己基吡唑啉酮类羧酸酯酶1抑制剂,其具有1-环己基吡唑啉酮骨架结构,结构通式如下:
[0008][0009]
其中,其中,r1和r2分别为苯基、苄基、2-甲基苯基、4-甲基苯基、4-甲基苄基和2-萘基中的任意一种。
[0010]
作为优选的技术方案:
[0011]
如上所述的1-环己基吡唑啉酮类羧酸酯酶1抑制剂,所述r1为苯基、苄基或2-萘基;所述r2为2-甲基苯基、4-甲基苯基或4-甲基苄基。本发明的保护范围并不仅限于此,此处仅给出部分可行的技术方案,在实际应用中本领域技术人员可合理调整的选择r1和r2。
[0012]
如上所述的1-环己基吡唑啉酮类羧酸酯酶1抑制剂,所述抑制剂可强效地抑制人羧酸酯酶亚型1的活性,抑制hces1a的ic
50
达50纳摩,抑制hces2a的ic
50
与抑制hces1a的ic
50
比率可达252倍。
[0013]
如上所述的1-环己基吡唑啉酮类羧酸酯酶1抑制剂,所述抑制剂的生物毒性小,安全性好,且其能有效抑制小鼠前脂肪3t3-l1细胞系诱导的脂肪细胞脂滴的生成。
[0014]
本发明还提供了如上所述的1-环己基吡唑啉酮类羧酸酯酶1抑制剂的制备方法,其步骤如下:
[0015]
1)合成β-酮酸酯;
[0016]
2)基于步骤1)制得的β-酮酸酯合成α-取代-β-酮酸酯;
[0017]
3)环己基肼与α-取代-β-酮酸酯合成1-环己基吡唑啉酮类化合物。
[0018]
本发明的制备方法,一方面原料易得,成本较为低廉;另一方面制备条件较为简单,合成工艺较为简单且收率较高,这大大降低了本发明产品(1-环己基吡唑啉酮类化合物)的成本。
[0019]
此外,本发明还提供了如上所述的1-环己基吡唑啉酮类羧酸酯酶1抑制剂的应用,所述抑制剂可通过抑制hces1a的活性减少血浆游离胆固醇和脂肪酸的水平,进而通过调控脂类代谢并提高胰岛素的敏感度,缓解脂质异位沉积诱导的胰岛素抵抗发展至糖耐量受损。
[0020]
本发明提供的1-环己基吡唑啉酮类羧酸酯酶1抑制剂除了可以单独或复方与常用辅料混合后制剂使用外,还可以与氯吡格雷等酯类药物按不同比例混合作为药物混合物使用,其使用场景广,其能够通过抑制hces1a活性保证药物的药理活性,不仅能够提高药物活性,还能降低成本(达到同等药效时混入1-环己基吡唑啉酮类化合物的羧酸酯酶抑制剂的活性药物量大大少于单纯的活性药物量),极具应用前景。
[0021]
作为优选的技术方案:
[0022]
如上所述的应用,所述抑制剂可与部分酯类药物合用并抑制人肠及肝脏内的hces1a活性,减少酯类药物的首过代谢,提高口服酯类药物的生物利用度。
[0023]
如上所述的应用,所述抑制剂可作为氯吡格雷等酯类药物的增效剂,可通过抑制
羧酸酯酶1的活性减少氯吡格雷等酯类药物非活性代谢产物的生成,进而提高氯吡格雷的药理活性。
[0024]
有益效果:
[0025]
(1)本发明的1-环己基吡唑啉酮类羧酸酯酶1抑制剂,原料易得,成本较为低廉,合成工艺较为简单且收率较高;
[0026]
(2)本发明的1-环己基吡唑啉酮类羧酸酯酶1抑制剂,抑制活性高且其选择性好,抑制hces1a的ic
50
达50纳摩,抑制hces2a的ic
50
与抑制hces1a的ic
50
比率可达252倍,极具应用前景。
附图说明
[0027]
图1为实施例1中化合物stp1的合成路线示意图;
[0028]
图2为实施例1中化合物stp2的合成路线示意图;
[0029]
图3为实施例1中化合物stp3的合成路线示意图;
[0030]
图4为实施例1中化合物stp4的合成路线示意图;
[0031]
图5为实施例1中化合物stp5的合成路线示意图;
[0032]
图6为化合物stp2、化合物stp3、化合物stp4对细胞活性的影响与浓度的关系图;
[0033]
图7为化合物stp2、化合物stp3、化合物stp4抑制小鼠前脂肪细胞系3t3-l1诱导的脂肪细胞脂滴生成的示意图。
具体实施方式
[0034]
下面结合附图,对本发明的具体实施方式做进一步阐述。
[0035]
本发明所采用的设备及其型号为:荧光发射/激发光谱是由synergyh1全功能微孔板检测仪检测完成;1h-nmr谱图是由核磁共振波谱仪(avance ii400mhz)检测完成。
[0036]
实施例1
[0037]
1、stp1的合成
[0038]
stp1的合成路线如图1所示;
[0039]
1)合成stp1-1:
[0040]
室温,向250ml三口瓶中分别加入nah(210mmol)、碳酸二甲酯(17.6ml,210mmol)、30ml甲苯,升温至120℃回流,向其中滴加苯乙酮(83mmol)的30ml甲苯溶液。反应30min后tlc监测苯乙酮反应完全后,加入冰水100ml,6n hcl调ph=6~7。分液,水相乙醚萃取(1
×
100ml,2
×
60ml),合并有机相,水洗一次,饱和食盐水洗一次,无水硫酸钠干燥,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得白色固体,产率80~90%。
[0041]
2)合成stp1-2:
[0042]
室温,向nah(15mmol)的10ml四氢呋喃悬浮液中,逐滴加入stp1-1(15mmol)的5ml四氢呋喃溶液,室温搅拌至不再有气泡冒出。然后向反应体系中逐滴加入溴化苄(15mmol)的10ml四氢呋喃溶液,室温搅拌反应20h。加入20ml饱和氯化铵溶液,分液,水相用乙酸乙酯(3
×
20ml)萃取,合并有机相,na2so4干燥后,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得油状液体,收率80-90%。
[0043]
3)合成stp1:
[0044]
室温,向50ml二口瓶中依次加入环己基肼(7mmol)、stp1-2(5.6mmol),搅拌下逐渐升温至115℃反应4h(tlc监测反应)。冷却至室温,加入乙酸乙酯和水分液,水相用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,旋干溶剂。无水乙醇重结晶,得白色固体,收率40-50%。
[0045]
产物(stp1)结构式如下:
[0046][0047]
stp1的mp(熔点)为164.8-166.3℃,其核磁共振波谱如下:
[0048]1h nmr for a mixture of ketone form and enol form enamine form(400mhz,dmso-d6)δ10.26(s,1h),7.48(d,j=6.7hz,2h),7.33-7.07(m,8h),4.17(brs,1h),3.91(s,2h),1.95-1.80(m,6h),1.67(d,j=11.1hz,1h),1.45-1.34(m,2h),1.25-1.15(dd,j=18.5,10.8hz,1h);
13
c nmr(101mhz,dmso-d6)δ150.1,146.8,142.0,135.5,128.7,128.6,128.2,127.2,127.0,126.1,96.8,55.0,32.6,28.3,25.6,25.5;hrms(ei)m/z calcd.for c
22
h
24
n2o([m]
+
)332.1883,found 332.1896.
[0049]
2、stp2的合成
[0050]
stp2的合成路线如图2所示;
[0051]
1)合成stp2-1:
[0052]
室温,向250ml三口瓶中分别加入nah(300mmol)、碳酸二甲酯(300mmol)、50ml甲苯,升温至120℃回流,向其中滴加间甲基苯乙酮(120mmol)的40ml甲苯溶液。反应30min后tlc监测苯乙酮反应完全后,加入冰水200ml,6n hcl调ph=6~7。分液,水相乙酸乙酯萃取(1
×
150ml,2
×
100ml),合并有机相,水洗一次,饱和食盐水洗一次,无水硫酸钠干燥,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得白色固体,产率70-80%。
[0053]
2)合成stp2-2:
[0054]
室温,向nah(50mmol)的10ml四氢呋喃悬浮液中,逐滴加入stp2-1(50mmol)的20ml四氢呋喃溶液,室温搅拌至不再有气泡冒出。然后向反应体系中逐滴加入对甲基溴化苄(50mmol)的20ml四氢呋喃溶液,室温搅拌反应20h。加入20ml饱和氯化铵溶液,分液,水相用乙酸乙酯(1
×
100ml,2
×
50ml)萃取,合并有机相,na2so4干燥后,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得油状液体,收率70-80%。
[0055]
3)合成stp2:
[0056]
室温,向50ml二口瓶中依次加入环己基肼(12mmol)、stp2-2(10mmol),搅拌下逐渐升温至115℃反应4h(tlc监测反应)。冷却至室温,加入乙酸乙酯和水分液,水相用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,旋干溶剂。无水乙醇重结晶,得白色固体,收率30-40%。
[0057]
产物(stp2)结构式如下:
[0058][0059]
stp2的mp(熔点)为161.0-162.4℃,其核磁共振波谱如下:
[0060]1h nmr for the enol form(400mhz,dmso-d6)δ10.19(s,1h),7.31(s,1h),7.23(d,j=7.8hz,1h),7.15(t,j=7.6hz,1h),7.07-6.98(m,5h),4.20-4.10(m,1h),3.82(s,2h),2.24(s,3h),2.23(s,3h),1.90-1.80(m,6h),1.67(d,j=11.9hz,1h),1.43-1.33(d,j=12.6hz,2h),1.28-1.16(m,1h);
13
c nmr(400mhz,dmso-d6)δ150.0,146.8,139.0,137.5,135.4,134.8,129.2,128.4,128.2,127.8,127.7,124.1,97.2,54.9,32.6,28.0,25.6,25.5,21.5,21.0;hrms(esi):calcd.for c
24
h
29
n2o([m+h]
+
)361.2274,found 361.2286.
[0061]
3、stp3的合成
[0062]
stp3的合成路线如图3所示;
[0063]
1)合成stp3-1:
[0064]
室温,向250ml三口瓶中分别加入nah(200mmol)、碳酸二甲酯(200mmol)、40ml甲苯,升温至120℃回流,向其中滴加对甲基苯乙酮(60mmol)的30ml甲苯溶液。反应30min后tlc监测苯乙酮反应完全后,加入冰水100ml,6n hcl调ph=6~7。分液,水相乙酸乙酯萃取(1
×
120ml,2
×
80ml),合并有机相,水洗一次,饱和食盐水洗一次,无水硫酸钠干燥,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得白色固体,产率70-80%。
[0065]
2)合成stp3-2:
[0066]
室温,向nah(50mmol)的10ml四氢呋喃悬浮液中,逐滴加入stp3-1(50mmol)的20ml四氢呋喃溶液,室温搅拌至不再有气泡冒出。然后向反应体系中逐滴加入对甲基溴化苄(50mmol)的20ml四氢呋喃溶液,室温搅拌反应20h。加入20ml饱和氯化铵溶液,分液,水相用乙酸乙酯(1
×
100ml,2
×
50ml)萃取,合并有机相,na2so4干燥后,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得油状液体,收率70-80%。
[0067]
3)合成stp3:
[0068]
室温,向50ml二口瓶中依次加入环己基肼(12mmol)、stp3-2(10mmol),搅拌下逐渐升温至115℃反应4h(tlc监测反应)。冷却至室温,加入乙酸乙酯和水分液,水相用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,旋干溶剂。无水乙醇重结晶,得白色固体,收率40-50%。
[0069]
产物(stp3)结构式如下:
[0070][0071]
stp3的mp(熔点)为157.8-160.3℃,其核磁共振波谱如下:
[0072]1h nmr for the enol form(400mhz,dmso-d6)δ10.16(s,1h),7.37(d,j=8.1hz,2h),7.10-6.98(m,6h),4.20-4.09(m,1h),3.82(s,2h),2.27(s,3h),2.23(s,3h),1.90-1.77(m,6h),1.67(d,j=12.6hz,1h),1.42-1.33(m,2h),1.27-1.18(m,1h);
13
c nmr(400mhz,dmso-d6)δ150.10,146.8,138.93,136.5,134.8,129.8,129.2,128.7,128.1,126.9,126.4,96.8,55.1,32.5,27.9,25.7,25.5,21.2,21.0;hrms(esi):calcd.for c
24
h
29
n2o([m+h]
+
)361.2274,found 361.2288.
[0073]
4、stp4的合成
[0074]
stp4的合成路线如图4所示;
[0075]
1)合成stp4-1:
[0076]
室温,向250ml三口瓶中分别加入nah(100mmol)、碳酸二甲酯(100mmol)、40ml甲苯,升温至120℃回流,向其中滴加对2-萘基乙酮(30mmol)的30ml甲苯溶液。反应30min后tlc监测苯乙酮反应完全后,加入冰水100ml,6n hcl调ph=6~7。分液,水相乙酸乙酯萃取(1
×
100ml,2
×
50ml),合并有机相,水洗一次,饱和食盐水洗一次,无水硫酸钠干燥,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得白色固体,产率65-75%。
[0077]
2)合成stp4-2:
[0078]
室温,向nah(50mmol)的10ml四氢呋喃悬浮液中,逐滴加入stp4-1(50mmol)的20ml四氢呋喃溶液,室温搅拌至不再有气泡冒出。然后向反应体系中逐滴加入对甲基溴化苄(50mmol)的20ml四氢呋喃溶液,室温搅拌反应20h。加入20ml饱和氯化铵溶液,分液,水相用乙酸乙酯(1
×
100ml,2
×
50ml)萃取,合并有机相,na2so4干燥后,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得油状液体,收率70-80%。
[0079]
3)合成stp4:
[0080]
室温,向50ml二口瓶中依次加入环己基肼(12mmol)、stp4-2(10mmol),搅拌下逐渐升温至115℃反应4h(tlc监测反应)。冷却至室温,加入乙酸乙酯和水分液,水相用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,旋干溶剂。无水乙醇重结晶,得淡黄色固体,收率40-50%。
[0081]
产物(stp4)结构式如下:
[0082][0083]
stp4的mp(熔点)为176.4-179.1℃,其核磁共振波谱如下:
[0084]1h nmr for the enol form(400mhz,dmso-d6)δ10.31(s,1h),7.92(s,1h),7.88-7.70(m,4h),7.48-7.41(m,2h),7.09(d,j=8.2hz,2h),7.06(d,j=8.2hz,2h),4.29-4.14(m,1h),3.96(s,2h),2.22(s,3h),1.94-1.81(6,7h),1.69(d,j=12.5hz,1h),1.44-1.35(m,2h),1.29-1.17(m,1h);
13
c nmr(400mhz,dmso-d6)δ150.2,146.4,139.0,134.9,133.4,129.9,129.3,128.8,128.3,127.9,126.6,125.6,125.1,97.7,55.0,32.6,28.2,25.7,25.5,21.0;hrms(esi):calcd.for c
27
h
29
n2o([m+h]
+
)397.2274,found 397.2289.
[0085]
5、stp5的合成
[0086]
stp5的合成路线如图5所示;
[0087]
1)合成stp1-1:
[0088]
室温,向250ml三口瓶中分别加入nah(210mmol)、碳酸二甲酯(17.6ml,210mmol)、30ml甲苯,升温至120℃回流,向其中滴加苯乙酮(83mmol)的30ml甲苯溶液。反应30min后tlc监测苯乙酮反应完全后,加入冰水100ml,6n hcl调ph=6~7。分液,水相乙醚萃取(1
×
100ml,2
×
60ml),合并有机相,水洗一次,饱和食盐水洗一次,无水硫酸钠干燥,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得白色固体,产率80-90%。
[0089]
2)合成stp5-2:
[0090]
室温,向nah(100mmol)的20ml四氢呋喃悬浮液中,逐滴加入stp1-1(100mmol)的50ml四氢呋喃溶液,室温搅拌至不再有气泡冒出。然后向反应体系中逐滴加入对甲基溴化苄(100mmol)的50ml四氢呋喃溶液,室温搅拌反应20h。加入50ml饱和氯化铵溶液,分液,水相用乙酸乙酯(1
×
200ml,2
×
80ml)萃取,合并有机相,na2so4干燥后,旋干溶剂,柱层析纯化(石油醚:乙酸乙酯=20:1洗脱),得油状液体,收率70-80%。
[0091]
3)合成stp5:
[0092]
室温,向100ml二口瓶中依次加入苯肼(25mmol)、stp5-2(20mmol),搅拌下逐渐升温至115℃反应4h(tlc监测反应)。冷却至室温,加入乙酸乙酯和水分液,水相用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,旋干溶剂。无水乙醇重结晶,得白色固体,收率40-50%。
[0093]
产物(stp5)结构式如下:
[0094][0095]
stp5的mp(熔点)为122.7-123.8℃,其核磁共振波谱如下:
[0096]1h nmr for the enol form(400mhz,dmso-d6)δ11.14(s,1h),7.95(d,j=8.0hz,2h),7.65(d,j=7.2hz,2h),7.55-7.26(m,6h),7.18-7.04(m,4h),3.97(s,1h),2.25(s,3h);
13
c nmr(101mhz,dmso-d6)δ149.6,138.3,135.2,129.4,128.9,128.2,127.5,126.1,121.8,27.9,21.1;hrms(ei)m/z calcd.for c
23
h
20
n2o([m]
+
)340.1570,found 340.1577.
[0097]
实施例2
[0098]
1-环己基吡唑啉酮类化合物对羧酸酯酶1(hces1a)抑制能力的定量评估
[0099]
以d-荧光素甲酯(dme)羧酸酯酶1的水解代谢为探针反应,应用生物发光,借助人肝微粒体体外孵育体系,测1-环己基吡唑啉酮类化合物对羧酸酯酶1(hces1a)抑制的ic
50
:
[0100]
a)100微升体外代谢反应体系中,含有ph为6.5的磷酸缓冲液(0.1m pbs,94μl),人肝微粒体蛋白终浓度为2μg/ml(hlm,2μl),抑制剂终浓度范围为0.1μm-80μm(2μl),于37℃条件下在酶标仪上震荡预孵10分钟;
[0101]
b)向反应体系中加入d-荧光素甲酯(dme)底物(2μl,终浓度3μm)起始反应,在酶标仪上震荡孵育反应10分钟;
[0102]
c)向反应体系中加入luciferin detection reagent(50μl,promga,ua)终止反应,应用酶标仪bioluminescence测定30分钟,integration time:1s/孔,gain:140,应用生物发光(bioluminescence)持续进行震荡20分钟,每隔2分钟检测一次在酶标仪检测分析;对水解产物d-荧光素进行定量检测(580nm)。
[0103]
实施例3
[0104]
1-环己基吡唑啉酮类化合物对羧酸酯酶2(hces2a)抑制能力的定量评估
[0105]
以对二乙酸荧光素fd(fluorescein diacetate)的羧酸酯酶2水解代谢为探针反应,借助人肝微粒体体外孵育体系,测定1-环己基吡唑啉酮类化合物对羧酸酯酶2(hces1a)抑制的ic
50
:
[0106]
a)200微升体外代谢反应体系中,含有ph为7.4的磷酸缓冲液(0.1m pbs,194μl),人肝微粒体蛋白终浓度为2μg/ml(2μl),抑制剂终浓度范围为0.5μm-100μm(2μl),于37℃条件下震荡预孵5分钟;
[0107]
b)向反应体系中加入fd底物(2μl,终浓度5μm),起始反应;于37℃条件下反应30分钟后,加入200μl乙腈,剧烈震荡后,终止反应;
[0108]
c)采用高速冷冻离心机,在20 000
×
g的条件下,高速离心上述体系5分钟后,取上清,进行酶标仪检测分析(ex 480nm/em 525nm);对代谢水解产物进行定量检测。
[0109]
实施例1制得的产品stp1、stp2、stp3、stp4和stp5采用实施例2和3的方法测试后的结果如表1所示,由表1中可以看出,本发明制得的产品(1-环己基吡唑啉酮类化合物)对
hces1a呈现出很好的抑制活性,,改造吡唑啉酮(1位为环己基)可以明显提高其对hces1a的抑制活性,同时显著增强对hces2a的选择性。1-环己基吡唑啉酮类化合物stp1、stp2、stp3和stp4对hces1a抑制活性可达可达50纳摩,抑制hces2a的ic
50
与抑制hces1a的ic
50
比率可达252。
[0110]
表1
[0111][0112]
实施例4
[0113]
stp2对氯吡格雷的抑制动力学研究:
[0114]
以氯吡格雷的水解代谢为探针反应,借助人肝微粒体体外孵育体系,通过监测氯吡格雷非活性代谢路径产物氯吡格雷酸的生产速率,考察stp2对氯吡格雷非活性代谢的催化中性胆固醇脂水解酶的半数抑制浓度ic
50
及抑制动力学常数k
i
:
[0115]
1.ic
50
值的测定
[0116]
a)200微升体外代谢反应体系中,含有ph为6.5的磷酸盐缓冲液,人肝微粒体蛋白浓度为20μg/ml,抑制剂stp2终浓度范围分别为0.001μm-100μm,于37℃条件下震荡预孵3分钟;
[0117]
b)向反应体系中加入氯吡格雷底物(终浓度60μm),起始反应;于37℃条件下反应60分钟后,加入100μl乙腈,剧烈震荡后,终止反应;
[0118]
c)采用高速冷冻离心机,在20 000
×
g的条件下,高速离心上述体系20分钟后,取上清,在waters tq-d液质联用仪进行检测定量分析。
[0119]
2.k
i
值的测定
[0120]
a)200微升体外代谢反应体系中,含有ph为6.5的磷酸盐缓冲液,人肝微粒体蛋白浓度为20μg/ml,底物氯吡格雷的浓度点为:20μm、60μm、120μm、180μm,抑制剂stp2终浓度范围分别为0.001μm-100μm,于37℃条件下震荡预孵3分钟;
[0121]
b)向反应体系中分别加入不同浓度的氯吡格雷底物起始反应;于37℃条件下反应60分钟后,加入100μl乙腈,剧烈震荡后,终止反应;
[0122]
c)采用高速冷冻离心机,在20 000
×
g的条件下,高速离心上述体系20分钟后,取上清,在waters tq-d液质联用仪进行检测定量分析。
[0123]
测试结果如表2所示:
[0124]
表2
[0125][0126]
实验结果表明,stp2对参与氯吡格雷非活性代谢的hces1a水解酶呈现出较好的抑制活性。从所得实验数据可以看出,stp2可以有效的抑制参与氯吡格雷非活性代谢的hces1a,且抑制半数有效浓度ic
50
在1μm以下。因此,共服该类hces1a抑制剂能够减少氯吡格雷体内代谢的非活性代谢产物的生成,可以作为氯吡格雷的增效剂。
[0127]
实施例5
[0128]
stp2、stp3和stp4细胞毒性研究:
[0129]
以cell counting kit-8试剂盒,一种基于wst-8(化学名:2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2h-四唑单钠盐)检测细胞毒性:
[0130]
1)将冻存的小鼠前脂肪细胞3t3-l1从液氮罐中取出,迅速放入37℃金属浴锅中,然后迅速加入到预先准备好完全培养基(dmem+10%胎牛血清+1%双抗)中,1000g离心5min后,弃上清。用培养基将细胞混匀,然后放入25m2的培养瓶中在细胞培养箱中37℃,5%co2培养。24小时后,弃去上清,用无菌pbs洗培养瓶,弃去pbs,加入1ml胰酶,放入培养箱中消化细胞。5min后加入完全培养基终止消化。将细胞加入96孔板中,每孔5000个细胞。
[0131]
2)24小时细胞贴壁后,加入不同浓度的待测化合物(stp2,stp3,stp4)。分别用完全培养基将药物稀释为100,80,60,40,20,10,5,2.5,1,0μm的终浓度(dmso浓度1%)。分别将不同浓度加入到细胞孔中,每个浓度3个复孔。细胞培养箱中37℃继续培养。
[0132]
3)48小时后加入弃去上清,将含有10%cck8检测试剂的完全培养基加入到96孔板中。在酶标仪上检测450nm吸收强度,对细胞活性进行检测。
[0133]
stp2、stp3和stp4对细胞活性的影响与浓度的关系图如图6所示,由图7中可以看出,stp2在60μm毒性小于百分之二十,stp3在80μm毒性小于百分之二十,stp4在40μm毒性小于百分之二十。
[0134]
实施例6
[0135]
1-环己基吡唑啉酮类化合抑制小鼠前脂肪细胞系(3t3-l1)诱导的脂肪细胞脂滴生成研究:
[0136]
以小鼠前脂肪细胞3t3-l1为模型细胞,考察1-环己基吡唑啉酮类化合stp1、stp2、
stp3存在下,3t3-l1细胞系诱导的脂肪细胞脂滴生成情况:
[0137]
将冻存的小鼠前脂肪细胞3t3-l1从液氮罐中取出,迅速放入37℃金属浴锅中,然后迅速加入到预先准备好完全培养基(dmem:f/12+10%胎牛血清+1%双抗)中,1000g离心5min后,弃上清。用培养基将细胞混匀,然后放入25m2的培养瓶中在细胞培养箱中37℃,5%co2培养。24小时后,弃去上清,用无菌pbs洗培养瓶,弃去pbs,加入1ml胰酶,放入培养箱中消化细胞。5min后加入完全培养基终止消化。然后将细胞铺到24孔板中,没孔2
×
104个细胞。待细胞生长至100%融合,继续培养2天。用诱导培养基i(10μg/ml胰岛素,500μm/l3-异丁基-1-甲基黄嘌呤,1μm/l地塞米松溶于完全培养基)配制化合物stp2、stp3、stp4(0,10,20,30μm浓度),继续培养2天。然后用诱导培养基ii(10μg/ml胰岛素溶于完全培养基)配制化合物stp2、stp3、stp4(0,10,20,30,40μm浓度),继续培养2天。最后用完全培养基配制化合物stp2、stp3、stp4(0,10,20,30,40μm浓度),继续培养4天,每2天换一次液。最后将将培养基去除,用甲醇固定,油红o染色。在倒置显微镜下观察。
[0138]
混有不同浓度的化合物stp2、化合物stp3、化合物stp4的培养基培养后的示意图如图7所示,实验结果表明,stp2、stp3、stp4在10μm,20μm,30μm时对3t-l1细胞的细胞脂滴生成相对于对照组具有明显的抑制细胞脂滴生成作用。
[0139]
经验证,本发明的1-环己基吡唑啉酮类羧酸酯酶1抑制剂,原料易得,成本较为低廉,合成工艺较为简单且收率较高;抑制活性高且其选择性好,抑制hces1a的ic
50
达50纳摩,抑制hces2a的ic
50
与抑制hces1a的ic
50
比率可达252倍,极具应用前景。
[0140]
虽然以上描述了本发明的具体实施方式,但是本领域的技术人员应该理解,这些仅是举例说明,在不违背本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


