一种可提高番茄中辅酶Q的制作方法
 2021-02-02 04:02:49|
2021-02-02 04:02:49| 364|
364| 起点商标网
起点商标网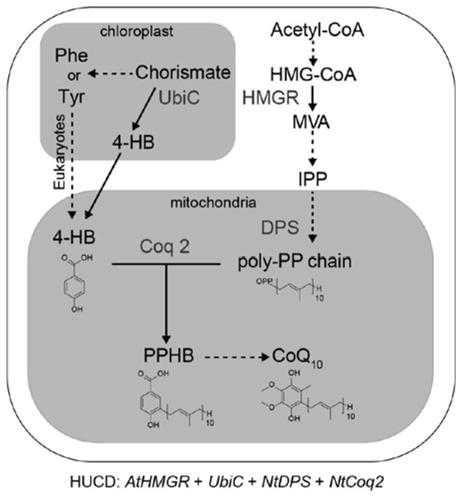
一种可提高番茄中辅酶q
10
含量的联合载体及其构建方法和应用
技术领域
[0001]
本发明涉及植物技术领域,尤其涉及一种可提高番茄中辅酶q
10
含量的联合载体及其构建方法和应用。
背景技术:
[0002]
辅酶q
10
(coenzyme q
10
,又名coq
10
)的分子结构由苯醌母基团和一条十聚异戊烯侧链的醌类组成。辅酶q
10
在人体内主要是作为氧化呼吸链中复合体ii/iii的电子转运体,帮助细胞产生atp。此外它也是一种膜上的抗氧化物质,被用作许多酶的辅助因子。在人体内,缺乏辅酶q
10
会导致各种严重的神经性疾病,如线粒体脑肌病、小脑共济性失调或leigh氏脑病等,并影响如骨骼肌、心脏和肾脏等多个器官的功能。一般情况下,辅酶q
10
水平会随着人年龄的增长而降低,并且在服用某些药物(如他汀类药物)和患有心血管疾病的情况下,辅酶q
10
含量会异常减少。
[0003]
目前辅酶q
10
生产主要是通过微生物(酵母等)合成。考虑到食品安全问题,从工程酵母或细菌细胞中提取的辅酶q
10
并不能完全适用于食品添加,而从植物中提取辅酶q
10
可以有效避免这一问题。但由于植物中辅酶q
10
含量过低,需要通过一定的分子生物学方法提高作物中辅酶q
10
含量。由于目前植物中辅酶q
10
合成途径尚未完全解析,还未有成功在作物中提高辅酶q
10
的报道。
[0004]
而从饮食中获得外源辅酶q
10
,对于维持体内辅酶q
10
水平稳定具有非常重要的意义。在我们的饮食结构中,肉类、鱼类和油中通常含有丰富的辅酶q
10
(约为0.12mg/g),但蔬菜和水果中的辅酶q
10
含量相对较低(小于0.02mg/g)。在如今社会提倡增加蔬菜水果饮食结构比例的观念影响下,维持食物中辅酶q
10
的稳定摄入变得极为困难。为了满足日常营养摄入的需要,人们对富含辅酶q
10
的植物性食品抱有极大的需求。因此提高作物中辅酶q
10
含量的发明具有实际的生产价值和明确的转化前景。
技术实现要素:
[0005]
本发明的目的是针对现有技术中的不足,提供一种可提高番茄中辅酶q
10
含量的联合载体及其构建方法和应用。
[0006]
为实现上述目的,本发明采取的技术方案是:
[0007]
本发明的第一方面是提供一种可提高番茄中辅酶q
10
含量的联合载体构建方法,步骤包括:
[0008]
s1、提取番茄基因组dna,通过pcr扩增获得e8启动子序列;通过全合成获得烟草coq2基因编码序列,如seq id no.1所示;提取烟草基因组rna,通过反转录获得cdna,再通过pcr扩增获得dps基因编码序列,如seq id no.2所示;通过全合成获得拟南芥hmgr2基因编码序列,如seq id no.3所示;通过全合成获得n端融合了番茄叶绿体信号肽的大肠杆菌ubic基因编码序列,如seq id no.4所示;提取拟南芥基因组dna,通过pcr扩增获得hsp终止
子序列;
[0009]
s2、通过golden gate克隆法将所述e8启动子序列连入载体puap1,以获得e8启动子的level 0载体;通过golden gate克隆法将所述coq2基因编码序列连入另一载体puap1,以获得coq2基因的level 0载体;通过golden gate克隆法将所述dps基因编码序列连入另一载体puap1,以获得dps基因的level 0载体;通过golden gate克隆法将所述hmgr2基因编码序列连入另一载体puap1,以获得hmgr2基因的level 0载体;通过golden gate克隆法将所述ubic基因编码序列连入另一载体puap1,以获得ubic基因的level 0载体;通过golden gate克隆法将所述hsp终止子序列连入另一载体puap1,以获得hsp终止子的level 0载体;
[0010]
s3、通过golden gate克隆法将所述e8启动子序列、所述coq2基因编码序列和所述hsp终止子序列依次连入载体pich47742,以获得coq2基因的level 1载体;通过golden gate克隆法将所述e8启动子序列、所述dps基因编码序列和所述hsp终止子序列依次连入载体pich47751,以获得dps基因的level 1载体;通过golden gate克隆法将所述e8启动子序列、所述hmgr2基因编码序列和所述hsp终止子序列依次连入载体pich47761,以获得hmgr2基因的level 1载体;通过golden gate克隆法将所述e8启动子序列、所述ubic基因编码序列和所述hsp终止子序列依次连入载体pich47772,以获得ubic基因的level 1载体;
[0011]
s4、通过golden gate克隆法将35s启动子序列、潮霉素抗性基因编码序列和35s终止子序列,所述e8启动子序列、所述coq2基因编码序列和所述hsp终止子序列,所述e8启动子序列、所述dps基因编码序列和所述hsp终止子序列,所述e8启动子序列、所述hmgr2基因编码序列和所述hsp终止子序列,所述e8启动子序列、所述ubic基因编码序列和所述hsp终止子序列依次连入载体picsl4723-p1,所获得的level 2载体即为所述联合载体,如seq id no.5所示。
[0012]
优选地,步骤s1中各所述的pcr扩增体系均为:模板,即500ng所述基因组dna或50ng所述cdna;0.2μm正向引物;0.2μm反向引物;10μl fastpfu缓冲液;0.2mm dntps;2.5units fastpfu dna聚合酶;h2o补足至50μl;
[0013]
pcr扩增程序均为:95℃,2min;95℃,20s、58℃,20s、72℃,2min,循环33次;72℃,5min。
[0014]
优选地,番茄基因组dna的pcr扩增引物如seq id no.6和seq id no.7所示;烟草cdna的pcr扩增引物如seq id no.8和seq id no.9所示;拟南芥基因组dna的pcr扩增引物如seq id no.10和seq id no.11所示。
[0015]
优选地,通过所述全合成获得相应基因编码序列时,修改其中部分的碱基以去除bsai和bpii酶切位点。
[0016]
优选地,步骤s2中各所述的level 0载体构建体系均为:100ng puap1载体;步骤s1中所获得的相应序列片段,与所述puap1载体的摩尔比为2:1;5units bpii内切酶;200units t4连接酶;1.5μl t4连接酶缓冲液;1.5μl bsa,1mg/ml;h2o补足至20μl;
[0017]
反应程序均为:37℃,3min、16℃,4min,循环26次;80℃,5min;
[0018]
反应结束后,取反应液转化大肠杆菌dh10b热击感受态,在含氯霉素的lb固体培养基上生长;挑选阳性克隆,lb液体培养基培养,提质粒,测序后获得相应正确的level 0载体。
[0019]
优选地,步骤s3中各所述的level 1载体构建体系均为:相应的level 1载体,
100ng;步骤s2中所获得的e8启动子的level 0载体,与所述相应的level 1载体的摩尔比为2:1;步骤s2中所获得的相应基因的level 0载体,与所述相应的level 1载体的摩尔比为2:1;步骤s2中所获得的hsp终止子的level 0载体,与所述相应的level 1载体的摩尔比为2:1;5units bsai内切酶;200units t4连接酶;1.5μl t4连接酶缓冲液;1.5μl bsa,1mg/ml;h2o补足至20μl;
[0020]
反应程序均为:37℃,3min、16℃,4min,循环26次;80℃,5min;
[0021]
反应结束后,取反应液转化大肠杆菌dh10b热击感受态,在含氨苄青霉素的lb固体培养基上生长;挑选阳性克隆,lb液体培养基培养,提质粒,测序后获得相应正确的level 1载体。
[0022]
优选地,步骤s4中所述的level 2载体构建体系均为:100ng picsl4723-p1载体;picsl11059载体,与所述picsl4723-p1载体的摩尔比为2:1;步骤s3中所获得的coq2基因的level 1载体,与所述picsl4723-p1载体的摩尔比为2:1;步骤s3中所获得的dps基因的level 1载体,与所述picsl4723-p1载体的摩尔比为2:1;步骤s3中所获得的hmgr2基因的level 1载体,与所述picsl4723-p1载体的摩尔比为2:1;步骤s3中所获得的ubic基因的level 1载体,与所述picsl4723-p1载体的摩尔比为2:1;pich41800接头载体,与所述picsl4723-p1载体的摩尔比为2:1;5units bsai内切酶;5units bpii内切酶;200units t4连接酶;1.5μl t4连接酶缓冲液;1.5μl bsa,1mg/ml;h2o补足至20μl;
[0023]
反应程序为:37℃,3min、16℃,4min,循环26次;80℃,5min;
[0024]
反应结束后,取反应液转化大肠杆菌dh10b热击感受态,在含卡那霉素的lb固体培养基上生长;挑选阳性克隆,lb液体培养基培养,提质粒,测序后获得正确的level 2载体。
[0025]
本发明的第二方面是提供一种通过如上述联合载体构建方法所得到的联合载体。
[0026]
本发明的第三方面是提供一种提高辅酶q
10
含量番茄的生产方法,将由如上述构建方法所得到的联合载体通过热击转化农杆菌gv3101,并转化野生型番茄;获得独立的抗性愈伤组织后,进一步分化再生即得高辅酶q
10
含量的番茄株系。
[0027]
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
[0028]
野生型番茄果实中辅酶q
10
干重含量远低于0.02mg/g。经过培育筛选,本发明番茄株系hucd的t3代果实辅酶q
10
产量最高可以达到野生型番茄果实的7倍以上(~0.151mg/g),并能稳定遗传且表型无差异;即本发明的番茄株系hucd中辅酶q
10
含量显著提高。
附图说明
[0029]
图1为本发明联合载体的设计思路图;
[0030]
图2为本发明联合载体的结构示意图;
[0031]
图3为本发明检测实施例中hucd不同株系果实中辅酶q
10
含量的结果图;其中,字母a表示hucd-5与其他株系之间具有显著性差异;字母b表示hucd-4与hucd-2以及更低含量株系之间具有显著性差异;字母c表示hucd-2与hucd-1以及更低含量株系之间具有显著性差异;字母d表示hucd-1与wt之间具有显著性差异;字母bc表示hucd-3分别和hucd-4与hucd-2之间无显著性差异(n=5,p值<0.05)。
具体实施方式
[0032]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0033]
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
[0034]
下面结合附图和具体实施例对本发明作进一步说明,但不作为本发明的限定。
[0035]
实施例1
[0036]
如图1所示,辅酶q
10
的生物合成途径主要包括四个过程:(1)醌环前体芳香环结构的形成;(2)异戊二烯焦磷酸聚合成链;(3)芳香环结构与异戊烯基侧链的结合;(4)结合后醌环上的修饰。前三个过程直接决定了下游辅酶q
10
的产量。因此促进前三步反应过程是我们的技术方案的主要目标:
[0037]
(1)促进醌环前体芳香环结构的形成:辅酶q
10
醌环结构的前体是对羟基苯甲酸(4-hydroxybenzoic,4-hb)。在原核生物中,4-hb由分支酸裂解酶(chorismate lyase,ubic)催化分支酸裂解而成。在真核生物中,4-hb由苯丙氨酸或酪氨酸转化而来,然而具体形成过程尚不明确。因此我们采用过表达ubic催化分支酸替代苯丙氨酸或酪氨酸以补充4-hb的合成。
[0038]
(2)促进异戊二烯焦磷酸聚合成链:在植物中异戊二烯焦磷酸(isopentenyl diphosphate,ipp)主要由甲羟戊酸(mevalonic acid,mva)途径和2-c-甲基-d-赤藓糖醇-4-磷酸(mep)途径合成,其中用于辅酶q
10
合成的ipp主要来自于mva途径。在mva途径中,调控羟甲基戊二酸单酰coa(hydroxymethylglutaryl-coa,hmg-coa)向甲羟戊酸转变的hmg-coa还原酶(hmg-coa reductase,hmgr)是一步关键限速酶,它的表达直接影响了下游ipp的产量。对于辅酶q
10
而言,ipp经由细胞质转运到线粒体后,在线粒体内由十异戊烯基焦磷酸合酶(decaprenyl-diphosphate synthase,dps)催化聚合成十异戊烯基侧链。因此我通过提高hmgr表达,增加ipp的积累。继而通过上调dps的表达,将更多的ipp转化为十异戊烯基侧链。
[0039]
(3)促进芳香环结构与十异戊烯基侧链的结合:在线粒体内,十异戊烯基侧链经由对羟基苯甲酸异戊烯基转移酶(4-hydroxybenzoate polyprenyltransferase,coq2)催化与4-hb的c-3位置结合,形成辅酶q
10
结构前体,该步反应被认为是限制辅酶q
10
合成的最后一步关键酶。因此我们通过提高coq2表达,促进上游积累的4-hb和异戊烯基聚合侧链向下游辅酶q
10
方向转化。
[0040]
因此,本实施例提供一种可提高番茄中辅酶q
10
含量的联合载体构建方法,步骤包括:
[0041]
s1、提取番茄基因组dna,通过pcr扩增获得e8启动子序列;通过全合成获得烟草coq2基因(xm_016628012.1)编码序列,如seq id no.1所示;提取烟草(nicotiana tabacum)基因组rna,通过反转录获得cdna,再通过pcr扩增获得dps基因(nm_001325324.1)编码序列,如seq id no.2所示;通过全合成获得拟南芥hmgr2基因(ay143930.1,n段去掉了99个氨基酸)编码序列,如seq id no.3所示;通过全合成获得n端融合了番茄叶绿体信号肽
(nm_001308944.1,solanum lycopersicum ribulose bisphosphate carboxylase small chain 2a前67个氨基酸)的大肠杆菌ubic基因编码序列,如seq id no.4所示;提取拟南芥基因组dna,通过pcr扩增获得hsp终止子序列;
[0042]
其中,各所述的pcr扩增体系均为:模板(即500ng所述基因组dna或50ng所述cdna);0.2μm正向引物;0.2μm反向引物;10μl fastpfu缓冲液;0.2mm dntps;2.5units fastpfu dna聚合酶;h2o补足至50μl;
[0043]
pcr扩增程序均为:
[0044][0045]
其中,番茄基因组dna的pcr扩增引物如seq id no.6和seq id no.7所示;烟草cdna的pcr扩增引物如seq id no.8和seq id no.9所示;拟南芥基因组dna的pcr扩增引物如seq id no.10和seq id no.11所示。
[0046]
其中,通过所述全合成获得相应基因编码序列时,修改其中部分的碱基以去除bsai和bpii酶切位点。
[0047]
s2、通过golden gate克隆法将所述e8启动子序列连入载体puap1,以获得e8启动子的level 0载体;通过golden gate克隆法将所述coq2基因编码序列连入另一载体puap1,以获得coq2基因的level 0载体;通过golden gate克隆法将所述dps基因编码序列连入另一载体puap1,以获得dps基因的level 0载体;通过golden gate克隆法将所述hmgr2基因编码序列连入另一载体puap1,以获得hmgr2基因的level 0载体;通过golden gate克隆法将所述ubic基因编码序列连入另一载体puap1,以获得ubic基因的level 0载体;通过golden gate克隆法将所述hsp终止子序列连入另一载体puap1,以获得hsp终止子的level 0载体;
[0048]
其中,步骤s2中各所述的level 0载体构建体系均为:100ng puap1载体;步骤s1中所获得的相应序列片段(与所述puap1载体的摩尔比为2:1);5units bpii内切酶;200units t4连接酶;1.5μl t4连接酶缓冲液;1.5μl bsa(1mg/ml);h2o补足至20μl;
[0049]
反应程序均为:
[0050][0051][0052]
反应结束后,取10μl反应液转化大肠杆菌dh10b热击感受态,在含氯霉素的lb固体培养基上生长;挑选阳性克隆,lb液体培养基培养,提质粒,测序后获得相应正确的level 0载体。
[0053]
s3、通过golden gate克隆法将所述e8启动子序列、所述coq2基因编码序列和所述hsp终止子序列依次连入载体pich47742,以获得coq2基因的level 1载体;通过golden gate克隆法将所述e8启动子序列、所述dps基因编码序列和所述hsp终止子序列依次连入载
体pich47751,以获得dps基因的level 1载体;通过golden gate克隆法将所述e8启动子序列、所述hmgr2基因编码序列和所述hsp终止子序列依次连入载体pich47761,以获得hmgr2基因的level 1载体;通过golden gate克隆法将所述e8启动子序列、所述ubic基因编码序列和所述hsp终止子序列依次连入载体pich47772,以获得ubic基因的level 1载体;
[0054]
其中,步骤s3中各所述的level 1载体构建体系均为:相应的level 1载体(100ng);步骤s2中所获得的e8启动子的level 0载体(与所述相应的level 1载体的摩尔比为2:1);步骤s2中所获得的相应基因的level 0载体(与所述相应的level 1载体的摩尔比为2:1);步骤s2中所获得的hsp终止子的level 0载体(与所述相应的level 1载体的摩尔比为2:1);5units bsai内切酶;200units t4连接酶;1.5μl t4连接酶缓冲液;1.5μl bsa(1mg/ml);h2o补足至20μl;
[0055]
反应程序均为:
[0056][0057]
反应结束后,取10μl反应液转化大肠杆菌dh10b热击感受态,在含氨苄青霉素的lb固体培养基上生长;挑选阳性克隆,lb液体培养基培养,提质粒,测序后获得相应正确的level 1载体。
[0058]
s4、通过golden gate克隆法将35s启动子序列、潮霉素抗性基因编码序列和35s终止子序列,所述e8启动子序列、所述coq2基因编码序列和所述hsp终止子序列,所述e8启动子序列、所述dps基因编码序列和所述hsp终止子序列,所述e8启动子序列、所述hmgr2基因编码序列和所述hsp终止子序列,所述e8启动子序列、所述ubic基因编码序列和所述hsp终止子序列依次连入载体picsl4723-p1,所获得的level 2载体即为所述联合载体,如seq id no.5所示;
[0059]
其中,步骤s4中所述的level 2载体构建体系均为:100ng picsl4723-p1载体;picsl11059载体(与所述picsl4723-p1载体的摩尔比为2:1);步骤s3中所获得的coq2基因的level 1载体(与所述picsl4723-p1载体的摩尔比为2:1);步骤s3中所获得的dps基因的level 1载体(与所述picsl4723-p1载体的摩尔比为2:1);步骤s3中所获得的hmgr2基因的level 1载体(与所述picsl4723-p1载体的摩尔比为2:1);步骤s3中所获得的ubic基因的level 1载体(与所述picsl4723-p1载体的摩尔比为2:1);pich41800接头载体(与所述picsl4723-p1载体的摩尔比为2:1);5units bsai内切酶;5units bpii内切酶;200units t4连接酶;1.5μl t4连接酶缓冲液;1.5μl bsa(1mg/ml);h2o补足至20μl;
[0060]
反应程序为:
[0061][0062]
反应结束后,取10μl反应液转化大肠杆菌dh10b热击感受态,在含卡那霉素的lb固体培养基上生长;挑选阳性克隆,lb液体培养基培养,提质粒,测序后获得正确的level 2载
体,如图2所示。
[0063]
实施例2
[0064]
本实施例提供一种提高辅酶q
10
含量番茄的生产方法,将实施例1所获得的level 2载体通过热击转化农杆菌gv3101,并转化野生型番茄microtom;获得独立的抗性愈伤组织后,进一步分化再生即得番茄株系hucd。
[0065]
检测实施例
[0066]
测定番茄辅酶q
10
的含量:在果实变色期后同一时间采集冻干,按照1:20的比例加入异丙醇,低温避光超声提取1h,随后将过滤后的样品注入液相-质谱联用进行分析。液相条件如下:采用hplc-dad-ms(1260infinity ii-6460,agilent)搭配zorbax eclipse xdb c18柱(3.5μm,2.1
×
50mm),流动相(a)异丙醇,(b)87.5%乙腈水溶液(含10mmol/l乙酸铵),流动相条件为0-10min,70-15%b;10.5-20min,15-70%b,流速0.25ml/min。质谱条件如下:采用esi离子源,设置条件为毛细管电压为4.0kv,中性电压15psi,高纯氮气作为载气,流速11l/min;选取正离子模式对辅酶q10(母离子m/z 863.69,子离子m/z 197.1)进行测定,测定条件为解离电压230v,碰撞能量42v。
[0067]
检测结果:如图3所示,t3代(t3 generation)各株系辅酶q
10
含量显著高于野生型,其中hucd-5株系含量最高,约为0.151mg/g,高于野生型(<0.02mg/g)7倍以上。
[0068]
综上所述,野生型番茄果实中辅酶q
10
干重含量远低于0.02mg/g。经过培育筛选,本发明番茄株系hucd的t3代果实辅酶q
10
产量最高可以达到野生型番茄果实的7倍以上(~0.151mg/g),并能稳定遗传且表型无差异;即本发明的番茄株系hucd中辅酶q
10
含量显著提高。
[0069]
以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


