基因内microRNAmiR-483-3p在诱导巨噬细胞凋亡中的应用的制作方法
 2021-02-02 04:02:00|
2021-02-02 04:02:00| 448|
448| 起点商标网
起点商标网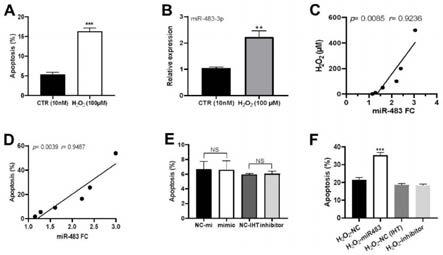
基因内microrna mir-483-3p在诱导巨噬细胞凋亡中的应用
技术领域
[0001]
本发明涉及基因内microrna mir-483-3p在诱导巨噬细胞凋亡中的应用,属于基因工程领域。
背景技术:
[0002]
冠心病和脑卒中等心脑血管疾病是严重危害人类健康的“头号杀手”,动脉粥样硬化(as)是这些疾病的关键病理基础之一。as的发病机制十分复杂,免疫炎在其中发挥关键作用。作为关键的免疫炎症细胞,巨噬细胞从初期的脂质条纹,到末期的斑块破裂或糜烂,在as发生发展的全过程都发挥核心作用。目前认为巨噬细胞凋亡在as病变早期是保护因素,能减轻早期动脉粥样硬化的发展;而在as病变晚期则加剧as进程,导致斑块不稳定,促使坏死核心形成,增加形成血栓的风险。影响巨噬细胞凋亡的因素及其机制非常复杂包括各种环境信号、细胞因子、脂质及其衍生物等,在as发生发展过程中巨噬细胞凋亡的机制仍未完全阐明。因此,有必要对as中巨噬细胞的凋亡机制开展更深入的研究。
[0003]
活性氧类(ros)是需氧细胞氧化呼吸代谢的产物,包括氧离子、过氧化物和含氧自由基等。生理浓度的ros作为信号分子,在各种细胞功能调控中发挥关键作用。如ros能刺激破骨细胞活性,促使其分化。然而,过量ros则引起氧化应激,导致细胞功能异常,如细胞迁移、增殖和凋亡异常等,这也是包括as在内的多种心血管疾病的重要发病机制
[0004]
内含子mirna是位于蛋白编码基因(host gene)内含子上的一类mirna,一般与主基因受同一启动子调控,表达模式一致,协同调控细胞功能。mir-483-3p是位于igf2基因内含2的典型内含子mirna,并被报道参与多种代谢性疾病和肿瘤的发生发展。如在鼠源3t3-l1细胞系中过表达mir-483-3p能通过限制脂肪细胞的脂质存储而引发脂毒性和胰岛素抵抗;抑制mir-483-3p则能促进内皮祖细胞归巢。mir-483-3p在肾母细胞瘤、结肠癌、肝癌等中过表达,能抑制肿瘤细胞凋亡,促进肿瘤发生。但也有研究显示mir-483-3p促进肿瘤细胞凋亡,抑制增殖,从而抑制肿瘤发病。此外,mir-483-3p在人小梁网细胞中能抑制靶基因smad4表达,从而对抗氧化应激对细胞外基质的上调。这些结果提示mir-483-3p的功能复杂,在不同种类的细胞和环境因素下的作用可能不同甚至相反。目前仍未有mir-483-3p在氧化应激诱导巨噬细胞凋亡中作用和机制的报道。
技术实现要素:
[0005]
本发明为解决上述内容,提供基因内microrna mir-483-3p在诱导巨噬细胞凋亡中的应用,诱导mir-483-3p上调能通过抑制靶基因med1,使其转录调控的下游促凋亡分子p53和p21表达升高,从而促进巨噬细胞凋亡,同时,上调的主基因igf2也能促进巨噬细胞凋亡。
[0006]
基因内microrna mir-483-3p在诱导巨噬细胞凋亡中的应用。
[0007]
进一步的,上述基因内microrna mir-483-3p的序列为seq id no.1。
[0008]
基因内microrna mir-483-3p诱导巨噬细胞凋亡的方法,包括如下步骤:上调巨噬
细胞内基因内microrna mir-483-3p的表达,从而抑制其靶基因med1表达,进而上调med1调控的p53/p21促进ros诱导的巨噬细胞凋亡。
[0009]
本申请还可以提供基因内microrna mir-483-3p在缓解高浓度h2o2引起的氧化应激中的应用。
[0010]
进一步的,上述应用的应用方法为:下调基因内microrna mir-483-3p在巨噬细胞中的表达。
[0011]
有益效果:
[0012]
本发明明确显示mir-483-3p的上调能抑制其靶基因med1的表达而增强p53依赖的凋亡通路,促进ros诱导的巨噬细胞凋亡。主基因igf2促进了mir-483-3p的上述作用。我们的研究有助于深入理解内含子mirna在ros引起的巨噬细胞功能紊乱中的作用,揭示其在as发生发展中的作用。
附图说明
[0013]
图1 mir-483-3p促进氧化应激诱导的巨噬细胞凋亡。
[0014]
图2 mir-483-3p预测的靶基因参与多种生物过程。
[0015]
图3 med1是mir-483-3p靶基因。
[0016]
图4 mir-483-3p通过med1-p53/p21轴与其主基因igf2促进ros诱导的巨噬细胞凋亡。
[0017]
图5 mir-483-3p通过med1-p53/p21轴及其主基因igf2协同促进ros诱导的巨噬细胞凋亡机制图.
具体实施方式
[0018]
为了使本技术领域人员更好地理解本申请中的技术方案,下面结合实施例对本发明作进一步说明,所描述的实施例仅是本申请一部分实施例,而不是全部,本发明不受下述实施例的限制。
[0019]
实施例
[0020]
1.材料方法
[0021]
1.1细胞系和细胞培养
[0022]
实验所用细胞系(hek293t,raw264.7)均从中国科学院上海细胞库购买。这些细胞复苏后都在含10%的胎牛血清中培养,所有细胞均在37℃和5%co2的孵箱中培养。
[0023]
1.2细胞处理和转染
[0024]
h2o2处理前一天将raw细胞按1
×
106接种到6孔板中。100μm h2o2刺激细胞作为实验组,对照组细胞为生理浓度下10nm h2o2处理的细胞(ctr)。24小时后收集细胞用于后续试验。在不同处理的巨噬细胞培养基中加入终浓度为200ng/ml的重组igf2活性蛋白(abcam,ab233678),48小时后收集细胞进行流式分析。293t细胞或raw细胞分别接种到6孔板中使细胞到60%-80%的密度。然后按照说明书,通过lipofectamine 3000试剂盒(l3000015,life technologies,carlsbad,usa)将质粒转染到293t细胞或raw细胞中。mirnas(mir-483-3p mimics,mir-483-3p inhibitors,以及对应的阴性对照)通过lipofectamine rnaimax试剂盒(13778150,life technologies)按终浓度为50nm转染到相应细胞中。mirna类似物
med1(phospho t1457)(ab60950,abcam,1:1000)。次日,相应的二抗(sa00001-1,sa00001-2,proteintech,1:1000)孵育1小时.chemidoc xrs+imaging system(bio-rad,hercules,usa)仪器上检测条带。image pro plus 6.0软件(media cybernetics,rockville,usa)分析蛋白条带灰度值。
[0032]
1.5双荧光素酶报告实验
[0033]
pcr扩增含预测的mir-483-3p结合位点的鼠源med1 3'utr序列。利用pcr技术突变med1 3'utr序列中mir-483-3p的结合位点,产生突变的med1 3'utr(mut)。将包含mir-483-3p预测结合位点的野生(wt)和突变(mut)序列的med1 3'utr序列分别克隆至pmir-glo载体(promega)。然后,lipofectamine 3000试剂盒(l3000015,life technologies,carlsbad,usa)和lipofectamine rnaimax试剂盒(13778150,life technologies)共转染mir-483-3p mimics or mir-483-3p-ncs以及上诉对应质粒到hek-293t细胞中。48小时后用dual-luciferase reporter assay system(promega)在centro lb 960microplate luminometer(berthold,germany)仪器上分析荧光值。
[0034]
1.6细胞凋亡
[0035]
raw264.7的细胞凋亡率用试剂盒fitc annexin v apoptosis detection kit i(bd,556547)。不同处理的细胞按1
×
105的细胞浓度重悬于1
×
binding buffer,加入5μl of fitc annexin v和5μl pi,在暗处室温(25℃)孵育15分钟。流式细胞仪(facscalibur,becton dickinson)检测细胞凋亡率。flowjo x software(flow jo,ashland,or,usa)用于数据分析。
[0036]
1.7数据分析
[0037]
所有统计分析均使用graphpad prism software(graphpad software inc.,san diego,ca,usa)进行。数据表示为平均值
±
sem,两组间统计分析用student's t-test,多组间检测用anova。pearson correlation检测相关性。p<0.05表示具有统计学意义。所有实验独立重复至少三次。
[0038]
2.结果
[0039]
2.1 mir-483-3p促进活性氧诱导的巨噬细胞凋亡
[0040]
图1中的a和b是用生理浓度10nm(ctr)和100μm h2o2分别处理小鼠巨噬细胞株raw 264.7,用流式细胞仪检测细胞凋亡(图1中的a),qpcr检测mir-483-3p表达量(图1中的b)。(图1中的a和b)pearson相关分析mir-483-3p的表达变化与双氧水的浓度(图1中的c)及巨噬细胞凋亡(图1中的d)的关系。(图1中的e)转染mir-483-3p、inhibitor及其相应nc后raw 264.7细胞凋亡的变化。(图1中的f)转染mir-483-3p、inhibitor以及nc对100μm h2o2处理的raw264.7细胞凋亡的影响。nc:negative control for mir-483-3p;nc-iht:negative control for mir-483-3p inhibitor。数据均用平均值
±
sem表示.student's t和anova检验用于检验差异显著性,n=6.***:p<0.001
[0041]
h2o2是细胞内的主要活性氧产物,高浓度的h2o2也是引起氧化应激的主要原因。生理浓度的h2o2并不引起巨噬细胞凋亡。但高浓度h2o2则明显引起巨噬细胞凋亡(fig.1a)。the real-time pcr结果表明与生理浓度对照组相比,高浓度h2o2处理24小时后巨噬细胞mir-483-3p的表达显著上调(图1中的b)。相关性分析表明mir-483-3p上调的幅度与双氧水的浓度及其诱导的巨噬细胞凋亡的比例显著正相关(图1中的c和d)。这提示mir-483-3p的
上调可能介导了双氧水引起的巨噬细胞凋亡。与转染相应随机序列的对照组相比,转染mir-483-3p mimic和inhibitor对巨噬细胞株praw 264.7的凋亡没有明显影响图1中的e);但在双氧水处理下,mir-483-3p mimic能显著增强巨噬细胞的凋亡,而mir-483-3p inhibitor则对双氧水诱导的巨噬细胞细胞凋亡没有显著影响(图1中的f)。这些结果indicated that mir-483-3p在ros诱导的巨噬细胞凋亡中发挥重要作用。
[0042]
2.2预测mir-483-3p参与多种生物学功能和通路包括细胞凋亡
[0043]
(图2中的a)argetscan、mirwalk、mirdb三个mirna靶基因预测工具预测的mir-483-3p潜在靶基因的韦恩图。(图2中的b和c)argetscan、mirwalk、mirdb三个mirna靶基因预测工具都预测的45个mir-483-3p潜在靶基因生物过程与分子功能(图2中的b)和kegg信号通路(图2中的c)的富集分析。颜色灰度的深浅代表富集通路中的p值(p<0.05)。x轴数字表示-log(pvalue)。*:p<0.05,***:p<0.01,***:p<0.001.
[0044]
为进一步揭示mir-483-3p促进双氧水诱导的巨噬细胞凋亡的机制,mir-483-3p的靶基因的预测用常用的靶基因预测软件targetscan,mirwalk and mirdb。为提高预测结果的准确性,选择这三个软件预测的mir-483-3p靶基因结果的交集作为mir-483-3p的潜在靶基因。取三个软件预测的45个交集基因为mir-483-3p的潜在靶基因图2中的a)。这45个mir-483-3p潜在靶基因的功能富集分析表明mir-483-3p涉及很多重要的生物学功能,其中包括细胞凋亡,细胞内脂质和胆固醇转运,ldl结合,细胞对应ros和免疫的反应(图2中的b)。其中细胞凋亡的调控富集最为显著。另外,这些mir-483-3p潜在靶基因的功能也在多条调控炎症和细胞增殖与凋亡的关键信号通路上显著富集,如nf-κb,noth1,wnt,p53 and igf1通路等(图2中的c)。这些结果提示mir-483-3p可能涉及多种功能,特别是在免疫炎症的调控中发挥重要作用。
[0045]
2.3 mir-483-3p靶向med1并在巨噬细胞中抑制其表达
[0046]
图3中的a显示med1 3
’-
utr内预测的mir-483-3p结合位点以及结合能。绿色字母表示3
’-
utr内与mir-483-3p种子区域互补的序列;红色字母表示用于构建双荧光素酶报告载体的3
’-
utr内mir-483-3p结合序列的突变位点。图3中的b和c是100μm h2o2处理raw264.7细胞后med1在mrna(b)和蛋白(c)水平上的表达变化。ctr为生理浓度h2o2(10nm)处理的细胞。图3中的d为pearson相关分析med1在mrna 和蛋白与mir-483-3p表达变化。(图3中的e、f、g)mir-483-3p mirna及其inhibitor对med1表达的影响at mrna(图3中的e和f)和蛋白(图3中的g)水平。nc:negative control for mir-483-3p mimic;nc-iht:negative control for mir-483-3p inhibitor。(图3中的g)分别将含med1 3
’-
utr中mir-483-3p结合位点的序列(wt)及其突变体(mut)的双荧光素酶报告载体与mir-483-3p共转染h293t细胞。nc:negative control for mir-483-3p mimic.relative luciferase active(fl/rl)是萤火虫/海参荧光值与同样处理的nc组归一化后的比值。数据表示为平均值
±
sem。student's t和anova检验用于检验差异显著性。n=7。*:p<0.05,***:p<0.001.
[0047]
targetscan等多个靶基因预测软件都显示med1是mir-483-3p的潜在靶基因。rnahybrid的分析结果也表明med1 3'-utr序列中存在与mir-483-3p种子序列的结合位点,而且结合能低至-22.4kcal/mol(图3中的a)。这提示med1很可能是mir-483-3p的靶基因。另外,高浓度(100μm)h2o2在诱导raw细胞凋亡的同时也显著下调med1 mrna和蛋白的表达图3中的b和图3中的c)。而且,med1 mrna和蛋白的下调与mir-483-3p表达的上调都显著负相关
(图3中的d)。在mrna水平,与随机对照序列相比,mir-483-3p mimic能显著下调巨噬细胞med1的表达,而mir-483-3p inhibitor的作用则完全相反,在蛋白水平,mir-483-3p mimic也能显著下调巨噬细胞med1的表达,但mir-483-3p inhibitor对med1蛋白的表达没有显著影响(图3中的e和f)。双荧光素酶报告载体实验was performed to验证med1 3'-utr序列是否与mir-483-3p结合。med1 3'-utr中mir-483-3p的预测结合位点的野生型序列(wt)和突变序列(mut)分别克隆到pmir-glo双荧光素酶报告载体。然后,这些载体分别与mir-483-3p mimic共转染293t细胞。结果表明共转染mir-483-3p和野生型报告载体能显著降低荧光素酶的活性;而共转染mir-483-3p mimic和突变型报告载体则对荧光素酶的活性没有明显影响(图3中的g)。这些结果都表明med1是mir-483-3p的靶基因,其表达也被mir-483-3p抑制。
[0048]
2.4 mir-483-3p通过med1-p53/p21轴及其主基因igf2协同促进ros诱导的巨噬细胞凋亡
[0049]
图4中的a图示mir-483-3p与宿主基因igf2在基因组的位置。图4中的b显示了100μm h2o2处理raw264.7细胞后igf2在mrna水平的变化。ctr:生理浓度h2o2(10nm)处理的细胞。图4中的c显示pearson相关分析igf2与mir-483-3p的mrna表达变化关系。图4中的d显示转染mir-483-3p后加和不加igf2蛋白对100μm h2o2刺激后raw264.7细胞凋亡的影响。图4中的e显示raw264.7细胞100μm h2o2处理并转染mir-483-3p后p53和p21在mrna水平上的表达变化。nc:negative control for mir-483-3p.图4中的f-i显示pearson相关分析med1 mrna的表达变化与p53(图4中的f)和p21(图4中的g)的表达变化,以及raw264.7细胞凋亡率和p53(图4中的h)、p21(图4中的i)的表达变化的相关性。数据均用平均值
±
sem显示。student's t和anova用于检验差异显著性,n=6。*:p<0.05.
[0050]
mir-483-3p位于igf2基因的第二个内含子,是典型的内含子mirna(图4中的a)。巨噬细胞用100μm h2o2处理,mir-483-3p的主基因igf2在mrna水平的表达也显著升高。而且igf2 mrna水平增加的倍数与双氧水诱导的mir-483-3p的表达上调显著正相关(图4中的b和c)。这一高的相关性间接证明mir-483-3p与其主基因igf2可能共用一套相同的转录调控元件。考虑到igf2主要是作为分泌蛋白发挥作用,所以用igf2蛋白处理巨噬细胞。结果表明igf2单独处理对双氧水诱导的巨噬细胞凋亡没有显著影响。但igf2与mir-483-3p一起处理巨噬细胞则能显著增强双氧水诱导的巨噬细胞凋亡。这一结果反映了内含子mirna与其主基因协同发挥特定功能的作用特点(图4中的d)。此外,有研究证明med1能直接调控关键凋亡相关基因p53的表达,p53则能调控下游p21的表达。在巨噬细胞中,mir-483-3p mimic能显著下调med1的表达,并使p53和p21的表达显著升高(图4中的e)。而且,med1的表达变化与p53和p21的表达变化显著负相关,而双氧水诱导的巨噬细胞凋亡则与这些变化显著正相关图4中的f-i)。这些结果表明mir-483-3p能通过其靶基因med1及后者的下游分子p53/p21促进氧化应激诱导的巨噬细胞凋亡,同时,上调的主基因igf2也能促进巨噬细胞凋亡。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



