一种分析长链非编码RNA在胶质瘤中分子机制的实验方法与流程
 2021-02-02 04:02:07|
2021-02-02 04:02:07| 310|
310| 起点商标网
起点商标网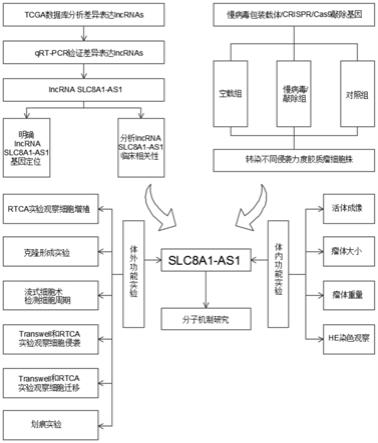
一种分析长链非编码rna在胶质瘤中分子机制的实验方法
技术领域
[0001]
本发明实施例涉及生物工程技术领域,具体涉及一种分析长链非编码rna在胶质瘤中分子机制的实验方法。
背景技术:
[0002]
胶质瘤(glioma)是成年人最常见的颅脑原发性恶性肿瘤,是高侵袭性和致死性的人类癌症类型之一。近20年,胶质瘤的发病率逐年上升。然而数据统计显示,70年以来,针对胶质瘤的传统治疗手段如手术、放疗、化疗并未取得突破性进展。尽管随着分子生物学技术的迅速发展,分子遗传学诊断为化疗敏感性少突胶质瘤患者带来福音,但大多数胶质瘤患者的总体生存率仍然不令人满意,尤其是胶质母细胞瘤患者,其中位生存期仅14个月,其根本原因在于,胶质瘤的发病机制还不完全清楚。因此,阐明胶质瘤的发病机制并寻找有效的治疗靶点具有重要的理论和实践意义。
[0003]
目前,世界卫生组织(who)根据组织学特征将胶质瘤分为星形细胞瘤,少突胶质细胞瘤以及混合性寡星形细胞瘤三大类。星形细胞瘤通常包括毛细胞型星形细胞瘤(ⅰ级)、弥漫性星形细胞瘤(ii级)、间变性星形细胞瘤(ⅲ级)和胶质母细胞瘤(ⅳ级)。与其它肿瘤相类似,胶质瘤的发生与基因表达的异常尤其相关。ⅰ级星形细胞瘤最早发生的改变是血小板衍生生长因子(platelet-derived growth factor,pdgf)配体和受体过表达,导致生长因子自分泌和tp53基因失活。tp53基因失活促进细胞异常分裂和间变性转化。胶质母细胞瘤除了tp53基因突变外,纯合子p16/cdkn2a缺失导致细胞阻滞于g1期至s期。以上研究提示从基因层面深入研究胶质瘤发生发展机制,设计基于胶质瘤发生发展机制的细胞或分子策略,可能成为治疗恶性胶质瘤的新途径。长链非编码rna(long non-coding rna,lncrna),核苷酸长度>200nt,可从表观遗传学、转录及转录后等多个层次实现对基因的表达调控。lncrna,尽管最初被认为是“转录噪声”,但人们逐渐认识到,lncrna作为细胞状态的特定信号,可以识别肿瘤细胞,并提供预后信息,甚至成为新的治疗靶点。越来越多的证据表明,lncrna的异常表达与胶质瘤的发生、转移、预后和治疗密切相关。在胶质瘤中,lncrna neat1通过与ezh2相互作用,促进axin2,icat和gsk3β启动子区h3k27甲基化,负向调控wnt/β-catenin信号通路。在胶质母细胞瘤中,lncrna crnde与mir-38竞争结合其下游靶基因(stat3、cyclin d和bcl-2),并保护其靶基因不被mir-38降解。lncrna foxm1-as促进转录因子foxm1与去甲基化酶alkbh5相互作用,导致foxm1去甲基化和表达升高,升高的转录因子foxm1进一步促进胶质瘤干细胞(glioma stem cells,gsc)的自我更新。尽管目前已发现许多lncrna通过影响gsc活性,促进肿瘤细胞增殖,促进血管增生,增强药物抵抗等作用在胶质瘤的进程中发挥重要作用,然而,起关键作用的lncrna在胶质瘤疾病进程中的分子机制仍有待进一步研究,而在现有技术中暂时还没有完善的研究过程,无法从宏观到微观展示整个分子机制变化,而且现有技术中没有考虑到实验过程中因为细胞自身生命周期等导致的异常因素,从而在分析过程中可能将不稳定因素也囊括其中。
技术实现要素:
[0004]
为此,本发明实施例提供一种分析长链非编码rna在胶质瘤中分子机制的实验方法,以解决现有技术中研究方法不完善不能整个准确展示分子机制的问题。
[0005]
为了实现上述目的,本发明的实施方式提供如下技术方案:
[0006]
一种分析长链非编码rna在胶质瘤中分子机制的实验方法,通过分析tcga数据库筛选出胶质瘤中差异表达的lncrna,通过体外实验分析lncrna调控wnt/β-catenin信号通路影响胶质瘤细胞增殖、侵袭和迁移行为,进一步在体内验证lncrna在胶质瘤疾病发生发展中的功能;
[0007]
具体包括如下步骤:
[0008]
步骤1、分析tcga数据库,分析胶质母细胞瘤组织和瘤旁正常脑组织的lncrna表达谱的差异lncrna,设定筛选标准,并以筛选标准进行筛选,锁定与胶质瘤有关的lncrna;
[0009]
步骤2、利用转染试剂盒转染lncrna smart silencer质粒进入具有不同侵袭力的胶质瘤细胞株,在体外分别验证细胞周期变化、胶质瘤细胞株侵袭能力变化和胶质瘤细胞迁移能力变化;
[0010]
步骤3、lncrna smart silencer转染胶质瘤细胞株,沉默lncrna并经qrt-pcr验证后建立基因沉默组,将基因沉默组分别与空载组形成对照组种植在裸鼠双侧腋下形成对照,观察lncrna对裸鼠皮下成瘤的影响。
[0011]
作为本发明的一种优选方案,所述lncrna具体为lncrna slc8a1-as1。
[0012]
作为本发明的一种优选方案,在步骤1中,所述筛选标准为|log2foldchange|≥2且p<0.01,其中,log2foldchange为每组实验的平均归一化值,具体为log2倍数变化,p为统计值。
[0013]
作为本发明的一种优选方案,在步骤1中还包括统计分析lncrna的fpkm值在胶质母细胞瘤组织和瘤旁正常脑组织间的统计学差异,并依据所述统计学差异验证tcga数据库的分析结果。
[0014]
作为本发明的一种优选方案,从数据库选取不同级别的胶质母细胞瘤组织,并分别与正常脑组织对照,提取各个组织中的rna,并通过qrt-pcr技术检测不同级别胶质母细胞瘤组织中lncrna的表达水平,并分析lncrna作为胶质瘤诊断标志物的敏感性。
[0015]
作为本发明的一种优选方案,在步骤2中:
[0016]
验证细胞周期变化的具体方法为,采用流式细胞术检测lncrna smart silencer干扰lncrna slc8a1-as1后细胞周期的变化,在流式细胞术处理之前先将待处理物进行分解,并将分解后的组织或者细胞通过前置分选方法进行初步筛分,并根据筛分的分区情况对不同分区的组织或者细胞进行不同荧光标定,进行荧光标定之后将组织或者细胞再进行充分混合后进行流式细胞术检测,并在检测的过程中始终检测荧光分区和聚集情况;
[0017]
验证胶质瘤细胞株侵袭能力变化的具体方法为,利用transwell实验和rtca技术监测胶质瘤细胞侵袭能力的改变;
[0018]
验证胶质瘤细胞迁移能力变化的具体方法为,通过划痕实验和rtca技术监测胶质瘤细胞迁移能力的变化,在进行划痕实验之前先对指定区域进行检测标记,在进行划痕实验之后,通过显影方式实时观察细胞的迁移和更替情况,并依据设定的时间区间保留显影分布图,在划痕实验结束依据不同时间区间的显影分布图进行对照分析。
[0019]
作为本发明的一种优选方案,在步骤2中通过western-blot技术检测lncrna smart silencer干扰lncrna表达所述胶质瘤细胞株的wnt/β-catenin信号通路中磷酸化β-catenin(p-β-catenin)和磷酸化gsk3β(p-gsk3β)表达水平以及hippo信号通路中磷酸化yap-1(p-yap1)表达水平的变化。
[0020]
作为本发明的一种优选方案,在步骤3中,定期检测种植瘤的生长状况,并将种植瘤的生长情况以数据的形式表征出来,以不同的对照参数建立不同的坐标系,将种植瘤的生长情况以时间轴表示在同一个相同对照参数的坐标系中,并根据在坐标系中的变化趋势标定在活体或种植瘤上,以便对后续分析建立导向;
[0021]
取样肿瘤,采用常规4%多聚甲醛固定、脱水、石蜡包埋后切片,行he染色,在普通光学显微镜下观察肿瘤组织浸润情况,并将浸润情况与所述变化趋势进行一一对应以剔除异常数据,将能够一一对应的浸润情况和所述变化趋势进行数值分析以验证成瘤情况。
[0022]
另外,在本发明中还提供一种基于前述方法的lncrna应用,所述lncrna为lncrna slc8a1-as1。
[0023]
本发明的实施方式具有如下优点:
[0024]
本发明通过分析tcga数据库,筛选出胶质瘤中差异表达的lncrna slc8a1-as1,通过体外功能实验和体内功能实验相结合的研究,论证和展示了lncrna slc8a1-as1在胶质瘤细胞增殖、侵袭和迁移过程中的具体分子机制。
附图说明
[0025]
为了更清楚地说明本发明的实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是示例性的,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图引伸获得其它的实施附图。
[0026]
图1为本发明实施方式中的流程图;
[0027]
图2是差异基因表达的火山图及差异表达的基因数示意图;
[0028]
图3为本发明实施方式中tcga数据库以及组织样本中lncrna slc8a1-as1的表达值图;
[0029]
图4为本发明实施方式中lncrna slc8a1-as1体外功能验证图;
[0030]
图5为本发明实施方式中体外条件下抑制lncrna slc8a1-as1的表达对胶质瘤细胞侵袭和迁移的影响图;
[0031]
图6为本发明实施方式中lncrnaslc8a1-as1相关信号通路检测图;
[0032]
图7为本发明实施方式中lncrna slc8a1-as1在体内条件下影响胶质瘤细胞增殖图。
具体实施方式
[0033]
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0034]
如图1所示,本发明提供了一种分析长链非编码rna在胶质瘤中分子机制的实验方法,包括通过分析tcga数据库筛选出胶质瘤中差异表达的lncrna,通过体外实验分析lncrna调控wnt/β-catenin信号通路影响胶质瘤细胞增殖、侵袭和迁移行为,进一步在体内验证lncrna在胶质瘤疾病发生发展中的功能。
[0035]
其中,lncrna具体为lncrna slc8a1-as1。
[0036]
该实验方法验证了lncrna slc8a1-as1在胶质瘤发生发展中的功能并探究lncrna slc8a1-as1调控wnt/β-catenin信号通路在胶质瘤疾病进程中的具体分子机制。
[0037]
为了更好的说明上述实验方法验证的具有新功能lncrna在胶质瘤中应用,将结合具体的实施例从以下步骤进行阐述:
[0038]
分析tcga数据库,筛选胶质母细胞瘤组织和瘤旁正常脑组织的lncrna表达谱存在的差异,设定筛选标准,并以筛选标准的差异倍数进行筛选,锁定与胶质瘤有关的lncrna。
[0039]
以|log2foldchange|>2且p<0.01为筛选标准(log2foldchange为每组实验的平均归一化值,具体为log2倍数变化),通过分析tcga数据库发现,胶质母细胞瘤组织与正常脑组织lncrna表达谱存在显著差异。如表1和图2所示,在图2中x轴为每组的平均归一化值(log2倍数变化),y轴的值是每组的平均归一化值(-log10的p值)。
[0040]
由表1和图2中可以发现235个lncrna显著上调,450个lncrna显著下调,按照差异倍数进行筛选。
[0041]
在本实施方式中,锁定了多个可能与胶质瘤发生发展有关的lncrna,选取其中差异较为显著的lncrna,如lncrna ak311383、lncrna ak094117、lncrna slc8a1-as1、lncrna tbx5-as1。
[0042]
表1差异表达的基因数(|log2foldchange|>2且p<0.01)
[0043][0044][0045]
统计分析发现lncrna slc8a1-as1的fpkm值在胶质母细胞瘤组织和瘤旁正常脑组织间差异具有统计学意义,差异最为显著,且roc值大于0.8,选择lncrnaslc8a1-as1进行后续实验研究。
[0046]
从数据库(胶质瘤标本库)中选取不同级别的胶质母细胞瘤组织,并分别与正常脑组织对照,提取各个组织中的rna,并通过qrt-pcr技术检测不同级别胶质母细胞瘤组织中lncrna的表达水平,并分析lncrna作为胶质瘤诊断标志物的敏感性。
[0047]
进一步在67例胶质瘤组织和7例正常脑组织中检测差异lncrna的表达,如图3所示,图中:
[0048]
a.tcga数据库中lncrna slc8a1-as1的表达值(log2);
[0049]
b.组织样本中lncrna slc8a1-as1的表达值(2
-△△
ct);
[0050]
c.tcga数据库中lncrna slc8a1-as1 roc曲线分析;
[0051]
d.组织样本中lncrna slc8a1-as1 roc曲线分析。
[0052]
由图3的分析结果发现lncrna slc8a1-as1差异较为显著,且高表达于胶质瘤组织,roc值大于0.9,与tcga数据库分析结果相一致。通过上述初步分析认为:lncrna slc8a1-as1可能参与了胶质瘤发生发展的疾病进程。
[0053]
为更好的说明该实验过程,需要对lncrna slc8a1-as1分子特征做进一步的解释说明:
[0054]
lncrnaslc8a1-as1,作为slc8a1基因的反义rna是一个已知的lncrna,定位于人类第2号染色体上,是长度约为1002nt的核苷酸序列,无蛋白编码能力。
[0055]
为了进一步研究lncrna slc8a1-as1在胶质瘤疾病发展中的作用,将从体外功能实验和体内功能实验分别进行验证。
[0056]
体外功能实验:利用转染试剂盒转染lncrna slc8a1-as1 smart silencer进入具有不同侵袭力的胶质瘤细胞株,在体外分别验证细胞周期变化、胶质瘤细胞株侵袭能力变化和胶质瘤细胞迁移能力变化。
[0057]
如图4所示,其中:
[0058]
a.利用rtca技术实时监测u87mg细胞和ln382细胞增殖能力变化;
[0059]
b.u87mg细胞和ln382细胞克隆形成能力变化;
[0060]
c.u87mg细胞和ln382细胞细胞周期变化。
[0061]
无限增殖是胶质瘤细胞的重要特性,利用rtca技术(xcelligence实时细胞分析,real time cell analysis)实时监测胶质瘤细胞增殖曲线,发现lncrna slc8a1-as1 smart silencer干扰后,与对照组增殖曲线相比,u87mg细胞和ln382细胞增殖速率受到明显抑制(图4a)。此外,lncrna slc8a1-as1 smart silencer干扰后u87mg细胞和ln382细胞克隆形成能力同样受到抑制(图4b)。细胞周期失调是肿瘤细胞增殖的重要原因,为了进一步探讨lncrna slc8a1-as1是否通过影响细胞周期进程而促进胶质瘤的增殖,申请人采用流式细胞术分析细胞周期。结果表明,lncrna slc8a1-as1 smart silencer干扰后u87mg和ln382细胞在g2期出现明显的细胞周期阻滞,s期细胞数减少,g2/m期细胞数明显增加。这些结果表明lncrna slc8a1-as1可能通过诱导细胞周期阻滞参与胶质瘤细胞增殖(图4c)。
[0062]
胶质瘤细胞是最具侵袭性的脑肿瘤之一,具有强大的侵袭和迁移能力。如图5所示:
[0063]
图5a、b为rtca技术监测u87mg和ln382细胞侵袭和迁移行为;
[0064]
图5c为划痕实验监测u87mg和ln382细胞迁移行为;
[0065]
图5d为western-blot检测emt信号通路中关键蛋白表达水平。
[0066]
应用rtca技术发现,lncrna slc8a1-as1 smart silencer干扰后,能够侵袭和迁移至下室的细胞较对照组明显减少(图5a、b);进一步通过细胞划痕实验验证胶质瘤细胞的迁移能力发现,lncrna slc8a1-as1smart silencer干扰后,与对照组相比,能够通过膜孔迁移的肿瘤细胞数目显著下降(图5c)。
[0067]
上皮细胞-间充质转化(epithelial-mesenchymal transition,emt)是恶性肿瘤细胞获得侵袭和迁移能力的重要生物学过程,western-blot检测发现,lncrna slc8a1-as1 smart silencer干扰后,e-钙黏蛋白(e-cadherin)、组织紧密连接蛋白(claudin)表达增加,而n-钙黏蛋白(n-cadherin)、波形蛋白(vimentin)表达减少(图5d),提示
lncrnaslc8a1-as1可能通过影响胶质瘤细胞emt而促进肿瘤细胞迁移,然而其分子机制不清。
[0068]
wnt/β-catenin信号通路,在人类肿瘤中通常处于异常激活状态,促进肿瘤细胞侵袭和迁移。为探讨lncrna slc8a1-as1调控胶质瘤细胞侵袭和迁移的可能机制,利用western-blot分析方法研究了lncrna slc8a1-as1基因敲除对wnt/β-catenin通路的影响。western-blot分析表明,下调lncrna slc8a1-as1可显著降低磷酸化gsk-3β(p-gsk3β)和磷酸化β-catenin(p-β-catenin)的水平,而gsk-3β和β-catenin的总水平无明显变化。此外,hippo信号通路也参与了肿瘤的增殖、侵袭和迁移过程中起着重要作用。
[0069]
如图6所示:
[0070]
图6a为下调lncrna slc8a1-as1对wnt/β-catenin以及hippo信号通路的影响;
[0071]
图6b为transwell实验代表性图像显示xav939部分逆转了lncrna slc8a1-as1对胶质瘤细胞侵袭迁移的促进作用,其中xav939为wnt/β-catenin信号通路抑制剂。
[0072]
研究证实了hippo通路不参与胶质瘤的发展(图6a)。此外,xav939抑制wnt/β-catenin信号通路部分逆转了lncrna slc8a1-as1诱导的胶质瘤细胞侵袭和迁移。以上数据表明lncrna slc8a1-as1通过激活wnt/β-catenin信号通路促进胶质瘤的疾病进展(图6b)。
[0073]
进一步通过裸鼠成瘤实验探究了lncrna slc8a1-as1在体内的功能,图7a显示了在裸鼠右腋窝注射u87mg细胞35天后,lncrna slc8a1-as1沉默组和对照组异种移植瘤的形态。图7b和图7c显示了lncrna slc8a1-as1沉默组的肿瘤大小和平均肿瘤重量较对照组明显减小。
[0074]
为验证上述分子机制,采用如下方式进行验证:
[0075]
验证细胞增殖的具体方法为:利用rtca技术和克隆形成实验监测胶质瘤细胞增殖。rtca技术监测胶质瘤细胞增殖的具体操作为:接种8
×
103个u87mg细胞、ln382细胞于cim设备,转染lncrna slc8a1-as1 smart silencer,在含10%胎牛血清的培养基中培养,培养箱中培养140小时,通过监测阻抗信号的变化来跟踪细胞的增殖;克隆形成实验的具体操作为:将u87mg细胞及ln382细胞以每孔2
×
102个细胞的比例接种在6孔培养板中,并在含有10%fbs的dmem中培养2周,然后用pbs缓冲液冲洗细胞两次,用甲醇固定,结晶紫染色,然后在倒置显微镜下计数并用相机采集代表性图像,所有实验分三次进行。
[0076]
验证细胞周期变化的具体方法为:碘化丙啶(pi)染色法测定dna含量,在rnase a(核糖核酸酶a)存在下,收获lncrna slc8a1-as1 smart silencer转染后的u87mg和ln382胶质瘤细胞,并用碘化丙啶染色20分钟,使用流式细胞仪进行分析。
[0077]
验证胶质瘤细胞株侵袭能力变化的具体方法为:利用transwell实验和rtca技术监测胶质瘤细胞侵袭能力的改变。transwell实验的具体方法为:在进行实验前预铺matrigel基质胶于培养室上腔,然后种植3
×
104个u87mg细胞、ln382细胞于培养室上腔,转染lncrna slc8a1-as1smart silencer,在无胎牛血清的培养基中培养,然后将上腔置于含10%胎牛血清的培养基中培养,24小时后用0.1%结晶紫染色30min,光镜下观察侵袭至培养室下腔的细胞并进行计数拍照;rtca技术监测胶质瘤细胞侵袭能力的具体方法为:在进行实验前预铺matrigel基质胶于cim设备上室,然后种植8
×
103个u87mg细胞、ln382细胞于cim设备上室,转染lncrna slc8a1-as1 smart silencer,在无胎牛血清的培养基中培养,然后将上室置于含10%胎牛血清的下室中培养,培养箱中培养120小时,通过监测阻抗信号
的变化来跟踪细胞的侵袭。
[0078]
验证胶质瘤细胞迁移能力变化的具体方法为,通过划痕实验及rtca技术检测胶质瘤细胞迁移能力的变化。划痕实验的具体方法为:将等量的u87mg和ln382细胞(5.0
×
105)接种于不含抗生素的6孔细胞培养板中,然后转染lncrna slc8a1-as1 smart silencer,待转染24小时细胞浓度达到90%左右时,用200μl无菌塑料移液管在培养皿上划一条均匀划痕,然后用无血清培养基冲洗细胞,清除碎片,分别于0小时和24小时观察细胞的迁移,在倒置显微镜下观察移行到划痕区域的细胞并拍照记录,通过计数移向划痕区域的细胞总数来量化迁移。该实验从每个培养孔中随机选择三个区域,并在每个实验中对每组三个孔中的细胞进行定量;rtca技术监测胶质瘤细胞迁移的具体方法为:接种8
×
103个u87mg细胞、ln382细胞于cim设备上室,转染lncrna slc8a1-as1smart silencer,在无胎牛血清的培养基中培养,然后将上室置于含10%胎牛血清的下室中培养,培养箱中培养120小时,通过监测阻抗信号的变化来跟踪细胞的迁移。
[0079]
在前述实验中,如采用流式细胞术检测处理之前先将待处理物进行分解,并将分解后的组织或者细胞通过前置分选方法进行初步筛分,并根据筛分的分区情况对不同分区的组织或者细胞进行不同荧光标定,进行荧光标定之后将组织或者细胞再进行充分混合后进行流式细胞术检测,并在检测的过程中始终检测荧光分区和聚集情况。在实验中,先将其进行初步筛分的作用在于将宏观上处于同一个分选级别的组织或者细胞进行聚集性的标定,并且在实际分析中,能够依据不同的分选级别进行灵活的荧光标定,从而在实验过程中,对于不同分选级别的组织或者细胞均具有不同的显色,以便在后续的流式细胞术分选和计数的过程中可以清晰的知晓其成分的宏观来源,从而确定扩散来源,以便与其他方法相互交叉验证,获得更加准确的分析效果,因为在现有的方式中只能实现分选和计数,而不能实现溯源,而且是多来源的溯源。而这也是本发明中观察方法区别于现有单纯流式细胞术的核心。
[0080]
验证胶质瘤细胞株侵袭能力变化的具体方法为,利用transwell实验和rtca技术监测胶质瘤细胞侵袭能力的改变;
[0081]
验证胶质瘤细胞迁移能力变化的具体方法为,通过划痕实验和rtca技术监测胶质瘤细胞迁移能力的变化,在进行划痕实验之前先对指定区域进行检测标记,在进行划痕实验之后,通过显影方式实时观察细胞的迁移和更替情况,并依据设定的时间区间保留显影分布图,在划痕实验结束依据不同时间区间的显影分布图进行对照分析。
[0082]
在本发明中,细胞划痕实验室验证细胞的迁移能力,然而在该发明中不仅仅要考虑到细胞迁移,同时要考虑到细胞的生存周期以及损伤伤亡和细胞繁殖产生新细胞对迁移过程的影响,在现有分析过程中忽略了该过程,即即不考虑细胞的死亡,也不考虑细胞的繁殖增生,而是简单的根据细胞位置(形状)进行迁移能力的判定,该分析过程由于存在上述两种因素将会导致分析过程不准确,无法准确体现细胞迁移的现象。
[0083]
在本发明中通过显影的方式使得原生细胞能够显影,并且能够标识出已经死亡的细胞,仅仅不标识新生的细胞,从而以整个显影的范围来表示真实的细胞迁移,避免了现有技术中其他因素的干扰。
[0084]
验证lncrna slc8a1-as1调控胶质瘤细胞增殖、侵袭、迁移相关信号通路的具体方法为:首先制备用于蛋白质提取的细胞裂解物,蛋白裂解物用10%sds-page分离,转移到
0.22μm nc膜中,与抗体孵育。以β-actin蛋白作为对照。抗claudin、vimentin、e-cadherin、n-cadherin、gsk-3β、p-gsk-3β、β-catenin、p-β-catenin的抗体(1:1000)均购自abcam公司。抗β-actin(1:1000)抗体购自sigma公司。利用图像处理软件测量了条带灰度值。蛋白灰度值用β-actin的灰度值进行标准化,所有实验均重复三次。
[0085]
用裸鼠移植胶质瘤模型在体内验证lncrnaslc8a1-as1的作用具体方法为:lncrna slc8a1-as1 smart silencer转染u87mg和ln382细胞种植裸鼠双侧腋下,形成对照,35天后观察并比较lncrna slc8a1-as1种植瘤的生长状况。
[0086]
在上述中,定期检测种植瘤的生长状况,并将种植瘤的生长情况以数据的形式(生长参数,如大小半径、所占面积等)表征出来,以不同的对照参数建立不同的坐标系(即根据不同的生长参数对比建立不同的时间轴坐标系,以展示其生长状况),将种植瘤的生长情况以时间轴表示在同一个相同对照参数的坐标系中,并根据在坐标系中的变化趋势标定在活体或种植瘤上,以便对后续分析建立导向;
[0087]
取样肿瘤,采用常规4%多聚甲醛固定、脱水、石蜡包埋后切片,行he染色,在普通光学显微镜下观察肿瘤组织浸润情况,并将浸润情况与所述变化趋势进行一一对应以剔除异常数据,将能够一一对应的浸润情况和所述变化趋势进行数值分析以验证成瘤情况。
[0088]
本发明中首先通过坐标系的方式建立种植瘤的变化趋势,相当于对每一个种植瘤的变化标定了自身的属性,即后续的分析结果将不会影响其变化趋势,如两者不能对应则表明可能存在培养或者分析的异常,从而需要将改数据剔除以保证分析结果的准确性,这个过程为本发明中的导向。另外,在这个基础上对种植瘤的分析建立了数据化的分析结果,从而将整个分析过程不再局限于现有技术的定性分析上,而是更加准确的定量分析。
[0089]
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



