核酸的检测方法与流程
 2021-02-02 04:02:20|
2021-02-02 04:02:20| 369|
369| 起点商标网
起点商标网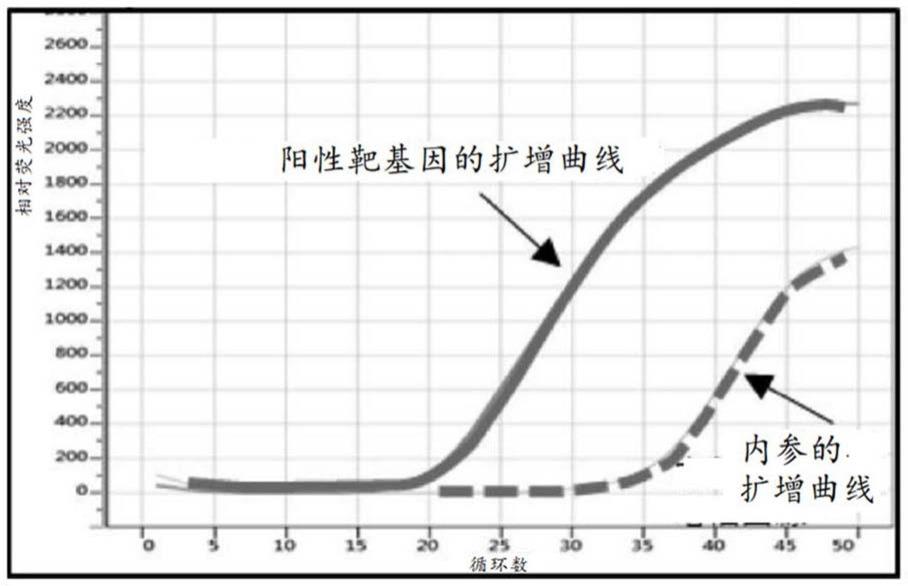
[0001]
本发明涉及通过逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,rt-pcr)检测被检体中的rna病毒的方法及用于执行该方法的试剂盒。更具体而言,涉及具有以下特征的检查方法及用于执行该方法的试剂盒:用于与被检体混合并得到作为分析试样的离心上清液的纯化水、生理盐水或缓冲液预先包含选自内参dna、与该dna特异性地杂交的正向及反向引物中的至少一个要素,另一方面,rt-pcr反应液不包含所述纯化水、生理盐水或缓冲液中包含的所述要素。
背景技术:
[0002]
为了防止细菌或病毒造成的感染及防止感染的扩大,确定细菌或病毒的感染者、细菌或病毒的污染物至关重要。作为该污染物,可以例举感染者的粪便、吐出物及被这些直接或间接地污染的物品类、以及被细菌或病毒污染的食品类等。
[0003]
在细菌或病毒的检测法中有各种方法,作为迅速测量的方法,普及有基于pcr法的核酸检测法。例如,作为迅速地以高灵敏度测量作为rna病毒的诺如病毒的方式,可以例举通过rt-pcr扩增诺如病毒的rna,测量扩增产物量的方法(专利文献1、2,非专利文献1)。在日本国内,根据厚生劳动省医药食品局食品安全部监视安全课的通知(非专利文献2、3),广泛地进行基于rt-pcr法的诺如病毒的检测及基于实时pcr法的诺如病毒的定量检测,还市售有诺如病毒检测试剂盒。
[0004]
在作为微生物的细菌或病毒污染的检查对象为粪便等排泄物的情况下,通常将粪便悬浮在纯化水或生理盐水等中而得的粪便乳剂高速离心分离,并将得到的离心上清液作为被检体,通过pcr或rt-pcr进行源自微生物的基因的分析。通常,在市售的核酸检查用试剂盒中包含内参dna,通过添加到pcr反应系统中,可以用作用于判断核酸的检测是否恰当地进行即判断pcr反应是否恰当地进行的指标。其结果为,即便在没有检测出相对于源自被检体中的微生物的核酸的扩增曲线或扩增产物的熔解曲线峰的情况下,在检测到内参dna的扩增曲线或扩增产物的熔解曲线峰时,也对微生物污染判定为真阴性。此外,若因源自被检体的成分而阻碍pcr反应,则虽然未检测到源自被检体中的微生物的核酸,但只要内参dna共存,内参dna也不会被检测出,因此能够避免被检体的微生物污染被误判定为阴性的情况(假阴性)。
[0005]
现有技术文献
[0006]
专利文献
[0007]
专利文献1:wo2002/029119
[0008]
专利文献2:wo2002/029120
[0009]
非专利文献
[0010]
非专利文献1:kageyama t等,《broadly reactive and highly sensitive assay for norwalk-like viruses based on real-time quantitative reverse transcription-pcr(基于实时定量逆转录pcr对诺瓦克样病毒的广泛反应性与高灵敏度测
量)》,临床微生物学杂志2003年4月;41(4):1548-57。
[0011]
非专利文献2:日本厚生劳动省医药食品局食品安全部监视安全课食安监发布第1105001号(平成15年11月5日)附件《关于诺如病毒的检测法》,最终修订:食安监发布0514004号(平成19年5月14日)
[0012]
非专利文献3:日本厚生劳动省医药食品局食品安全部监视安全课食安监发布第1105001号(平成15年11月5日)附件《关于诺如病毒的检测法》,最终修订:食安监发布1022第1号(平成25年10月22日)
技术实现要素:
[0013]
发明要解决的技术问题
[0014]
通常,在核酸检查用试剂盒中,在pcr反应液或rt-pcr反应液中包含作为内参的模板dna及引物等的pcr反应推进的全部要素。因此,即便在应检查微生物污染的被检体由于分析作业上的人为错误等而未添加到pcr反应液或rt-pcr反应液中的情况下,也会检测到内参dna的扩增曲线或扩增产物的熔解曲线峰,因此即便在分析对象的被检体中存在来源于微生物的基因,检查结果也会呈阴性,导致错误的判定(假阴性)。
[0015]
本发明的目的在于,提供一种防止假阴性的方法及用于执行该方法的检查用试剂盒,该假阴性是被检体由于人为错误而未添加到pcr反应液或rt-pcr反应液中,作为其结果,判定被检体的微生物污染为阴性。
[0016]
用于解决上述技术问题的方案
[0017]
本发明的目的通过以下发明达成。
[0018]
[1].一种方法,检测被检体中的rna病毒,其特征在于,包括:
[0019]
(1)使被检体悬浮于包含选自由内参dna、和与该dna特异性地杂交的正向及反向引物构成的组的至少一个要素的纯化水、生理盐水或缓冲液的工序;
[0020]
(2)提取在工序(1)中得到的悬浮液的离心上清液的工序;
[0021]
(3)将工序(2)中提取的离心上清液与被检体处理液混合的工序;
[0022]
(4)将工序(3)中得到的混合液与一步法rt-pcr反应液混合,进行rt-pcr的工序,其中,所述一步法rt-pcr反应液包含逆转录酶以及dna聚合酶且不包含在工序(1)中所选择的要素;以及
[0023]
(5)检测所述rt-pcr产物的工序。
[0024]
[2].如[1]所述的方法,其特征在于,所述被检体源自选自由生物试样、生物来源试样、环境试样以及环境来源试样构成的组的试样。
[0025]
[3].如[1]所述的方法,其特征在于,所述被检体源自选自由排泄物试样、排泄物来源试样、呕吐物以及呕吐物来源试样构成的组的试样。
[0026]
[4].如[1]所述的方法,其特征在于,所述rna病毒是诺如病毒。
[0027]
[5].如[4]所述的方法,其特征在于,所述诺如病毒的基因型为基因组i(gi)或基因组ii(gii)。
[0028]
[6].如[1]所述的方法,其特征在于,所述工序(3)中的被检体处理液包含1种以上的表面活性剂。
[0029]
[7].如[6]所述的方法,其特征在于,所述表面活性剂是阴离子表面活性剂。
[0030]
[8].如[7]所述的方法,其特征在于,所述阴离子表面活性剂选自下组:烷基硫酸盐、烷基醚硫酸盐、多库酯、磺酸盐含氟表面活性剂、烷基苯磺酸盐、烷基芳基醚磷酸盐、烷基醚磷酸盐、烷基羧酸盐、月桂酰基肌氨酸钠、羧酸盐含氟表面活性剂、胆酸钠和脱氧胆酸钠。
[0031]
[9].如[7]所述的方法,其特征在于,所述阴离子表面活性剂是烷基硫酸盐。
[0032]
[10].如[9]所述的方法,其特征在于,所述烷基硫酸盐是十二烷基硫酸钠或十二烷基硫酸铵。
[0033]
[11].如[6]~[10]的任一项所述的方法,其特征在于,所述表面活性剂的浓度为0.02~0.5%(w/v)。
[0034]
[12].如[1]所述的方法,其特征在于,所述工序(3)中的被检体处理液包含氢氧化物。
[0035]
[13].如[12]所述的方法,其特征在于,所述氢氧化物是氢氧化钠或氢氧化钾。
[0036]
[14].如[12]或[13]所述的方法,其特征在于,所述氢氧化物的浓度为10~100mm。
[0037]
[15].如[1]~[14]的任一项所述的方法,其特征在于,所述工序(3)中的离心上清液与被检体处理液的混合比作为体积比为1∶3~6。
[0038]
[16].如[1]所述的方法,其特征在于,所述工序(3)中的被检体处理液是诺如病毒检测试剂盒(探针法)(岛津制作所,产品编号241-09325系列)中包含的sample treatment reagent(样品处理剂)。
[0039]
[17].如[1]所述的方法,其特征在于,所述工序(4)中的一步法rt-pcr反应液是诺如病毒检测试剂盒(探针法)(岛津制作所,产品编号241-09325系列)中包含的nov reagent a、b以及c的混合物,且是不包含在所述工序(1)中所选择的要素的混合物。
[0040]
[18].如[1]所述的方法,其特征在于,所述逆转录酶选自由amv逆转录酶、mmlv逆转录酶、hiv逆转录酶以及它们的突变体构成的组。
[0041]
[19].如[1]所述的方法,其特征在于,所述dna聚合酶选自由taq dna聚合酶、tth dna聚合酶、kod dna聚合酶、pfu dna聚合酶及它们的突变体构成的组。
[0042]
[20].如[1]所述的方法,其特征在于,通过实时测量监视所述工序(5)中的rt-pcr产物的检测。
[0043]
[21].如[20]所述的方法,其特征在于,在所述实时测量中,通过使用荧光过滤器测量rt-pcr产物的扩增曲线或熔解曲线中的峰,从而判定被检体中的rna的存在是阳性还是阴性。
[0044]
[22].如[20]或[21]所述的方法,其特征在于,在所述实时测量中,通过测量pcr产物相对于内参dna的扩增曲线或熔解曲线中的峰,判定是否需要对被检体再检查。
[0045]
[23].一种试剂盒,用于检测被检体中的rna病毒,其特征在于,包含:
[0046]
(1)包含选自由内参dna、和与该dna特异性地杂交的正向及反向引物构成的组的至少一个要素的纯化水、生理盐水或缓冲液;
[0047]
(2)被检体处理液;以及
[0048]
(3)包含逆转录酶及dna聚合酶且不包含(1)中选择的要素的一步法rt-pcr反应液。
[0049]
[24].如[23]所述的试剂盒,其特征在于,所述逆转录酶选自由amv逆转录酶、mmlv
逆转录酶、hiv逆转录酶及它们的突变体构成的组。
[0050]
[25].如[23]所述的试剂盒,其特征在于,所述dna聚合酶选自由taq dna聚合酶、tth dna聚合酶、kod dna聚合酶、pfu dna聚合酶及它们的突变体构成的组。
[0051]
[26].如[23]所述的试剂盒,其特征在于,所述被检体处理液包含1种以上的表面活性剂。
[0052]
[27].如[26]所述的试剂盒,其特征在于,所述表面活性剂是阴离子表面活性剂。
[0053]
[28].如[27]所述的试剂盒,其特征在于,所述阴离子表面活性剂选自下组:烷基硫酸盐、烷基醚硫酸盐、多库酯、磺酸盐含氟表面活性剂、烷基苯磺酸盐、烷基芳基醚磷酸盐、烷基醚磷酸盐、烷基羧酸盐、月桂酰基肌氨酸钠、羧酸盐含氟表面活性剂、胆酸钠和脱氧胆酸钠。
[0054]
[29].如[27]所述的试剂盒,其特征在于,所述阴离子表面活性剂是烷基硫酸盐。
[0055]
[30].如[29]所述的试剂盒,其特征在于,所述烷基硫酸盐是十二烷基硫酸钠或十二烷基硫酸铵。
[0056]
[31].如[23]所述的试剂盒,其特征在于,所述被检体处理液包含氢氧化物。
[0057]
[32].如[31]所述的试剂盒,其特征在于,所述氢氧化物是氢氧化钠或氢氧化钾。
[0058]
[33].如[23]所述的试剂盒,其特征在于,所述被检体处理液是诺如病毒检测试剂盒(探针法)(岛津制作所,产品编号241-09325系列)中包含的sample treatment reagent(样品处理剂)。
[0059]
[34].如[23]所述的试剂盒,其特征在于,所述一步法rt-pcr反应液是诺如病毒检测试剂盒(探针法)(岛津制作所,产品编号241-09325系列)中包含的nov reagent a、b以及c的混合物,且是不包含在所述(1)中所选择的要素的混合物。
[0060]
发明效果
[0061]
根据本发明,在工序(1)中,为了供被检体悬浮而使用的纯化水、生理盐水或缓冲液包含选自由内参dna、和与该dna特异性地杂交的正向及反向引物构成的组的至少一个要素。另一方面,在工序(4)中使用的rt-pcr反应液不包含在工序(1)中使用的纯化水、生理盐水或缓冲液中加入的要素。因此,内参dna的扩增仅在将被检体与所述纯化水、生理盐水或缓冲液的悬浮液的离心上清液添加到所述rt-pcr反应液中的情况下产生。未产生内参dna的扩增的情况表示在rt-pcr反应中未供给被检体。如此,通过不向rt-pcr反应液中添加被检体,能够检测出被检体未被正确分析这样的人为错误,防止对于微生物污染的假阴性的判定。
附图说明
[0062]
图1是示出以下情况下的扩增曲线的图:将包含诺如病毒的粪便悬浮于包含内参dna、和与该dna特异性地杂交的正向及反向引物的各个要素的蒸馏水中,将得到的悬浮液的离心上清液与被检体处理液混合,将得到的混合液添加到不包含所述要素的一步法rt-pcr反应液中从而进行的实时pcr中的扩增曲线。
[0063]
图2是示出以下情况下的扩增曲线的图:将不包含诺如病毒的粪便悬浮于包含内参dna、和与该dna特异性地杂交的正向及反向引物的各个要素的蒸馏水中,将得到的悬浮液的离心上清液与被检体处理液混合,将得到的混合液添加到不包含所述要素的一步法
rt-pcr反应液中从而进行的实时pcr中的扩增曲线。
[0064]
图3是示出以下情况下的扩增曲线的图:将蒸馏水添加到不包含内参dna、和与该dna特异性地杂交的正向及反向引物的一步法rt-pcr反应液中从而进行的实时pcr中的扩增曲线。
具体实施方式
[0065]
本发明是利用rt-pcr对从被检体中的rna病毒中提取的rna进行扩增从而检测被检体中的rna病毒的存在的检查方法,且为防止在测量系统中未加入被检体的状态下进行检查而给出错误的检查结果这样的人为错误的方法。
[0066]
在本发明中,作为检测对象的rna病毒是具有rna作为基因组的病毒,可以例举具有由脂质双层构成的膜即包膜的冠状病毒、人免疫缺陷病毒、丙型肝炎病毒、日本脑炎病毒、登革热病毒等,以及不具有包膜的诺如病毒、轮状病毒、人鼻病毒等,但并不限定于这些病毒。
[0067]
作为本发明中的被检体,可以例举生物试样、生物来源试样、环境试样及环境来源试样等。作为生物试样,包括包含贝类的中肠腺等的动植物组织以及血液、唾液、鼻涕、组织分泌液等体液。例如,贝类作为诺如病毒造成的食物中毒的原因食品而最受重视。作为生物来源试样,包括对所述生物试样或其悬浮液进行例如超声等处理而得的试样。作为环境试样,可以例举包含大气、土壤、尘埃、水等的所有试样。作为环境来源试样,包括对所述环境试样进行了例如超声等处理而得的试样。
[0068]
作为本发明的另一实施方式,作为被检体可以例举排泄物试样、排泄物来源试样、呕吐物试样、呕吐物来源试样、唾液等体液试样及体液试样来源试样等。排泄物来源试样及呕吐物来源试样中包括拭子试样。拭子试样是指,以细菌或病毒污染的确认为目的,将用棉棒、棉片等擦拭手指、餐具、砧板、菜刀、烹调设备、厕所设备、住宅设备等取得的物质由磷酸盐缓冲液等洗脱而得的试样。对得到的洗脱液进行超离心分离而制成的离心沉渣能够作为被检体使用(宗村佳子等人、《食品卫生学杂志》、2017年58卷4号第201-204页)。
[0069]
在本发明的方法的工序(1)中,排泄物试样、呕吐物试样及体液试样等被检体是以5~10%(w/v)悬浮于包含选自由内参dna、和与该dna特异性地杂交的正向及反向引物构成的组的至少一个要素的纯化水、生理盐水或缓冲液从而制成乳剂或悬浮液。所述纯化水是利用直饮水通过单独的离子交换、蒸馏、反渗透或超滤等或组合这些而成的系统制造而得的。作为所述缓冲液,没有特别限定,可以例举磷酸盐缓冲液、tris缓冲液、硼酸盐缓冲液、hepes等两性离子(good's)缓冲液。所述乳剂或悬浮液在所述工序(2)中,以例如10000~12000rpm进行2~20分钟的离心分离,将得到的离心上清液在所述工序(3)中使用。
[0070]
在本发明的工序(3)中,通过使用被检体处理液,能够从被检体所包含的rna病毒中提取rna。在本发明的一实施方式中,工序(2)中使用的被检体处理液包含一种以上的表面活性剂。在本说明书中,“表面活性剂”是指作用于物质的边界面并改变其性质的物质的总称。表面活性剂具有在分子内有亲水性部分与疏水性部分两者的结构。表面活性剂分为阴离子表面活性剂、阳离子表面活性剂、两性表面活性剂及非离子表面活性剂。作为阴离子表面活性剂,可以例举烷基硫酸盐、烷基醚硫酸盐、多库酯、磺酸盐含氟表面活性剂、烷基苯磺酸盐、烷基芳基醚磷酸盐、烷基醚磷酸盐、烷基羧酸盐、月桂酰基肌氨酸钠、羧酸盐含氟表
面活性剂、胆酸钠和脱氧胆酸钠等,但不限定于这些。作为烷基硫酸盐,优选十二烷基硫酸钠(sodium dodecyl sulfate,sds)及十二烷基硫酸铵,更优选十二烷基硫酸钠。十二烷基硫酸钠也称为月桂基硫酸钠(sodium lauryl sulfate,sls)。作为阳离子表面活性剂,可以例举乙基三甲基溴化铵、十六烷基三甲基溴化铵、十四烷基三甲基溴化铵等,但不限定于这些。作为两性表面活性剂,例如可以例举甜菜碱及烷基氨基脂肪酸盐,但不限定于这些。作为非离子表面活性剂,可以例举壬基苯氧基聚乙氧基乙醇(np-40)、聚氧乙烯脱水山梨糖醇单油酸酯(tween(注册商标)80)、聚氧乙烯p-t-辛基苯酚(triton x-100(注册商标))等,但不限定于这些。
[0071]
若表面活性剂以一定浓度以上添加在水溶液中,则表面活性剂单体聚集而形成胶束。表面活性剂将要形成胶束的浓度被称为临界胶束浓度。在水溶液中,蛋白质或脂质的疏水性区域被引入表面活性剂胶束内部的疏水性区域,蛋白质或脂质被可溶化。在rna病毒粒子中,作为蛋白质的壳的衣壳或脂质构成的包膜在临界胶束浓度以上的表面活性剂的存在下被可溶化、改性或被破坏。其结果为,被封入衣壳中的rna变得容易成为在水溶液中暴露的状态。虽然表面活性剂的临界胶束浓度根据表面活性剂的种类而不同,但为了使病毒rna高效地暴露,优选被检体处理液中的表面活性剂的浓度为0.02~0.5%(w/v),更优选为0.05~0.2%(w/v),进一步优选为0.1%(w/v)。
[0072]
在本发明的工序(3)中,工序(2)中得到的离心上清液与被检体处理液的混合比优选作为体积比为1∶3~6,更优选为1∶4。通过将离心上清液与包含表面活性剂的被检体处理液混合,虽然混合液中的表面活性剂的浓度降低,但表面活性剂的上述浓度维持临界胶束浓度。
[0073]
在本发明的一实施方式中,所述被检体处理液包含氢氧化物。在本说明书中,“氢氧化物”是指作为阳离子的金属离子、与作为阴离子的氢氧根离子(oh-)离子键合而得的物质。金属是碱金属或碱土类金属。作为氢氧化物,可以例示氢氧化锂、氢氧化钠、氢氧化钾、氢氧化镁、氢氧化钙及氢氧化钡,优选氢氧化钠及氢氧化钾。氢氧化物示出强碱性,若溶解于水中则产生氢氧根离子,因此也被称为碱。氢氧化物在水溶液中改变蛋白质分子中的天冬氨酸、谷氨酸等解离性氨基酸的电荷状态,使蛋白质改性。通过该作用,若对rna病毒粒子进行碱处理,则会产生对衣壳的破坏。其结果为,被封入衣壳中的rna容易成为在水溶液中暴露的状态。为了使病毒rna高效地暴露,被检体处理液中的氢氧化物浓度优选为10~100mm,更优选为40~60mm,进一步优选为50mm。
[0074]
为了使由衣壳或脂质构成的包膜可溶化、改性或被破坏来使病毒rna高效地暴露,优选使表面活性剂与氢氧化物在所述被检体处理液中共存。
[0075]
用于使病毒rna自衣壳高效地暴露的本发明的工序(3)优选在1~60℃的温度下进行,更优选在1~50℃下进行,进一步优选在1~40℃下进行,最优选在1~30℃的室温下进行。优选将工序(2)中得到的离心上清液与被检体处理液混合后,放置3分钟以上。
[0076]
在从rna病毒提取rna的过程中,可以使用市售的诺如病毒检测试剂盒(探针法)(岛津制作所、产品编号241-09325系列、241-09325-91或241-09325-92)中包含的试剂sample treatment reagent(样品处理剂)。在该情况下,能够按照本试剂盒使用说明书提取rna。
[0077]
用于从rna病毒中提取rna的被检体处理液即便在与rt-pcr反应液混合的情况下,
也不会妨碍或几乎不会妨碍rt-pcr反应,只要能够提取rna,就没有特别限定。
[0078]
在所述工序(3)中,为了提高从rna病毒提取rna的效率,能够对在所述工序(2)中提取的离心上清液与被检体处理液的混合液进行热处理。作为热处理,例如可以例举在90℃下进行5分钟的加热处理,但为了提高rna提取效率可以改变加热温度与加热时间。
[0079]
在本发明的一实施方式中,被检体也可以是从试样分离、纯化后的rna。rna可以通过苯酚提取/水溶性有机溶剂沉淀的方法(专利5572578)、从高离液盐溶液沉淀、向二氧化硅吸附的方法等进行纯化。作为高离液盐溶液,可以使用基于苯酚-胍法的trizol(注册商标,英杰公司)及isogen(日本基因公司)等。作为向二氧化硅吸附的方法,可以使用市售的核酸纯化柱。例如,可以例举nucleospin rna(注册商标,宝生物工程公司)及purelink(注册商标,赛默飞世尔科技公司)。存在像这样的用于提取rna并进行纯化的各种方法对于本领域技术人员是公知的。
[0080]
在本发明的一实施方式中,在被检体中的rna是从试样分离、纯化出的rna的情况下,可以不执行本发明的工序(2)及(3),而是将在工序(1)中得到的溶液直接供给至工序(4)的rt-pcr。
[0081]
为了通过rt-pcr法检测被检体中的rna而在所述工序(4)中使用的一步法rt-pcr反应液的组成,只要是本领域技术人员就可以基于公知技术来构建。在本发明的一实施方式中,可以使用市售的诺如病毒检测试剂盒(探针法)(岛津制作所、产品编号241-09325系列、241-09325-91或241-09325-92)中包含的试剂。一步法rt-pcr反应液可以使用本试剂盒中包含的nov reagent a、b及c的混合物。nov reagent a含有镁离子、钾离子及tris。nov reagent b包含逆转录反应引物、用于扩增通过逆转录反应生成的cdna的pcr引物、内参dna以及与该dna特异性地杂交的正向及反向引物,但除去在工序(1)中使用的纯化水、生理盐水或缓冲液中所添加的选自由内参dna、与该dna特异性地杂交的正向及反向引物构成的组的至少一个要素。nov reagent c包含逆转录酶及dna聚合酶。在一步法rt-pcr反应中,通过预先混合逆转录酶与dna聚合酶,能够在同一容器内进行逆转录反应(单链cdna合成)与pcr。
[0082]
所述一步法rt-pcr反应液中包含的逆转录酶是以病毒rna为模板来生成单链的互补dna(cdna)的酶,只要是催化逆转录反应的酶,就没有特别限定,可以使用源自鸟类成髓细胞性白血病病毒(avian myeloblastosis virus,amv)、莫洛尼鼠白血病病毒(moloney murine leukemia virus,m-mlv)及人类免疫缺陷病毒(human immunodeficiency virus,hiv)等rna病毒的rna依赖性dna聚合酶以及它们的突变体。
[0083]
所述一步法rt-pcr反应液中包含的dna聚合酶是源自嗜热性细菌的耐热性dna聚合酶,可以使用taq、tth、kod、pfu及它们的突变体,但不限定于这些。为了避免dna聚合酶引起的非特异性扩增,也可以使用热启动dna聚合酶。热启动dna聚合酶是对例如结合有抗dna聚合酶抗体的dna聚合酶或酶活性部位进行热敏感性化学修饰而得到的dna聚合酶,且是在pcr中经过最初的改性步骤(90℃以上)后,dna聚合酶被活化的酶。
[0084]
在所述一步法rt-pcr反应液中,包含用于在适当的条件下完成逆转录反应及pcr的所有成分。作为该成分,至少包含所述逆转录酶、逆转录反应引物、所述耐热性dna聚合酶、pcr引物、dntp混合物(由脱氧核糖核苷酸5
’-
三磷酸(deoxyribonucleotide 5
’-
triphosphate);datp、dgtp、dctp及dttp构成的混合物)及缓冲液。也可以在所述反应液中
添加rna分解酶抑制剂。作为逆转录反应引物,可以使用在靶rna的序列中特异的引物、oligo(dt)引物或随机引物。作为pcr引物,可使用通过逆转录反应生成的在cdna的序列中特异的引物对(正向及反向)。pcr引物可以与在靶rna的序列中特异的所述逆转录反应引物相同。此外,在所述一步法rt-pcr反应液中,也可以根据扩增的dna区域即靶序列的数目添加2种以上的pcr引物。在检查对象为诺如病毒的情况下,作为包含所述成分的组合物,可以将市售的诺如病毒检测试剂盒(探针法)(岛津制作所、产品编号241-09325系列、241-09325-91或241-09325-92)中包含的nov reagent a、b及c按照试剂盒使用说明书混合而得到的混合物作为一步法rt-pcr反应液使用。另外,如上所述,除去在工序(1)中使用的纯化水、生理盐水或缓冲液中所添加的内参dna、和与该dna特异性地杂交的正向及反向引物的要素。
[0085]
在检测病毒rna时,例如可以通过使用专利文献1及2、非专利文献3以及日本特开2018-78806中记载的pcr引物,检测诺如病毒基因型中的基因组i(gi)以及基因组ii(gii),但并不限定于这些。非专利文献3中记载的pcr引物包含在所述诺如病毒检测试剂盒(探针法)中。
[0086]
在本发明的一实施方式中,在所述工序(3)中的被检体处理液包含sds作为表面活性剂的情况下,若对蛋白质的改性效果强的sds以高浓度被带入所述工序(4)中,则有可能会阻碍所述一步法rt-pcr反应液中包含的逆转录酶及dna聚合酶的酶活性,而使rt-pcr不推进。同样地,在本发明的一实施方式中,在工序(3)中的被检体处理液包含氢氧化物的情况下,若被带入所述工序(4)中的氢氧化物浓度较高,则会导致高ph引起的所述酶活性的降低。因此,在所述工序(4)中,在工序(3)中得到的混合液与所述一步法rt-pcr反应液的混合比优选作为体积比为1∶2~6,更优选为1∶4。
[0087]
rt-pcr中的逆转录反应的反应温度条件以及pcr条件(温度、时间及循环数)的设定只要是本领域技术人员就能够容易地进行。
[0088]
在本发明的一实施方式中,利用实时测量来监视通过所述工序(5)中的rt-pcr反应而生成的rt-pcr产物。在进行该实时测量时,rt-pcr及检测该rt-pcr产物的工序在同一容器内进行。
[0089]
pcr产物的实时测量也被称为实时pcr。在实时pcr中,通常利用荧光检测pcr扩增产物。在荧光检测方法中,有使用嵌入性荧光色素的方法及使用荧光标记探针的方法。作为嵌入性荧光色素,可使用sybr(注册商标)green i,但并不限定于此。嵌入性荧光色素与通过pcr合成的双链dna结合,通过激发光的照射发出荧光。通过测量该荧光强度,能够测量pcr扩增产物的生成量。此外,也可以进行温度解离曲线解析,测量峰检测温度(核酸的tm值)。
[0090]
作为荧光标记探针,可以例举taqman探针、分子信标(molecular beacon)、环状探针(cycling probe)等,但并不限定于这些。taqman探针是5
’
末端用荧光色素修饰且3
’
末端用淬灭剂物质修饰的寡核苷酸。taqman探针在pcr的退火步骤中与模板dna特异性地杂交,但由于在探针上存在淬灭剂,因此即便照射激发光也可抑制荧光的产生。在此后的延伸反应步骤中,若由于taq dna聚合酶所具有的5
’→3’
核酸外切酶活性而使与模板dna杂交的taqman探针被分解,则荧光色素从探针游离,淬灭剂对荧光产生的抑制被解除而发出荧光。通过测量该荧光强度,能够测量扩增产物的生成量。作为所述荧光色素,可以例举fam、rox、
cy5,但并不限定于这些。作为所述淬灭剂,可以例举tamra(注册商标)及mgb,但并不限定于这些。为了区别并检测2种以上的dna靶序列,使用结合有各自不同的荧光色素的2种以上的寡核苷酸探针(例如taqman探针)进行pcr。
[0091]
在pcr产物的实时测量中,用与所使用的荧光色素相对应的荧光过滤器监视pcr产物的扩增曲线。在荧光强度根据pcr循环数增加的情况下,判定为被检体中的分析对象的基因的存在为阳性,另一方面,在pcr中荧光强度不增加的情况下判定为阴性。在温度解离曲线解析中,在观察到规定的温度峰的情况下,判定为分析对象的基因的存在为阳性,在未观察到规定的温度峰的情况下,判定为分析对象的基因的存在为阴性。
[0092]
在本发明的一实施方式中,提供基于rt-pcr法的rna病毒检测用试剂盒。该试剂盒中包含的为了悬浮被检体而使用的纯化水、生理盐水或缓冲液,包含选自内参dna、和与该dna特异性地杂交的正向及反向引物构成的组的至少一个要素。另一方面,在所述试剂盒中包含的一步法rt-pcr反应液中,不包含所述纯化水、生理盐水或缓冲液中所包含的选自由内参dna、与该dna特异性地杂交的正向及反向引物构成的组的至少一个要素。因此,如果未将包含被检体的被检体处理液与一步法rt-pcr反应液混合,则不会观察到内参dna的扩增,与此同时,也不会观察到源自被检体的核酸的扩增。由于得到了这样的结果的检查被判定为是rt-pcr反应未推进的检查或由于人为错误而在rt-pcr反应中没有供给被检体的检查,因此表示需要对被检体进行再检查。
[0093]
实施例
[0094]
接下来,例举实施例对本发明进行详细说明,但本发明的范围不受这些实施例限定。
[0095]
实施例1
[0096]
(1)被检体
[0097]
采集100mg作为被检体的诺如病毒感染患者的粪便,使其悬浮于1ml的蒸馏水中,制成约10%(w/v)的粪便乳剂。在使用的蒸馏水中,预先添加诺如病毒检测试剂盒(探针法)(岛津制作所、产品编号241-09325系列)的nov reagent b中包含的内参dna、和与该dna特异性地杂交的正向及反向引物。将得到的粪便乳剂用微量离心分离机以10000rpm离心分离5分钟,得到离心上清液。
[0098]
(2)被检体处理
[0099]
将下述成分添加到蒸馏水中,制备被检体处理液。
[0100]
50mm氢氧化钠(naoh)、
[0101]
0.1%(w/v)十二烷基硫酸钠(sds)、及
[0102]
625μm dntp(datp、dgtp、dctp及dttp)
[0103]
被检体处理是通过取4μl上述被检体处理液放入无盖pcr反应管中,接着向其中加入1μl在(1)中得到的粪便乳剂的离心上清液后,在室温下放置3分钟来进行的。
[0104]
(3)一步法rt-pcr反应
[0105]
将20μl的rt-pcr反应液添加至在(2)中得到的、包含5μl粪便乳剂的离心上清液与被检体处理液的混合液的pcr反应管,搅拌混合后,利用小型离心分离器旋转,所述rt-pcr反应液是以成为该反应液组成的方式制备的一步法rt-pcr反应液,且不包含内参dna、与该dna特异性地杂交的正向及反向引物。然后,使用实时pcr装置(gvp-9600、岛津制作所),立
即监视rt-pcr反应。反应在45℃/5分钟的逆转录反应后,进行95℃/3分钟的初期改性,接着进行45次循环的95℃/1秒钟-56℃/10秒钟的pcr,测量扩增曲线。pcr中的测光在56℃/10秒钟的步骤中进行。
[0106]
(反应液组成)
[0107]
40mm tris
[0108]
0.025单元/μl taq聚合酶
[0109]
1单元/μl逆转录酶
[0110]
3.75mm氯化镁
[0111]
400nm pcr引物组(cog1f/cog1r及cog2f/cog2r)(参照非专利文献3、表11)
[0112]
200nm荧光标记探针(taqman探针:g1a、g1b及g2)
[0113]
(4)结果
[0114]
将测量结果示出在图1。由于检测到归属于内参dna的扩增曲线,因此表示进行了pcr反应。在此基础上,由于检测到归属于诺如病毒基因的扩增曲线,因此判定供检查的被检体为诺如病毒阳性。
[0115]
实施例2
[0116]
除了使用没有感染诺如病毒的健康人的粪便以外,与实施例1同样地进行了检查。将测量结果示出在图2。由图2可知,由于检测到归属于内参dna的扩增曲线,因此表示pcr反应推进。另一方面,由于没有检测到归属于诺如病毒基因的扩增曲线,因此判定供检查的被检体为诺如病毒阴性。
[0117]
实施例3
[0118]
对未将实施例1中制备的粪便乳剂的离心上清液用于rt-pcr反应的情况进行了研究。与实施例1同样地制备不包含内参dna、和与该dna特异性地杂交的正向及反向引物的一步法rt-pcr反应液。向仅包含实施例1中记载的被检体处理液的pcr反应管中,仅添加一步法rt-pcr反应液,与实施例1同样地进行反应。
[0119]
将测量结果示出在图3。根据未检测到归属于诺如病毒基因的扩增曲线的结果,判定为诺如病毒阴性。但是,由于也没有检测到归属于内参dna的扩增曲线,因此表示没有对rt-pcr反应添加所述粪便乳剂的离心上清液。即,表示被检体未被提供于检查。因此,所述的诺如病毒阴性的判定是假阴性,表示需要对被检体再检查。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



