一种羊膜干细胞的提取方法与流程
 2021-02-02 04:02:31|
2021-02-02 04:02:31| 188|
188| 起点商标网
起点商标网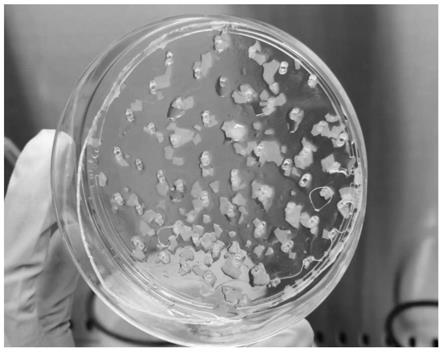
[0001]
本发明属于干细胞提取培养技术领域,尤其涉及一种羊膜干细胞的提取方法。
背景技术:
[0002]
羊膜干细胞是从新生胎儿羊膜上分离得到的干细胞,它包括羊膜上皮干细胞和羊膜间充质干细胞。另外,从羊水中也可以分离到大量的干细胞,由于羊水不好收集,且容易污染,因此,羊水来源干细胞的应用也受到限制。
[0003]
羊膜干细胞的优越性
[0004]
(1)羊膜干细胞(包括羊膜上皮干细胞和羊膜间充质干细胞)来源丰富、分离过程简单,且具有很强的多分化潜能、无伦理障碍、增殖能力强、体内体外无致瘤作用、低免疫原性及可透过血脑屏障等特征。
[0005]
(2)前人的研究结果表明,人羊膜干细胞在体外可分化为心肌细胞、胰岛β细胞、肝脏细胞、骨细胞、软骨细胞、脂肪细胞及神经元等来自三个不同胚层的细胞,而这些细胞免疫原性极低,表明进行组织细胞移植时不容易发生排斥反应。
[0006]
(3)羊膜干细胞可分泌大量的细胞因子,通过旁分泌作用达到抑制炎症、参与免疫调节的功效。
[0007]
(4)此外,羊膜干细胞的分化潜能基本上可以与胚胎干细胞相媲美,但其无伦理障碍,无致瘤作用及低免疫原性又优于其他干细胞。
[0008]
因此,鉴于羊膜干细胞及其干细胞因子在治疗诸多临床疾病如糖尿病、急性肝损伤、肺损伤、脑中风、阿尔茨海默症、纤维化类疾病、视网膜黄斑病变、卵巢早衰症及肿瘤等疾病方面具有显著的疗效,因此它被誉为“万能细胞”。
[0009]
目前羊膜干细胞传统提取方法有两种,一种是酶消化法,另一种是利用组织块爬出法,组织块爬出法一般将羊膜组织块剪碎,利用爬出法接到培养皿底中,由于组织块与培养皿粘贴太紧,去除组织时,去除不干净,会将组织块与细胞混合在一起,还需多一道细胞筛过滤工序,收集细胞;另外由于羊膜表皮是片状的,比较薄、黏,会粘到一起,接入到培养皿时无法将其铺开,或者将其铺开时所花费时间久,组织块非常容易发生重叠,重叠后影响细胞爬出。
[0010]
因此,需要一种新的羊膜干细胞提取方法,避免组织块相互重叠或组织块与爬出细胞混合,不容易收集细胞。
技术实现要素:
[0011]
本发明提供了一种羊膜干细胞的提取方法,利用悬浮法提取羊膜干细胞,将一个底部开孔的第一培养皿放入第二培养皿中,将剪碎的羊膜组织块放入第一培养皿中,利用羊膜自身特性,密度低,质量轻,加入缓冲液后,羊膜组织块飘起,处于展开状态,避免羊膜组织块相互重叠,将第一培养皿提起后,羊膜组织块以展开状态与皿底接触,然后将第一培养皿放在另一个第二培养皿中,培养组织块,使干细胞爬出,取出第一培养皿,羊膜组织块
留在第一培养皿中,干细胞留在培养液中,然后从培养液中提取干细胞。
[0012]
为实现上述目的,本发明的技术方案为:
[0013]
1、一种羊膜干细胞的提取方法,包括以下步骤:
[0014]
a1:将羊膜表皮从健康胎盘上机械分离后进行洗涤以除去血液和残片;
[0015]
a2:将第一培养皿放置在第二培养皿中,第一培养皿的底面开设若干孔;
[0016]
a3:将清洗后的羊膜剪碎后,放入第一培养皿中,加入缓冲液,然后取出第一培养皿,剪碎后的羊膜组织块平铺于第一培养皿底;
[0017]
a4:将带有羊膜组织块的第一培养皿重新放入另一个第二培养皿中,加入培养液培养,静置15-18天后,除去培养液,加入胰酶消化后,再加入培养液终止消化,取出第一培养皿,干细胞和培养液留在第二培养皿中,然后从培养液中提取干细胞;
[0018]
其中,步骤a1和a2无先后顺序。
[0019]
优选地,所述第一培养皿底部开设的孔的直径为1-5mm。
[0020]
具体地,所述步骤a4具体包括以下步骤:
[0021]
a401:将带有羊膜组织块的第一培养皿重新放入另一个第二培养皿中,在生物安全柜中采用无菌风干燥,此时羊膜组织块紧贴于第一培养皿底,然后加入20%血清培养液,放入二氧化碳浓度为5%的培养箱中静置培养;
[0022]
a402:静置9-12天后,更换20%血清培养液;
[0023]
a403:静置15-18天后,去除20%血清培养液,采用缓冲液洗涤第一培养皿和第二培养皿,以去除细胞代谢物,组织块代谢物及血清;
[0024]
a404:加入胰酶消化1-2min,然后加入10%血清培养液终止消化,取出第一培养皿,以使干细胞混合在10%血清培养液中;
[0025]
a405:提取干细胞。
[0026]
具体地,所述步骤a405具体为:采用移液管将第二培养皿中的液体加入离心管中,离心,干细胞全部沉在离心管底部,取出上清液,然后加入冻存液,放入液氮中冻存。
[0027]
优选地,所述冻存液为体积比为7:2:1的10%血清培养液、血清和二甲基亚砜的混合液。
[0028]
具体地,所述步骤a1具体为:将健康羊膜从胎盘上机械分离后,采用磷酸缓冲液清洗,去除杂菌,然后去除羊膜表面残留的血液以及自体所分泌的黏液。
[0029]
具体地,所述步骤a3具体为:将清洗后的羊膜剪碎为3cm
3-5cm3的羊膜组织块,将羊膜组织块放入第一培养皿中,加入磷酸缓冲液,羊膜组织块处于展开状态,然后取出第一培养皿,此时羊膜组织块平铺于第一培养皿中。
[0030]
优选地,所述第一培养皿为90mm培养皿,第二培养皿为100mm培养皿。
[0031]
优选地,所述第一培养皿和第二培养皿为聚乙烯材质或玻璃材质。
[0032]
本发明由于采用以上技术方案,使其与现有技术相比具有以下的优点和积极效果:
[0033]
本发明包括有两个大小不同的培养皿,其中第二培养皿为常规培养皿,第一培养皿为底部设孔的特殊培养皿,两者嵌合使用;利用悬浮法提取羊膜干细胞,将剪碎的羊膜组织块放入第一培养皿中,利用羊膜自身特性,密度低,质量轻,加入缓冲液后,羊膜组织块飘起,处于展开状态,避免羊膜组织块相互重叠,将第一培养皿提起后,羊膜组织块以展开状
态与皿底充分接触,然后将第一培养皿放在另一个第二培养皿中,加入培养液,静置培养组织块,使干细胞爬出,15-18天后去除培养液,加入胰酶消化,使细胞从培养皿上脱离,然后加入培养液,取出第一培养皿,羊膜组织块留在第一培养皿中,干细胞留在培养液中,然后从培养液中提取干细胞,此时第一培养皿起到过滤的作用,避免在收集细胞时多一道细胞筛过滤步骤。
[0034]
传统羊膜干细胞提取方法羊膜组织块接培养皿时,在生物安全柜中受无菌风的影响,致使组织块干燥程度不同,先接的组织块要干于后接的组织块,这样容易造成干细胞爬出不一致的现象;而本发明中将两个大小不同的培养皿嵌合使用,第一培养皿取出后,组织块平铺于第一培养皿底部,因此在干燥时,每一个组织块干燥程度均匀,有利于后续的干细胞爬出。
附图说明
[0035]
图1为本发明实施例1中羊膜组织块平铺在第一培养皿中时的照片;
[0036]
图2为本发明实施例1中羊膜组织块在第6-8天后干细胞爬出情况的光学显微镜图片
[0037]
图3为本发明实施例1中羊膜组织块在第9-14天后干细胞爬出情况的光学显微镜图片;
[0038]
图4为本发明实施例1中羊膜组织块在第15-20天后干细胞爬出情况的电子显微镜图片;
[0039]
图5为本发明对比例1中羊膜组织块在第9-12天后干细胞爬出情况的电子显微镜图片;
[0040]
图6为本发明对比例1中羊膜组织块在第13-15天后干细胞爬出情况的电子显微镜图片;
[0041]
图7为本发明对比例1中羊膜组织块在第16-20天后干细胞爬出情况的电子显微镜图片;
[0042]
图8为本发明实施例1和对比例1中提取的羊膜干细胞的生长曲线对比。
具体实施方式
[0043]
以下结合附图和具体实施例对本发明提出的一种羊膜干细胞的提取方法作进一步详细说明。根据下面说明和权利要求书,本发明的优点和特征将更清楚。
[0044]
实施例1
[0045]
一种羊膜干细胞的提取方法,包括以下步骤:
[0046]
1、实验前准备,实验用具消毒:生物安全柜照紫外,无菌器械、止镊、剪刀、磷酸缓冲液(pbs)、20%血清培养液、10%血清培养液、90mm培养皿和100mm培养皿,在90mm培养皿的底部开设有若干孔,孔的大小直径为1-5mm即可,将90mm培养皿放入到100mm培养皿中。
[0047]
2、将羊膜表皮从健康胎盘上机械分离,采用磷酸缓冲液清洗分离后的羊膜,去除杂菌,然后去除羊膜表面残留的血液以及自体所分泌的黏液。
[0048]
3、将清洗后的羊膜剪碎为3cm
3-5cm3的羊膜组织块,用移液管吸取1ml羊膜组织块放入90mm培养皿中,加入20ml磷酸缓冲液,羊膜组织块处于展开状态,且漂浮,采用胶头滴
管搅动,羊膜组织块均匀分布,然后取出第一培养皿,此时羊膜组织块平铺于90mm培养皿中,如图1所示,从图1中可以看出组织块处于完全展开状态,与皿完全接触。
[0049]
4、然后用胶头滴管轻微波动羊膜组织块使其均匀,且组织块间距控制在2
±
0.5cm,间距不可过大或者过小,过小影响爬出后的细胞增殖空间,将羊膜组织块铺好的90mm培养皿放入另一个新的100mm培养皿中,在生物安全柜中采用无菌风吹干,此时观察羊膜组织块是否紧贴于培养皿底部,无大量缓冲液后,盖上培养皿盖。
[0050]
5、加入10ml的20%血清培养液,放在二氧化碳培养箱中培养,隔天观察有无杂菌,若有出现浑浊,需拿出,以免感染其他玻璃皿或污染培养箱,静置放置在二氧化碳培养箱中培养。
[0051]
6、第6-8天,观察干细胞爬出情况,在光学显微镜下观察,如图2所示,少量干细胞爬出。
[0052]
7、第9-12天,观察干细胞爬出情况,在光学显微镜下观察,如图3所示,已有干细胞爬出,更换培养液,去除黏液、组织块代谢物,使干细胞进一步生长增殖。
[0053]
8、第15-20天,将培养皿从二氧化碳培养箱中取出,用移液管吸掉培养液,采用磷酸缓冲液洗涤多次,去除干细胞代谢物、羊膜干细胞代谢物及血清,采用光学显微镜观察细胞生长情况,如图4所示,大量的干细胞已爬出,加入3ml胰酶消化1分钟,然后用1ml无菌枪吹打,使细胞成散状,同时让羊膜组织块与皿分离开,然后加入10ml的10%血清培养液终止消化,使羊膜组织块悬浮与干细胞分离,此时干细胞已混合在培养液中,然后取出90mm培养皿,羊膜组织块留在90mm培养皿中,干细胞和培养液留在100mm培养皿中,此时90mm培养皿作用是细胞筛网,避免了收集细胞过程中需要添加过滤的步骤。
[0054]
8、采用移液管吸取100mm培养皿的液体,加入50ml离心管中,先采用countdtar细胞计数仪计算细胞数量,然后再将离心管内的溶液离心3分钟,转速为1500r/min,干细胞沉在离心管的底部,倒掉上清液,加入冻存液,放入液氮中冻存,其中冻存液为按照体积比10%血清培养液:血清:二甲基亚砜=7:2:1的比例配置。
[0055]
对比例1
[0056]
1、将健康羊膜从胎盘上机械分离,采用磷酸缓冲液清洗分离后的羊膜,去除杂菌,然后去除羊膜表面残留的血液以及自体所分泌的黏液。
[0057]
2、将清洗后的羊膜剪碎为3cm3-5cm3的羊膜组织块,用移液管吸取1ml羊膜组织块放入培养皿中,用胶头滴管轻微波动羊膜组织块,在生物安全柜中采用无菌风吹干。
[0058]
3、加入10ml的20%血清培养液,放在二氧化碳培养箱中培养,隔天观察有无杂菌,若有出现浑浊,需拿出,以免感染其他玻璃皿或污染培养箱,静置放置在二氧化碳培养箱中培养。
[0059]
4、第9-12天,观察干细胞大量爬出,在光学显微镜下观察,如图5所示,已有干细胞爬出,更换培养液,去除黏液、组织块代谢物,使干细胞进一步生长增殖。
[0060]
5、第12-15天,观察干细胞爬出情况,如图6所示。
[0061]
5、第16-20天,将培养皿从二氧化碳培养箱中取出,用移液管吸掉培养液,采用磷酸缓冲液洗涤多次,去除干细胞代谢物、羊膜干细胞代谢物及血清,观察此时的干细胞爬出情况,如图7所示,然后加入3ml胰酶消化1分钟,然后用1ml无菌枪吹打,使细胞成散状,同时让羊膜组织块与皿分离开,然后加入10ml的10%血清培养液终止消化,使羊膜组织块悬浮
与干细胞分离,此时干细胞已混合在培养液中,然后采用细胞筛网分离干细胞和羊膜组织块。
[0062]
6、采用移液管吸取100mm培养中的液体,加入50ml离心管中,先采用countdtar细胞计数仪计算细胞数量,然后再将离心管内的溶液离心3分钟,转速为1500r/min,干细胞沉在离心管的底部,倒掉上清液,加入冻存液,放入液氮中冻存,其中冻存液为按照体积比10%血清培养液:血清:二甲基亚砜=7:2:1的比例配置。
[0063]
实施例1和对比例1干细胞从羊膜组织块中爬出情况的对比,表示在表1:
[0064][0065]
从表1的结果得到,本发明提供的方法有利于干细胞爬出,且爬出数量多于传统的方法;同时在干细胞爬出后期的细胞形态小,最终提取的细胞形态优于对比中的传统方法。
[0066]
图8为实施例1和对比例1中获得的细胞的生长曲线图对比,可以看出应用本发明的方法可以在同一时间内可以获得更多数目的细胞。
[0067]
综上所述,本发明采用两个大小不同的培养皿,其中第二培养皿为常规培养皿,第一培养皿为底部设孔的特殊培养皿,两者嵌合使用,以完成羊膜(表皮)的接种。利用羊膜自身特性,密度底,质量轻,加入缓冲液后,羊膜组织块飘起,处于展开状态,从第二培养皿中取出第一培养皿后,羊膜组织块铺展在第一培养皿皿底上,避免了羊膜组织块相互重叠,不利于后续的细胞爬出;并且在后续收集细胞过程中,第一培养皿可充当细胞筛网的作用。因此本发明能有效的解决现有工艺中高成本低效率问题、以及人工接种方式带来的操作复杂性,能快速的实现提取操作,降低成本,提升工作效率。
[0068]
同时,本发明提供的方法提取的干细胞相对于传统的方法具有优异的细胞形态,且提高了细胞爬出数量。
[0069]
上面结合附图对本发明的实施方式作了详细说明,但是本发明并不限于上述实施方式。即使对本发明做出各种变化,倘若这些变化属于本发明权利要求及其等同技术的范围之内,则仍落入在本发明的保护范围之中。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


