一株铜绿假单胞菌8-7及其应用的制作方法
 2021-02-02 04:02:25|
2021-02-02 04:02:25| 374|
374| 起点商标网
起点商标网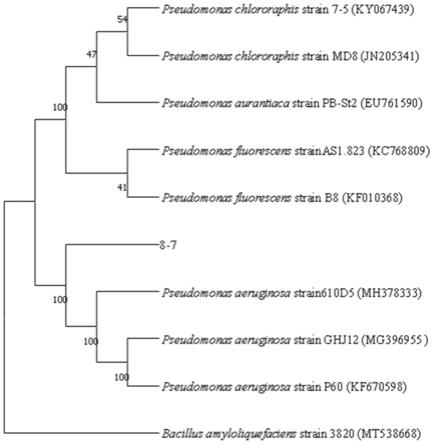
[0001]
本发明涉及微生物技术领域,更具体的说是涉及一株铜绿假单胞菌8-7及其应用。
背景技术:
[0002]
橡胶树棒孢霉落叶病病原菌为多主棒孢菌(corynespora cassiicola(berk and curt.)wei),属半知菌类(deuteromycotina),丝孢纲(hyphomycetes),丝孢目(hyphomycetales),暗色菌科(dematiaceae),棒孢属(corynespora cassiicola),是一种寄主范围广泛、世界性分布的植物病原真菌,也是棒孢属内发现最早、寄主范围最广的种。能侵染热带及亚热带地区葫芦科、无患子科、大戟科、番木瓜科、锦葵科、菊科、茄科、旋花科、苋科、豆科、天南星科、木樨科和楝科等多种植物,380个属内的530种植物。
[0003]
小孢拟盘多毛孢(pestalotiopsis microspora)是半知菌类的一个无性型内生真菌属,是著名的植物病原体品种,如引起闽楠叶枯病、橄榄果实腐烂、短穗鱼尾葵灰斑病、油棕苗叶枯病、油茶叶枯病、麻疯树叶枯病等。在云南澳洲坚果种植基地,常发现有小孢拟盘多毛孢引起的澳洲坚果叶枯、落叶等病害,造成树势逐渐衰退,果园减产。
[0004]
目前对棒孢霉落叶病和拟盘多毛孢叶枯病的防治主要采用化学农药,如咪鲜胺乳油、百菌清可湿性粉剂、苯来特、百菌清、代森锰锌、甲基托布津等。化学农药频繁使用导致病原菌抗药性产生,进而防治效果减弱,长期使用造成土壤和水资源污染严重,影响人类健康;研究高效、环保、安全的生物防治方法势在必行。
[0005]
假单胞菌(pseudomonas spp.)是活跃在植物根际和叶面的一类微生物,其产生的代谢产物(尤其是抗生素)在作物病害防治中发挥了重大作用,抗生素具有高效、低毒、易降解、无残留、对环境友好等特点。在众多的假单胞属细菌中分离得到最多且研究比较深入的有绿针假单胞菌(p.chlororaphis)、荧光假单胞菌(p.fluorescens)以及铜绿假单胞菌(p.aeruginosa)。假单胞菌能防治番茄枯萎病、烟草疫霉病、辣椒疫霉病、油菜菌核病、柏树溃疡病和豆类炭疽病等。然而,关于铜绿假单胞菌活菌制剂及其产生抗生素对多主棒孢叶斑病和拟盘多毛孢叶枯病的防治,国际上未见相关报道。
[0006]
因此,提供一株铜绿假单胞菌8-7及其应用是本领域技术人员亟需解决的问题。
技术实现要素:
[0007]
有鉴于此,本发明提供了一株铜绿假单胞菌8-7及其应用,用于抑制半知菌类病原菌:多主棒孢菌、小孢拟盘多毛孢,用于防治棒孢霉落叶病、拟盘多毛孢叶枯病。
[0008]
为了实现上述目的,本发明采用如下技术方案:
[0009]
一株铜绿假单胞菌(pseudomonas aeruginosa)8-7,其保藏编号为:cgmcc no.20694,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,简称cgmcc,地址北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏日期为2020年09月21日,分类命名为铜绿假单胞菌pseudomonas aeruginosa。
[0010]
进一步,铜绿假单胞菌8-7在抑制半知菌类病原菌中的应用。
[0011]
进一步,所述半知菌类病原菌为多主棒孢菌、小孢拟盘多毛孢。
[0012]
进一步,铜绿假单胞菌8-7在防治棒孢霉落叶病中的应用。
[0013]
进一步,铜绿假单胞菌8-7在防治拟盘多毛孢叶枯病中的应用。
[0014]
进一步,铜绿假单胞菌8-7产生的挥发性物质在抑制半知菌类病原菌中的应用。
[0015]
进一步,铜绿假单胞菌8-7产生的挥发性物质在抑制棒孢霉落叶病菌中的应用。
[0016]
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一株铜绿假单胞菌8-7及其应用,铜绿假单胞菌8-7对corynespora cassiicola和pestalotiopsis microspora具有良好的抑制作用,抑菌圈直径分别为57.68
±
0.66、66.25
±
2.03mm,抑菌率分别为79.33%、79.67%;抗菌谱试验结果表明菌株8-7具有广谱抗菌活性,尤其对半知菌类病原菌的抑制作用显著,推测8-7在半知菌类病原菌生防领域具有良好的应用前景。铜绿假单胞菌8-7产生的挥发性物质能够抑制半知菌类病原菌。
附图说明
[0017]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
[0018]
图1附图为本发明菌株8-7在lb培养基中的菌落形态;
[0019]
图2附图为本发明菌株8-7对棒孢霉落叶病菌的拮抗作用;
[0020]
其中,a,对照;b,菌株8-7的拮抗作用;
[0021]
图3附图为本发明构建的系统发育树;
[0022]
图4附图为本发明菌株8-7对pestalotiopsis microspora(小孢拟盘多毛孢)的拮抗作用;其中,a,菌株8-7的拮抗作用;ck,对照。
具体实施方式
[0023]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0024]
尖孢炭疽病菌dfmp1e(colletotrichum acutatum)、尖孢炭疽病菌mlzzp3(colletotrichum acutatum)、胶孢炭疽病菌(colletotrichum gloeosporioides)、棒孢霉落叶病菌(corynespora cassiicola)、橡胶树褐根病菌(phellinus noxius)、小孢拟盘多毛孢(pestalotiopsis microspora)、橡胶疫霉(phytophthora heveae)、五隔大无性孢丽赤壳菌(calonectriapentaseptata)、茄类镰刀菌(fusarium solani)均由云南省热带作物科学研究所植物保护与微生物利用研究中心分离保存。bacteria genomic dna kit:北京康为世纪公司;pcr引物:北京六合华大基因科技有限公司;葡萄糖、酵母膏、胰蛋白胨等分析纯试剂,生工生物工程股份有限公司;pcr仪:applied biosystems公司;电泳仪,北京六一生物科技有限公司;恒温培养箱,上海博迅实业有限公司。
[0025]
实施例1拮抗菌的分离与筛选
[0026]
(1)样品来源
[0027]
从云南省西双版纳州景洪市橡胶树植胶区采集根际土样,利用五点采样法,去除地表土壤,取深度约为5-20cm的土壤装入无菌自封袋,带回实验室于4℃冷藏备用。
[0028]
(2)培养基
[0029]
lb液体培养基:酵母粉5g、胰蛋白胨10g、nacl 10g、水1l。
[0030]
pda培养基(potato dextrose agar):土豆200g、葡萄糖20g、水1000ml。
[0031]
高氏一号培养基:可溶性淀粉20g、kno31 g、k2hpo40.5 g、mgso4·
7h2o0.5g、nacl 0.5g、feso4·
7h2o 0.01g、水1000ml。
[0032]
金氏b:蛋白胨20g、k2hpo41.5 g、mgso41.5 g,水1000ml。
[0033]
na培养基(nutrientagar):胰蛋白胨10g、牛肉膏3g、nacl 5g、水1000ml。
[0034]
查氏琼脂培养基(czapek):硝酸钠2g,磷酸氢二钾1g,硫酸镁0.5g,氯化钾0.5g,硫酸铁0.01g,蔗糖30g,琼脂15~20g,水定容至1000ml。所有培养基ph=7.2
±
0.2,固体培养基加20g琼脂/1000ml,1
×
105pa灭菌30min备用。
[0035]
(3)拮抗菌的分离
[0036]
将采集后的土样过100目筛。称取1g过筛土样,加1000ml无菌水,25℃、180r/min振荡30min,依次稀释浓度至10-3-10-8
g/l,充分混匀。分别取1ml稀释液加入冷却至50℃的lb培养基中,轻轻摇匀,在37℃下培养12h,挑取不同类型的菌落在新的平板上划线纯化培养。
[0037]
(4)拮抗菌初筛
[0038]
用直径5mm打孔器在已活化的棒孢霉落叶病菌(corynespora cassiicola)平板打孔,取一菌块接种于新的pda平板中央,四周接种不同待测菌株,28℃恒温培养5d后,挑选有抑制病原菌生长效果的菌落划线保存,编号记录。
[0039]
(5)拮抗菌复筛
[0040]
采用平板对峙法测定拮抗菌抑菌效率。用直径为5mm打孔器在已活化的病原菌平板打孔,取病原菌菌块放置于在新pda平板中央。在菌块四周等距离处接种初筛得到具有拮抗作用的菌株,以接病原菌的培养皿作为对照,重复3次,调节培养箱温度为28℃,将平板置于培养箱内4-5d后,取出测量病原菌直径。通过测量指示菌的生长抑制率,评价拮抗菌对病原菌拮抗作用的强弱。将抑制效果最好的拮抗菌命名为8-7,与20%甘油混合后置-20℃下保存。菌株8-7在lb培养基上的菌落形态见图1,对棒孢霉落叶病菌的拮抗作用见图2。
[0041]
实施例2拮抗菌的鉴定
[0042]
(1)菌落形态特征:将拮抗菌8-7划线接种于lb、pda、高氏一号培养基、na、金氏b培养基上,在30℃的恒温箱中培养1d后观察菌落形态,在不同培养基上的菌落形态详见表1。
[0043]
表1菌株8-7的培养特征
[0044][0045]
(2)生理生化指标:参考《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》的方法,对拮抗菌的m.r试验、v-p试验、接触酶试验、淀粉水解、硝酸盐还原、明胶水解、反硝化、柠檬酸盐利用等生理生化指标进行测定。
[0046]
结果发现,本发明筛选的拮抗菌8-7能利用d-葡萄糖、柠檬酸盐、甲基红,可使硝酸盐还原、氧化酶阳性、接触酶阳性、过氧化氢酶阳性,v-p试验为阴性,不能利用淀粉,属于好氧菌,能在42℃下生长,但不能再4℃下生长,耐盐浓度最高为5%。
[0047]
(3)16sr dna基因鉴定
[0048]
8-7菌株在lb培养基30℃、180r/min振荡培养至对数生长期,10000r/min离心5min收集菌体。使用试剂盒提取菌体基因组dna,选择引物27f和1492r进行pcr扩增;
[0049]
具体引物序列如下:
[0050]
27f:5
’-
agagtttgatcctggctcag-3
’
;seq id no.1;
[0051]
1492r:5
’-
ggttaccttgttacgaccctt-3
’
;seq id no.2。
[0052]
pcr反应体系:2
×
estaq master mix 25μl,基因组dna 2μl,27f和1492r引物(10μmol/l)各1μl,加ddh2o至50μl。pcr反应条件:95℃变性5min;95℃30s,55℃30s,72℃2min,35个循环;72℃10min。pcr产物经纯化后测序。将测序结果与genbank数据库中的blastn程序进行比对,通过mega 7.0软件进行多重序列比对及系统发育分析确定该菌株的分类地位,采用neighbor-joining法构建系统发育树,bootstrap设为1000。
[0053]
利用16sr dna鉴定对菌株8-7的种属进行鉴定,测序结果见seq id no.3;
[0054]
caattgatacctccgtggtaccgtcccccttgcggttagactagctacttctggagcaacccactcccatggtgtgacgggcggtgtgtacaaggcccgggaacgtattcaccgtgacattctgattcacgattactagcgattccgacttcacgcagtcgagttgcagactgcgatccggactacgatcggttttatgggattagctccacctcgcggcttggcaaccctttgtaccgaccattgtagcacgtgtgtagccctggccgtaagggccatgatgacttgacgtcatccccaccttcctccggtttgtcaccggcagtctccttagagtgcccacccgaggtgctggtaactaaggacaagggttgcgctcgttacgggacttaacccaacatctcacgacacgagctgacgacagccatgcagcacctgtgtctgagttcccgaaggcaccaatccatctctggaaagttctcagcatgtcaaggccaggtaaggttcttcgcgttgcttcgaattaaaccacatgctccaccgcttgtgcgggcccccgtcaattcatttgagttttaaccttgcggccgtactccccaggcggtcgacttatcgcgttagctgcgccactaagatctcaaggatcccaacggctagtcgacatcgtttacggcgtggactaccagggtatctaatcctgtttgctccccacgctttcgcacctcagtgtcagtatcagtccaggtggtcgccttcgccactggtgttccttcctatatctacgcatttcaccgctacacaggaaattccaccaccctctaccgtact
ctagctcagtagttttggatgcagttcccaggttgagcccggggatttcacatccaacttgctgaaccacctacgcgcgctttacgcccagtaattccgattaacgcttgcacccttcgtattaccgcggctgctggcacgaagttagccggtgcttattctgttggtaacgtcaaaacagcaaggtattaacttactgcccttcctcccaacttaaagtgctttacaatccgaagaccttcttcacacacgcggcatggctggatcaggctttcgcccattgtccaatattccccactgctgcctcccgtaggagtctggaccgtgtctcagttccagtgtgactgatcatcctctcagaccagttacggatcgtcgccttggtaggcctttaccccaccaactagctaatccgacctaggctcatctgatagcgtgaggtccgaagatcccccactttctccctcaggacgtatgcggtattagcgcccgtttccggacgttatcccccactaccaggcagattcctaggcattactcacccgtccgccgctgaatccaggagcaagctcccttcatccgctcgactcgcatggtagcatcgcta;seq id no.3。
[0055]
根据16sr dna测序结果构建的系统发育树参见图3;所述菌株的16sr dna序列全长为1435bp,和pseudomonas aeruginosa(铜绿假单胞菌)的16sr dna序列同源性达到99%。结合本菌株8-7序列分析、形态特征、培养特征、生理化特征与《常见细菌系统鉴定手册》,判断该菌株属于铜绿假单胞菌属(p.aeruginosa),并命名为铜绿假单胞菌(p.aeruginosa)8-7。
[0056]
(4)拮抗菌株8-7抗菌谱测定
[0057]
以尖孢炭疽病菌dfmp1e(colletotrichum acutatum)、尖孢炭疽病菌mlzzp3(colletotrichum acutatum)、胶孢炭疽病菌(colletotrichum gloeosporioides)、棒孢霉落叶病菌(corynespora cassiicola)、橡胶树褐根病菌(phellinus noxius)、小孢拟盘多毛孢(pestalotiopsis microspora)、橡胶疫霉(phytophthora heveae)、五隔大无性孢丽赤壳菌(calonectriapentaseptata)、茄类镰刀菌(fusariumsolani)为病原菌,pda平板同时接种拮抗菌和病原菌,以只接种指示菌的处理为对照,重复三次,28℃恒温箱中培养5d,测量抑菌圈直径,观察抑菌情况并拍照;其中,菌株8-7对pestalotiopsis microspora(小孢拟盘多毛孢)的拮抗作用见图4。测量8-7菌株对不同病原菌的生长抑制率[抑制率(%)=(对照组菌落生长直径-处理组菌落生长直径)/(对照组菌落生长直径-接种菌块直径)
×
100%],评价拮抗菌的抗菌广谱性,结果见表2。
[0058]
表2菌株8-7对9种病原真菌的抑制作用
[0059][0060]
注:不同小写英文字母表示同列数据在p<0.05水平上差异显著。
[0061]
表2结果表明,菌株8-7对9种供试病原真菌colletotrichum acutatum dfmp1e、colletotrichum acutatum mlzzp3、colletotrichum gloeosporioides、corynespora cassiicola、phellinus noxius、pestalotiopsis microspora、phytophthora heveae、
calonectriapentaseptata、fusarium solani均有抑制作用,其中对corynespora cassiicola和pestalotiopsis microspora抑制作用最好,抑菌圈直径分别为57.68
±
0.66、66.25
±
2.03mm,其次对calonectriapentaseptata和phellinus noxius两种病原菌的抑菌能力较强,对colletotrichum acutatum的抑制作用最弱。抗菌谱试验结果表明菌株8-7具有广谱抗菌活性,尤其对半知菌类病原菌的抑制作用显著,推测菌株8-7在半知菌类病原菌生防领域具有良好的应用前景。
[0062]
实施例3菌株8-7的挥发性产物对棒孢霉落叶病菌的作用
[0063]
挑取菌株8-7单菌落接种于50ml lb液体培养基中,37℃、180r/min培养12h。取50μl已培养好发酵液,均匀涂布在lb平板上,取一块直径为5mm的棒孢霉落叶病菌菌块放置于pda培养基中央,将后者反扣于前者之上,两皿接触处用封口膜密封,以空白的lb平板作对照,每个处理3次重复。30℃黑暗培养,待对照组菌丝长至2/3培养皿时,测定对照和处理的棒孢霉落叶病菌病菌菌落直径,并计算抑制率。
[0064]
结果发现,当对照棒孢霉落叶病菌菌丝平均菌落直径达67.34mm时,实验组棒孢霉落叶病菌菌丝平均菌落直径为36.98mm,平均抑制率达48.70%,表明8-7菌株能够产生挥发性物质,且该物质对棒孢霉落叶病菌有良好的拮抗作用。
[0065]
实施例4外源营养对菌株8-7挥发性物质抑菌活性的影响
[0066]
以棒孢霉落叶病菌为指示菌,分别以6种不同培养基lb、na、高氏、金氏b、查氏和pda为营养来源,采用双皿对扣法,根据菌丝生长速率测定挥发性物质对病菌的抑制率。将菌株8-7于lb培养基中活化,挑取单菌落接种于50ml lb液体培养基中,37℃、180r/min培养12h。取50μl已培养好发酵液,分别均匀涂布到含有上述6种固体培养基的培养皿皿底(直径为9cm)。挑取病原菌菌块(直径5mm)接种于含有pda培养基的培养皿皿盖,然后将接种有真菌的皿盖与涂有细菌的皿底对扣,用封口膜密封,于30℃恒温培养。以不接细菌发酵液的培养基为对照,当对照组菌丝长至2/3培养皿时,采用十字交叉测量菌落直径,根据抑制率公式计算结果,每处理重复3次,结果见表3。以抑制率评定不同营养条件下8-7所产挥发物的作用活性强弱,筛选产抑菌挥发物质的最优培养基。
[0067]
结果发现,菌株8-7能够在lb、na、高氏、金氏b和pda上生长,不能在查氏培养基上生长;且菌株8-7在lb、na、高氏、金氏b和pda上均能产生挥发性物质,在lb培养基上展现的拮抗作用最强,抑菌率达48.69%。因此,选择lb培养基为菌株8-7产挥发性物质的最优培养基。
[0068]
表3不同培养基上菌株8-7挥发性物质对棒孢霉落叶病菌的抑制作用
[0069]
[0070]
注:不同小写英文字母表示同列数据在p<0.05水平上差异显著。
[0071]
实施例5菌株8-7挥发性物质的gc-ms鉴定
[0072]
在20ml灭菌的顶空瓶中制作lb斜面培养基,取50μl菌株8-7种子液涂布接种于斜面培养基,用带有胶垫的瓶盖迅速密封,瓶盖外层再用封口膜密封,置于30℃生化培养箱中培养48h,以不接种的斜面培养基为空白对照,每处理重复3次。利用固相微萃取方法萃取顶空瓶中的挥发物。萃取头采用50/30μm dvb/car/pdms。色谱柱:db-5ms(30m
×
250μm
×
0.25μm);色谱条件:不分流模式;升温程序:50℃保持2min,再以4℃/min的速率升至100℃,保持1min,然后再以10℃/min的速率升至200℃,保持1min,最后以25℃的速升至250℃,保持5min;气相进样口温度为250℃;载气:氦气。质谱条件:离子源温度230℃,四级杆温度150℃,电离方式ei,电子能量70ev,扫描质量范围35~600m/z。
[0073]
将所得气体成分的质谱分别与国际标准数据库比对(library ofthe national institute ofstandardsand technology,nist),匹配率>85%,鉴定出挥发性物质成分后,再将对照和处理中同时存在的化合物成分去掉,最终确定挥发性物质的组分。
[0074]
依据nist标准谱库将所测的挥发性物质进行物质匹配分析,排除lb培养基处理及菌株8-7+lb培养基处理中共有的物质,将萃取鉴定得到的挥发性物质进行分析,获得35种挥发性物质,包括胺类、醇类、烯类、酚类、酯类、吡嗪类等,详见表4。
[0075]
表4菌株8-7挥发性物质组分
[0076]
[0077][0078]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



