预防或治疗鱼类感染CyHV-2的试剂及其应用的制作方法
 2021-02-02 04:02:16|
2021-02-02 04:02:16| 367|
367| 起点商标网
起点商标网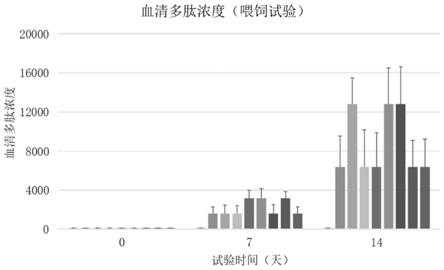
预防或治疗鱼类感染cyhv-2的试剂及其应用
技术领域
[0001]
本申请涉及鲤疱疹病毒ⅱ型感染的预防和治疗领域,特别是涉及一种预防或治疗鱼类感染cyhv-2的试剂及其应用。
背景技术:
[0002]
cyhv-2是鲤疱疹病毒ⅱ型的缩写,也称金鱼造血器官坏死病病毒(goldfish haematopoietic necrosis virus,缩写gfhnv),是金鱼造血器官坏死病(goldfish haematopoietic necrosis,缩写gfhn)、鲫鱼暴发性出血病等疾病的病原。
[0003]
cyhv-2具有较高的传染性,但是cyhv-2的感染谱较小,仅感染金鱼、鲫鱼及其普通变种,如hedrick等(2006)研究发现金鱼和鲤鱼的杂交体也能感染cyhv-2而成为该病毒的携带者。鱼卵、鱼苗、鱼种和亲鱼均可感染,但幼鱼比成鱼更易感,且引起暴发性死亡的通常是小于1龄的幼鱼,成鱼、亲鱼也有死亡的病例报道。jung和miyazaki(1995)通过腹腔注射该病毒来感染4月龄的锦鲤,感染的锦鲤没有死亡发生,也没有病理变化,表明该病毒不是锦鲤的病原。jeffrey等(2007)也报道与发病金鱼在同一养殖系统下的雅罗鱼、丁鲷不受影响。表明与金鱼种系相近的鱼类如鲤鱼、雅罗鱼、丁鲷等,即使在适宜温度长期与病鱼共养也不发病。该病主要发生在春秋季节,但主要受水温影响,15-25℃易发病。水温高于25℃时,发病率降低,goodwin等(2009)报道当水温提高至27℃时,发生死亡现象几乎立刻停止;当环境温度急剧下降至15-25℃该温度范围时,携带该病毒的金鱼种群能够产生典型的疾病和发生大量死亡,而当温度缓慢下降时,疾病的发生减缓,这可能与免疫反应的产生有关。表明温度是影响感染金鱼组织内病毒复制的关键因子。goodwin等(2009)在感染了cyhv-2的亲鱼孵化出的鱼卵和鱼苗中均发现了该病毒,从而证实了该病毒存在着垂直传播。
[0004]
cyhv-2病毒的核衣壳呈六角形或球形,直径为100-110nm,有囊膜的病毒粒子呈椭圆形,直径为175-200nm(groffet al.,1998)。cyhv-2与另外两种分离自鲤科鱼类的病毒,鲤科疱疹病毒1型和鲤科疱疹病毒3型(cyprinid herpesvirus3,cyhv-3),关系十分接近,与鮰疱疹病毒1型(ictalurid herpesvirus 1,ichv-1)关系相对较远(waltzek et al.,2005)。病毒对碘脱氧尿苷(iudr)、酸度和乙醚都比较敏感,在浓度为10-4mol/l的iudr和ph值为3时,病毒不能复制,但ph值为11时,实验组病毒培养液的滴度与控制组相近;在乙醚存在情况下,病毒失去了对fhm细胞的感染力(jung andmiyazaki,1995)。目前cyhv-2的衣壳体间三联蛋白基因、dna聚合酶基因、解螺旋酶基因、末端酶基因等的部分或完整的核苷酸序列已有报道,但关于cyhv-2的其它基因的研究未见报道,其完整的基因组序列及基因图谱还有待于进一步研究和完善。
[0005]
感染cyhv-2的金鱼的典型临床症状包括精神沉郁、昏睡、食欲不佳或厌食、呼吸频率增加,患病鱼停留在池塘或水箱底部,解剖后可见鳃苍白,脾和肾肿胀并呈苍白色,偶尔能见多处白色病灶,肝呈苍白色,肠道空无食物(jung and miyazaki,1995;groffet al.,1998;chang et al.,1999)。除此之外,philbey(2007)报道的病例鳃上出血,goodwin等
(2006)描述病鱼的鳔上有瘀斑性出血,jeffrey等(2007)观察到患病金鱼鳍上有水泡状脓疱,有些鱼还表现腹部膨大,双眼眼球突出。
[0006]
cyhv-2典型的组织病理变化有肾脏造血组织、脾、胰腺、肠道和鳃组织由多病灶发展到弥散性坏死(jung and miyazaki,1995;groffet al.,1998;chang et al.,1999),鳃小片融合,上皮细胞增生,口咽和表皮细胞变性坏死,心脏出现病灶性坏死,胸腺弥散性坏死,头肾和体肾中造血细胞出现明显的核固缩和核裂解性坏死,脾脏内的脾髓和小动脉大面积的坏死,有时还伴有出血。其他组织器官,包括肌肉组织、脑,没有发现病理性变化。感染了cyhv-2的细胞核肿胀,电镜检查发现细胞核染色质边集和核内包涵体,细胞核内有成熟的和形成中的病毒粒子,且成熟的病毒粒子散布于细胞浆中。
[0007]
目前已经有对cyhv-2的分子检测方法的研究和报道,但是,对于如何预防或治疗cyhv-2感染引起的相关疾病,尚没有行之有效的方案。
技术实现要素:
[0008]
本申请的目的是提供一种新的预防或治疗鱼类感染cyhv-2的试剂及其应用。
[0009]
本申请的一方面公开了一种预防或治疗鱼类感染cyhv-2的试剂,该试剂包括第四多肽,第四多肽为seq id no.4所示序列;
[0010]
seq id no.4:qyswyttvwgqgtsvtvstggggsggggsggggsdvvmaqspssmyasl。
[0011]
需要说明的是,本申请的关键在于,从噬菌体展示文库中筛选获得一些阳性克隆,对其进行iptg诱导表达后,最终获得了多个能够与cyhv-2特异性结合,并对cyhv-2有特异性免疫增强的多肽,即第一多肽至第八多肽。本申请的一种实现方式中,通过注射cyhv-2进行攻毒实验,结果显示,投喂第一多肽至第八多肽的鱼都有一定的存活率,而没有投喂多肽的对照组全数死亡。因此,本申请提出这些多肽可以用于预防或治疗鱼类感染cyhv-2。
[0012]
本申请的另一面公开了本申请预防或治疗鱼类感染cyhv-2的试剂在cyhv-2检测或鉴定中的应用。
[0013]
本申请的另一面公开了本申请预防或治疗鱼类感染cyhv-2的试剂在制备cyhv-2检测或鉴定的试剂盒或装置中的应用。
[0014]
需要说明的是,本申请的多肽不仅能够通过投喂、浸泡等方式特异性的增强鱼体对cyhv-2的免疫力,使其在感染cyhv-2具有更高的存活率;而且,本申请的多肽能够特异性的结合cyhv-2。在本申请的一种试验方案中,第一多肽至第八多肽都能够特异性的结合cyhv-2,而不与其它病毒,如pfrv、stiv、vnnv、vhsv和ihnv等发生交叉反应。因此,本申请的多肽同样可以用于cyhv-2特异性检测或鉴定,亦或者基于本申请的多肽制备cyhv-2特异性检测或鉴定的试剂盒或装置,例如可以利用本申请多肽的特异性,制备免疫层析试纸条等检测试剂盒或装置,在此不做具体限定。
[0015]
本申请的再一面公开了一种用于预防或治疗鱼类感染cyhv-2的疾病的饲料,该饲料中含有本申请预防或治疗鱼类感染cyhv-2的试剂。
[0016]
优选的,本申请预防或治疗鱼类感染cyhv-2的试剂在饲料中的用量为,每克饲料中含有至少0.5μg试剂。
[0017]
优选的,本申请所谓的鱼类感染cyhv-2的疾病包括金鱼造血器官坏死病和鲫鱼暴发性出血病。
[0018]
需要说明的是,本申请预防或治疗鱼类感染cyhv-2的试剂可以通过投喂进行预防,提高鱼体对cyhv-2的特异性免疫力,从而提高感染cyhv-2的鱼群的存活率;可以理解,投喂的方式最直接的就是将本申请的试剂掺杂在饲料中,因此,本申请创造性的提出了用于预防或治疗鱼类感染cyhv-2的饲料。可以理解,一方面,该饲料可以是各种适用于鲫鱼或金鱼的饲料,本申请的关键并非在于饲料,而在于本申请的多肽试剂,因此,饲料的具体配方或类型可以参考现有的鲫鱼、金鱼或其它鱼类的饲料;另一方面,目前比较普遍和严重的感染cyhv-2的疾病就是金鱼的金鱼造血器官坏死病和鲫鱼的鲫鱼暴发性出血病,可以理解,本申请的多肽试剂的关键在于能够特异性的结合cyhv-2,从而对其感染造成的疾病有预防或治疗效果,因此,不排除还有其他感染cyhv-2的疾病,同样可以采用本申请的多肽试剂进行预防或治疗,在此不做具体限定。
[0019]
此外,每克饲料中含有至少0.5μg试剂,这是本申请的一种试验方案中采用的有效剂量;可以理解,只要饲料中含有本申请的多肽试剂,其或多或少都对cyhv-2有特异性的免疫作用;因此,饲料中本申请多肽试剂的用量可以根据使用需求或产品设计要求进行调整,在此不做具体限定。
[0020]
本申请的再一面公开了一种用于预防或治疗鱼类感染cyhv-2的疾病的浸泡液,该浸泡液中含有本申请的试剂。同样的,本申请的浸泡液也特别适用于金鱼造血器官坏死病和鲫鱼暴发性出血病。
[0021]
需要说明的是,本申请预防或治疗鱼类感染cyhv-2的试剂可以通过将鱼浸泡在多肽试剂的浸泡液中的方式进行预防,提高鱼体对cyhv-2的特异性免疫力,从而提高感染cyhv-2的鱼群的存活率;因此,本申请创造性的提出了用于预防或治疗鱼类感染cyhv-2的浸泡液。可以理解,本申请的浸泡液适用于各种感染cyhv-2的鱼及感染cyhv-2造成的疾病,包括但不仅限于金鱼及其金鱼造血器官坏死病、鲫鱼及其鲫鱼暴发性出血病。
[0022]
本申请的有益效果在于:
[0023]
本申请预防或治疗鱼类感染cyhv-2的试剂,其第四多肽能够特异性的免疫结合cyhv-2,并且可以通过投喂或浸泡等方式特异性的增强鱼体对cyhv-2感染疾病的免疫抗性,从而提高感染cyhv-2的鱼群的存活率,为cyhv-2感染的预防和治疗提供了一种新的方案和途径。
附图说明
[0024]
图1是本申请实施例中病鲫组织上清的pcr检测结果;
[0025]
图2是本申请实施例中接种和未接种病毒的kf细胞的电镜观察结果图;
[0026]
图3是本申请实施例中接种病毒的kf细胞的培养物的pcr检测结果;
[0027]
图4是本申请实施例中回感病鲫的pcr检测结果;
[0028]
图5是本申请实施例中8个多肽对cyhv-2的特异性检测结果;
[0029]
图6是本申请实施例中8个多肽喂饲试验的鱼体中血清多肽浓度检测结果;
[0030]
图7是本申请实施例中8个多肽浸泡试验的鱼体中血清多肽浓度检测结果。
具体实施方式
[0031]
下面通过具体实施例对本申请作进一步详细说明。以下实施例仅对本申请进行进
一步说明,不应理解为对本申请的限制。
[0032]
实施例
[0033]
一、鲫鱼暴发性出血病攻毒模型建立
[0034]
1.病毒分离
[0035]
(1)病毒采样和实验动物
[0036]
鲤春病毒血症病毒(缩写svcv)和锦鲤疱疹病毒(缩写khv)由深圳出入境检验检疫局动植物检验检疫技术中心提供和保存。患病鲫采自盐城某异育银鲫养殖场,体长24
±
1cm左右,平均体重250
±
10g。锦鲤鳍条细胞(koi fin cell line,缩写kf)由深圳出入境检验检疫局动植物检验检疫技术中心提供。将缓慢浮游鱼池塘下风口发病濒死鱼打捞上岸可见大量血液从鳃盖下缘自然溢出,体表充血腹部肿胀,眼眶基部充血,鳃丝严重出血并发白。实验选用的健康异育银鲫由无锡淡水研究中心南泉基地提供,体长15
±
1cm,体重100
±
10g。所有的实验健康鱼均取自无gfhnv发病史的地区,养殖于本实验室水槽中,水温控制在23-25℃。
[0037]
无菌取患病鲫脑、脾、肾等组织,加入海砂,倒入研钵中充分研磨,制备成匀浆,按1:10的比例悬浮于细胞培养液中,5℃过夜孵育后,14000r/min离心15min,取上清,即病毒上清液,-80℃保存,用于病毒分离。
[0038]
(2)分离病毒鉴定
[0039]
分别用gfhnv、khv和svcv的引物进行检测。本试验具体采用了两对gfhnv引物,即gfhnv-jpf/r和gfhnv-cefas/r,以及khv、svcv引物,共计四对特异性引物,对病鱼组织的病毒上清液进行pcr扩增检测,针对gfhnv-jpf/r和gfhnv-cefas/r分别设置了gfhnv病毒阳性对照,针对khv引物设置了khv阳性对照,针对svcv引物设置了svcv阳性对照,并针对四对引物设置了四个模板为depc水的阴性对照。对pcr扩增产物进行2%琼脂糖凝胶电泳检测。具体如下:
[0040]
rna和dna抽提:本试验使用dneasy blood tissue kit(qiagen,germany)和rnamin(qiagen,germany)抽提核酸,具体步骤详见试剂盒说明书。
[0041]
svcv rt-pcr的反应体系和条件如下:
[0042]
反应体系为50μl,包括:10
×
pcrbuffer 5l,25mmol/lmgcl25μl,2.5mmol/l dntps 4μl,20mol/l引物f1和r1各2.5μl,5m/μl dna聚合酶0.5μl,5m/μl逆转录酶1μl,40m/l rna酶抑制剂1μl,总rna 5μl,加depc水至总体系50μl。每个反应体系设置两个平行,svcv pcr用引物f1和r1同oie手册。
[0043]
反应条件:50℃逆转录30min;95℃预变性2min;然后进入30个循环:95℃变性30s、50℃退火30s、72℃延伸60s;循环结束后,72℃再延伸7min;4℃保存。
[0044]
khv pcr的反应体系和条件如下:
[0045]
khv pcr的扩增引物为正向引物09-khv-tk-f和反向引物09-khv-tk-r,09-khv-tk-f为seq id no.9所示序列,09-khv-tk-r为seq id no.10所示序列。pcr扩增片段为409bp,退火温度为55℃。
[0046]
seq id no.9:5
’-
gggttacctgtacgag-3
’
[0047]
seq id no.10:5
’-
cacccagtagattatgc-3
’
[0048]
反应体系为100μl,包括:10
×
buffer 10μl、0.2mm的10
×
mg
2+
10μl、0.8mm的引物各
2.5μl、10mm的dntps 2μl、taq酶1μl,然后加水至总体积到100μl。
[0049]
反应条件为:94℃4min,然后进入32个循环:94℃1min、退火温度55℃1min、71℃1min;循环结束后72℃10min,最后4℃保温。
[0050]
gfhnv pcr的反应体系和条件如下:
[0051]
gfhnv pcr分别采用两对扩增引物进行,第一对扩增引物为seq id no.11所示序列的上游引物jf和seq id no.12所示序列的下游引物jr,pcr扩增片段为366bp的dna解旋酶基因片段;第二对扩增引物为seq id no.13所示序列的上游引物gfhnv-cefasf和seq id no.14所示序列的下游引物gfhnv-cefasr,pcr扩增片段为362bp的dna解旋酶基因片段。
[0052]
seq id no.11:5
’-
ggacttgcgaagagtttgatttctac-3
’
[0053]
seq id no.12:5
’-
ccatagtcaccatcgtctcatc-3
’
[0054]
seq id no.13:5
’-
cccagcaacatgtgcgacgg-3
’
[0055]
seq id no.14:5
’-
ccgtartgagagttggcgca-3
’
[0056]
两对扩增引物分别在不同的pcr管中进行扩增,两者的反应体系和反应条件相同。
[0057]
反应体系为100μl,包括:10
×
buffer 10μl、0.2mm的10
×
mg
2+
10μl、0.8mm的引物各2.5μl、10mm的dntps 2μl、taq酶1μl,然后加水至总体积到100μl。
[0058]
将反应管至于pcr仪中。94℃4min,然后进入32个循环:94℃1min、55℃退火温度1min、71℃1min;循环结束后72℃10min,最后4℃保温。
[0059]
gfhnv、khv和svcv的pcr扩增产物采用2%琼脂糖凝胶电泳检测,结果如图1所示。图1中,泳道1为dnamarker dl2000,泳道2-4依序为引物gfhnv-jpf/r对病鱼组织上清、gfhnv病毒阳性对照和阴性对照的pcr扩增产物的电泳结果,泳道5-7依序为gfhnv-cefasf/r病鱼组织上清、gfhnv病毒阳性对照和阴性对照的pcr扩增产物的电泳结果,泳道8-10依序为khv引物对病鱼组织上清、khv病毒阳性对照和阴性对照的pcr扩增产物的电泳结果,泳道11-13依序为svcv引物对病鱼组织上清、svcv病毒阳性对照和阴性对照的pcr扩增产物的电泳结果。
[0060]
图1的结果显示,四对引物对其阳性对照都有扩增,而对阴性对照都没有扩增,说明四对引物的pcr扩增体系正常,而对于病鱼组织上清,只有gfhnv的两个检测引物,即gfhnv-jpf/r和gfhnv-cefas/r由扩增片段,而svcv和khv都没有扩增,说明病鱼组织上清中含有gfhnv,即cyhv-2。
[0061]
将pcr扩增产物送至深圳华大基因对gfhnv-jpf/r的扩增产物进行测序。gfhnv-jpf/r扩增片段的测序结果为seq id no.15所示序列。
[0062]
seq id no.15:
[0063]5’-
ggacttgcgaagagtttgatttctacacgcctcgcatcatgcatcaggacaacgcggtcagacaactcaacgagtcttgtatgaaaaagactgtgggcgccgaacggatcttcaagcccaagatcaatcacaataacgtgcagaacccggacgagcgtagaaagtttgcagccgtggtccgtcaacggttcaagcacattgacttctttcaaggcgtccgaatcaaggtcggatctctggtgtgcgtactaaaatatcaaactcaagtgtttgaaggctgtctgggaatagtggaatcagtacaacccgtcatggtacgcctttttttgtttgtttgtttgtttgatgagacgatggtgactatgg-3
’
[0064]
测序结果显示gfhnv-jpf/r扩增获得了366的扩增片段,与预期结果相符。将测序结果与genbank中登录的gfhnv序列进行比较,结果发现测序结果与gfhnv标准株的基因序列同源性为99%。因此确定病鱼组织上清的确含有gfhnv,即病鱼所感染的病毒为gfhnv。
[0065]
2.毒株建立
[0066]
取1:10、1:100和1:1000等3个稀释度的病毒上清液,以适当体积分别接种到生长约24h的锦鲤鳍条细胞(koi fin cell line,kf)单层细胞中,本试验具体将50μl的病毒上清液接种到单层细胞中,25℃吸附1h后,加入细胞培养液,20℃过夜培养。7天内每天用40-100倍倒置显微镜检查,待出现可疑致细胞病变效应(缩写cpe)后,取培养的kf细胞反复冻融3次,作10倍系列稀释后,接种到生长约24h的kf细胞单层中进行传代,同时设正常kf细胞对照,并每日观察cpe。离心收集接种病毒上清液并刚出现cpe的kf细胞,制作超薄切片,在电镜下观察;同时,取同时期的正常的kf细胞,也制作超薄切片,进行电镜观察;结果如图2所示。
[0067]
图2中,左图为出现cpe的kf细胞的电镜扫描结果,其中,圆圈所示为kf细胞感染病毒后产生的cpe;右图为正常细胞的电镜扫描结果。
[0068]
实验结果发现,将组织上清接种单层kf细胞,盲传三代后,开始出现典型且规律的细胞病变,cpe表现为细胞体积增大变圆和少量细胞质空泡化,如图2所示,8天后病变明显,细胞脱落,而对照组的正常kf细胞生长良好。
[0069]
提取kf细胞培养物的第3代dna,用鉴定引物gfhnv-jpf/r对提取的dna进行检测,并对pcr扩增产物进行2%琼脂糖凝胶电泳。本试验dna抽提用试剂盒采用dneasy blood tissue kit(qiagen,germany),在进行dna提取之前预先对kf细胞进行冻融,离心后取上清抽提核酸。gfhnv-jpf/r扩增参考“(2)分离病毒鉴定”步骤,pcr扩增产物电泳结果如图3所示。
[0070]
图3中,泳道1为dnamarker dl2000,泳道2为gfhnv病毒阳性对照的pcr扩增产物的电泳结果,泳道3为正常kf细胞阴性对照的pcr扩增产物的电泳结果,泳道4为病毒感染的kf细胞培养物第3代dna的pcr扩增产物的电泳结果。图3的结果显示,提取kf细胞培养物的第3代dna,用鉴定引物gfhnv-jpf/r成功扩增出与预期一致的362bp目的片段。
[0071]
3.攻毒条件测试
[0072]
采集病鱼,取其鳃等组织器官,研磨、离心,取上清,以0.22μm的滤膜过滤除菌,以每尾1ml的剂量通过腹腔注射接种于实验鱼体内,对照组注射1ml dmem培养基。本试验设置了两个感染试验组,和一个对照组,每组10尾健康鲫鱼。
[0073]
每天观察,结果显示,试验组ⅰ、ⅱ的感染鲫分别在第3和第4日出现死亡,感染的死亡高峰期为第7、8日,第10日后全部死亡,体表充血腹部肿胀特征同自然发病鲫相同,解剖后发现,鳃丝发白,肝脾肾明显肿大,符合鲫鱼暴发性出血病的病征。而注射dmem培养基的对照组无明显变化。
[0074]
无菌取试验组死亡的患病鲫脑、脾、肾等组织,加入海砂,倒入研钵中充分研磨,制备成匀浆,按1:10的比例悬浮于细胞培养液中,5℃过夜孵育后,14000r/min离心15min,取上清采用引物gfhnv-jpf/r对其进行pcr扩增检测。与此同时,作为对照,取一尾对照组的鲫鱼的脑、脾、肾等组织,采用同样的方法制备获取上清液,作为阴性对照。pcr扩增产物的部分凝胶电泳结果如图4所示。
[0075]
图4中,泳道1为dnamarkerdl2000,泳道2为阴性对照的pcr扩增产物的电泳结果,泳道3为gfhnv病毒阳性对照的pcr扩增产物的电泳结果,泳道4为回感病鲫的pcr扩增产物的电泳结果。pcr扩增结果显示,感染鱼试验组ⅰ、ⅱ均扩增出362bp的片段,与预期大小相
符;这说明发病鲫中的gfhnv可以人工感染健康异育银鲫,而对照组无目的片段,与预期相符。
[0076]
二、鲫暴发性出血病毒特异性免疫增强多肽筛选
[0077]
1.噬菌体展示文库
[0078]
噬菌体展示技术(phage display techniques,pdt)是将外源蛋白质或多肽的基因表达产物与噬菌体外壳蛋白融合,并在噬菌体表面展示,同时将其遗传密码信息整合到噬菌体的基因组中。
[0079]
噬菌体抗体技术(phage display antibody library techniques)是指利用pcr技术扩增体全套可变区基因,通过噬菌体展示技术把fab或单链抗体(scfv)与编码噬菌体外壳蛋白的基因相连接,通过侵染宿主,在噬菌体表面表达成融合蛋白的过程,经过对目标分子如蛋白、糖蛋白、病毒及小分子物质等的特异性结合筛选过程,从而富集得到针对的目标分子的噬菌体展示抗体。抗体库技术直接利用抗原从抗体库中获取特异性抗体,标志着抗体制备进入了一个全新时代。
[0080]
噬菌粒展示系统中的外源蛋白展示在丝状噬菌体的表面,但构建其展示文库时所用的载体是噬菌粒,而非完整的丝状噬菌体基因组。噬菌粒(phagemid)是噬菌体(phage)和质粒(plasmid)的混合体,其拥有噬菌体和质粒的优点。噬菌粒带有m13(单链)和质粒(双链)的复制起始位点,既能像质粒一样快速复制,也能在辅助噬菌体如m13ko7的帮助下装配重组成重组噬菌体颗粒。噬菌粒含有氨卞青霉素(amp)抗性基因,而m13k07含卡那霉素(kan)抗性基因,使被感染的细胞能从未被感染的细胞中挑选出来。
[0081]
本试验的噬菌体抗体库、大肠杆菌tg1、辅助噬菌体m13ko7由中国科学院水生生物研究所戴和平研究员提供。来自文献:dai hp,gao h,zhao xy,dai lf,zhang xk,xiao n,zhao rh,hemmingsen sm.construction and characterization of a novel recombinant single-chain variable fragment antibody against white spot syndrome virus from shrimp.journal of immunological methods,2003,279(1-2):267-275。
[0082]
2.抗鲫暴发性出血病毒之特异性多肽筛选
[0083]
(1)噬菌体展示文库筛选
[0084]
以噬菌体展示文库对纯化的cyhv-2全病毒进行三轮筛选:以pbs稀释的50μg纯化的cyhv-2包被免疫管,4℃过夜;次日,倾掉免疫管中的包被液,以pbs洗涤,除去未结合的蛋白,再以10%pbsm溶液封闭免疫管,于37℃孵育1h;以pbs洗涤,将制备好的噬菌体展示文库与10%pbsm按1:1加入到免疫管中,37℃孵育2h;分别以pbst溶液洗涤,加入1ml之100mm的三乙胺,作用10min后加入0.5ml之1m tris-hcl(ph=7.5),然后加入5ml的大肠杆菌tg1,其o.d.600=0.3-0.5,37℃孵育1h;将感染的菌液涂布sobag平板,30℃倒置培养过夜;次日,用培养基刮下平板上的菌落,并拯救成噬菌体进行下一轮筛选。
[0085]
本试验的噬菌体文库扩增和拯救具体方法如下:
[0086]
1)从-70℃取一支冻存的噬菌体库,约1.5ml,37℃水浴解冻;
[0087]
2)解冻菌液加入到13ml的2
×
yt-ag培养基稀释,混匀;
[0088]
3)取1.5ml涂布于sobag大平板,共涂布10个,涂布均匀后30℃培养过夜,约16h;
[0089]
4)用2
×
yt-ag培养基将平板上的菌刮下,然后分装与冻存管,-70℃保存备用。
[0090]
抗gfhnv单链抗体噬菌体文库是以噬菌粒的形式保存在宿主菌中,在淘选前要将其拯救成噬菌体形式的文库。具体方法如下:
[0091]
5)从-70℃取一支冻存的二级噬菌体库,约1.5ml,37℃水浴解冻,然后加入到600ml的2
×
yt-ag培养基中,使od
600
为0.3-0.4;
[0092]
6)37℃,200r/min摇床培养至od
600
=0.5-0.8;
[0093]
7)按大肠杆菌:helperphage(m13k07)=1:5的比例加入helper phage,37℃摇床培养1小时后;
[0094]
8)以4000r/min,4℃离心15min,去上清,沉淀重悬于200ml的2yt-ak,37℃摇床培养2.5h;
[0095]
9)培养物以10000g,4℃离心20min,以1/5体积的peg/nacl沉淀上清中的噬菌体,冰浴1小时;
[0096]
10)以10000g,4℃离心20min,沉淀的噬菌体重悬于5ml的2yt中,备用。
[0097]
本试验对噬菌体文库进行了三轮筛选,并统计了每轮筛选的单链抗体的选择性富集,结果如表1所示。
[0098]
表1各轮淘选过程中单链抗体的选择性富集
[0099]
噬菌体数第一轮第二轮第三轮投入量(cfu)7.6
×
10
10
7.7
×
10
10
7.5
×
10
10
洗脱量(cfu)1.3
×
1044.2
×
1052.8
×
105产出率(%)1.7
×
10-7
5.5
×
10-6
3.7
×
10-6
[0100]
表1中,以cyhv-2为抗原对噬菌体抗体库进行4轮淘选,用投入与产出的比例来计算产出率,即产出率(%)=(洗脱量
÷
投入量)
×
100%;
[0101]
投入量的计算方式为,取10μl未经淘选的噬菌体库于90μl处于对数生长期的tg1菌液中,用2
×
yt制备10倍系列稀释细菌悬液,涂布bobag平板,计单菌落数。产出量的计算方式为,取10μl淘选后并已感染tg1的噬菌体加入到90μl的2
×
yt,进行10倍系列稀释,涂布bobag平板,计单菌落数。然后计算淘选效率。
[0102]
表1的结果显示,第三轮筛选的产出率明显高于第一轮,这说明较高亲和力的克隆得到有效富集,而第三轮与第二轮无数量级差别,说明三轮筛选足以保证筛选到高亲和力抗体。
[0103]
(2)阳性克隆鉴定
[0104]
从第三轮筛选的平板上随机挑取单菌落于96孔细菌培养板中,本试验具体挑取了2板,各培养板预留阳性及阴性对照孔,加入含氨苄及含辅助噬菌体培养基进行过夜培养;次日,从每孔中吸取30μl菌液于一新的细菌培养板中,加入培养基,30℃培养3h,离心去上清后,菌沉淀重悬于含氨苄及卡那霉素之培养基,30℃进行过夜培养;次日,离心后将含有抗体之上清保存于4℃备用,即抗体上清液。
[0105]
将纯化的cyhv-2以0.5μg/孔加入到elisa板中,于室温进行包被2h,倾去包被液后以pbs洗涤,4%pbsm进行过夜封闭;次日,倾去封闭液后以pbs洗涤,每孔加入100μl以4%pbsm溶液以1:1比例所稀释好的抗体上清液,于30℃孵育1h;以pbst溶液洗涤后,每孔加入100μl以4%pbsm溶液按1:5000稀释之二抗30℃孵育1h,本试验的二抗为hrp/anti-m13 monoclonal antibody;以pbst溶液洗涤后,每孔加入100μl的tmb底物溶液进行显色,最后
以2m硫酸终止反应;采用酶标仪测定激发波长450nm的值,当实验样本的值除以空白对照的值大于2.1时,视为阳性克隆。
[0106]
本试验挑取并检测了192个单克隆,elisa分析后结果显示,192个单克隆中有33个elisa值为阳性,阳性克隆率为17.2%。
[0107]
对筛选出的33个的阳性克隆进行进一步鉴定,将抗原设置7个稀释度,分别以0、50、100、200、300、400、500ng/孔包被elisa板进行鉴定。试验结果显示,33个阳性克隆中,有13个克隆对抗原包被量具有浓度依赖。
[0108]
将此13株阳性克隆扩增培养后,进行序列测定,并对测序结果进行序列分析。具体如下:
[0109]
1)取30μl阳性克隆菌液于一新的细菌培养板中,并补足2yt-ag培养基至200μl/孔,30℃培养3h;其中,2yt-ag培养基中加helperphage,100ml培养基加入100μl的m13k07。
[0110]
2)以3500rpm离心15min,去上清,菌沉淀重悬于200μl的2yt-ak中,30℃150rpm培养过夜;其中2yt-ak包括2yt、100μg/mlamp和50μg/mlkna。
[0111]
3)次日,将细菌培养板以3500rpm4℃离心15min,上清4℃保存备用。
[0112]
采用引物组对阳性克隆进行pcr扩增。本例的引物组上游引物为seq id no.16所示序列,下游引物为seq id no.17所示序列。
[0113]
seq id no.16:5
’-
ccatgattacgccaagctttggagcc-3
’
[0114]
seq id no.17:5
’-
cgatctaaagttttgtcgtctttcc-3
’
[0115]
pcr反应体系为100μl,包括10
×
buffer 10μl、10
×
mg
2+
(0.2mm)10μl、0.8mm的引物各2.5μl、10mm的dntps 2μl、taq酶1μl,然后加入含有dna的上清液,并补水至总体积100μl。
[0116]
将反应管至于pcr仪中进行pcr反应,设置反应条件为:94℃5min,然后进入35个循环:94℃1min、56℃退火1min、72℃1min,循环结束后,72℃10min,最后4℃保温。pcr扩增产物送深圳华大基因进行测序。
[0117]
测序结果表明,有3株为非单克隆,其余10株均为单克隆,10株克隆中有3株的cdr3区相同,其余7株均不相同。
[0118]
三、鲫暴发性出血病毒特异性免疫增强多肽特性分析
[0119]
1.多肽与cyhv-2结合性分析
[0120]
从筛选获得的10株单克隆中,3株cdr3区相同的单克隆任选一株进行试验,加上其余7株,总计采用8株阳性克隆进行iptg诱导表达后,通过原核表达体系,即大肠杆菌表达系统,获得鲫暴发性出血病毒特异性免疫增强多肽。八个鲫暴发性出血病毒特异性免疫增强多肽中,第一多肽为seq id no.1所示序列,第二多肽为seq id no.2所示序列,第三多肽为seq id no.3所示序列,第四多肽为seq id no.4所示序列,第五多肽为seq id no.5所示序列,第六多肽为seq id no.6所示序列,第七多肽为seq id no.7所示序列,第八多肽为seq id no.8所示序列;
[0121]
seq id no.1:vvyyyamdssgqgtsvtvstggggsggggsggggsdvvmaqspssmyasl
[0122]
seq id no.2:ggydwmavvwgqgtsvtvstggggsggggsggggsdvvmaqspssmyasl
[0123]
seq id no.3:ssllyamgywgqgtsvtvstggggsggggsggggsdvvmaqspssmyasl
[0124]
seq id no.4:qyswyttvwgqgtsvtvstggggsggggsggggsdvvmaqspssmyasl
[0125]
seq id no.5:gmftyaadswgqgtsvtvstggggsggggsggggsdvvmaqspssmyasl
[0126]
seq id no.6:qwgwsldgggqgtsvtvstggggsggggsggggsdvvmaqspssmyasl
[0127]
seq id no.7:maggltaywgqgtsvtvstggggsggggsggggsdvvmaqspssmyasl
[0128]
seq id no.8:qsqqggaywgqgtsvtvstggggsggggsggggsdvvmaqspssmyasl。
[0129]
其中,iptg诱导表达的具体方法为:将过夜培养菌液按1:20的比例接种到lb液体培养基中,37℃振荡培养。当菌液od
600nm
值达0.6时加入终浓度为1.0mmol/l的iptg,诱导6h,每隔1h收集菌液,保存备用,用于sds-page分析,观察表达量的变化。同时,将诱导后的菌液进行超声波破碎,4℃,5000r/min离心5min后将上清和沉淀进行sds-page电泳,分析表达蛋白的可溶性。
[0130]
然后对此8个多肽进行结合特性分析,并设置细胞碎片作为阴性对照和pbs空白对照。其中,细胞碎片是指大肠杆菌细胞碎片。
[0131]
本例使用斑点杂交实验进行结合特征分析,具体包括:
[0132]
可溶性单链抗体与cyhv-2的结合特性分析
[0133]
1)取3μl的pbs、细胞碎片和cyhv-2点样于nc膜上;
[0134]
2)待自然晾干后,以3%的bsa在室温封闭1h;
[0135]
3)pbs洗3次,将膜放入1:5稀释的单链抗体scfv溶液中,室温1h;其中稀释采用3%bsa进行;
[0136]
4)pbst、pbs各洗3次,然后将膜放入hrp/anti e-tag溶液中,室温反应1h;hrp/anti e-tag溶液以3%bsa按1:5000稀释;
[0137]
5)pbst、pbs各洗3次,然后以dab底物溶液显色。
[0138]
可溶性单链抗体与变性cyhv-2的结合特性分析
[0139]
1)对cyhv-2及细胞碎片进行12%的sds-page;
[0140]
2)将分离好的蛋白电转移到pvdf膜上,100ma,1.5h;
[0141]
3)以3%bsa在室温封闭1h;
[0142]
4)pbs洗3次,然后将pvdf膜放入1:5稀释的单链抗体溶液中,室温反应1h;
[0143]
5)pbst、pbs各洗3次,然后将pvdf膜放入hrp/anti e-tag溶液中,室温反应1h;hrp/anti e-tag溶液以3%bsa按1:5000稀释;
[0144]
6)pbst、pbs各洗3次,然后以dab底物溶液显色。
[0145]
斑点杂交的结果显示,8个多肽均能与cyhv-2发生反应,且阴性对照和空白对照均无斑点。
[0146]
对细胞碎片和cyhv-2进行sds-page电泳然后转至pvdf膜,分别以8个多肽为一抗,hrp/anti e-tagantibody为二抗进行westernblot检测。
[0147]
将诱导表达的糖蛋白经westernblot分析其免疫原性,具体方法如下:
[0148]
(1)取处理好的样品15μl上样,进行sds-pag电泳;
[0149]
(2)后电泳完成后,将胶带置于转印缓冲液中平衡10min;根据胶带大小剪裁两张滤纸和一张pvdf膜,得到的pvdf膜用100%甲醇处理,并分别将滤纸、处理后的pvdf膜、泡沫放入转印缓冲液中浸泡20min;
[0150]
(3)依次按照阴极-泡沫-滤纸(两层)-胶带-pvdf膜-滤纸(两层)-泡沫-阳极的顺序放入夹板槽中,加入转移电泳液,35v,3h;
[0151]
(4)转膜完成后,标记膜的正反面,pbst漂洗三遍,每次10min,加入2%封闭液,封
闭10h;
[0152]
(5)洗涤同上,加入兔抗ihnv全病毒血清作为一抗,1:20000稀释,37℃作用1h;
[0153]
(6)洗涤同上,将hrp标记的羊抗鼠igg作为二抗,1:2000稀释,37℃作用1h,最后用dab显色试剂盒进行显色,拍照分析。
[0154]
westernblot检测结果显示,只有第八多肽能识别变性的cyhv-2,表示第八多肽识别的是线性表位,而其他7个多肽识别的是构象表位。
[0155]
2.多肽特异性试验及亲和力常数
[0156]
本试验采用固相非竞争elisa分析法,对第一多肽至第八多肽,这8个多肽的结合特异性进行检测。特异性检测的供试材料包括cyhv-2、pfrv(狗鱼幼鱼弹状病毒)、stiv(甲鱼彩虹病毒)、vnnv(鱼病毒性神经坏死病病毒)、vhsv(病毒性出血败血症病毒)和ihnv(传染性造血器官坏死病病毒),这些供试材料均由深圳出入境检验检疫局动植物检验检疫技术中心提供和保存。
[0157]
固相非竞争elisa分析法具体包括,利用96孔板测定各多肽的亲和常数(kaff)=(n-1)/2(n[ab2]-[ab1]),式中[ab1]和[ab2]分别代表不同抗原浓度最大吸光度的50%时对应的抗体浓度,n为两个抗原稀释的倍数。本试验设置3个包被抗原浓度浓度梯度,及10μg/ml、5μg/ml和2.5μg/ml,封闭后以3%bsa系列稀释各多肽做为一抗,进行elisa试验,试验结果如图5所示。其中,elisa试验参考beatty等(1987)的方法,beattyjd,beattybg,vlahos wg.measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay.journal of immunologicalmethods,1987,100(1-2):173-179。
[0158]
图5中,横坐标各组依序为第一多肽至第八多肽,即1号多肽对应一抗为第一多肽的试验组的结果,2号多肽对应一抗为第二多肽的试验组的结果,以此类推;纵坐标为吸光度;横坐标的各试验组中由左至右依序为cyhv-2、pfrv、stiv、vnnv、vhsv、ihnv、阴性对照pbs和阴性对照细胞碎片的检测结果。
[0159]
图5的结果显示,八种多肽都能够特异性的结合cyhv-2,而不与其它病毒发生交叉反应。第一多肽至第八多肽的亲和力常数依序分别为7.16
±
1.25
×
107m-1
、6.7
±
2.39
×
107m-1
、6.93
±
3.55
×
107m-1
、5.36
±
1.67
×
107m-1
、1.63
±
0.43
×
106m-1
、1.83
±
0.59
×
106m-1
、4.6
±
1.75
×
105m-1
和1.15
±
0.69
×
105m-1
。
[0160]
3.多肽与cyhv-2间接免疫荧光测试
[0161]
在六孔板中传代kf细胞,待细胞长势较好时准备接种cyhv-2;接毒后约24h,吸出细胞培养液,用pbs洗涤板孔,用预冷的固定液于4℃固定10min;用pbs洗去固定液后,加入1:5稀释的各多肽,于37℃孵育1h;用pbs洗去多肽稀释液后,加入1:200稀释的兔抗鼠igg-fitc标记多肽,于37℃孵育1h;用pbs洗板后,以50%甘油-pbs封片镜检,于荧光倒置显微镜下观察结果。同时,设置未接毒的正常kf细胞作为阴性对照,阴性对照除了没有接种cyhv-2以外,其它处理方式和条件都与接种cyhv-2的kf细胞相同。荧光显微镜(400
×
)的观察结果显示,第一多肽至第八多肽,这8种多肽均能对感染cyhv-2病毒的kf细胞产生特异性荧光染色,而在未感染区则呈现阴性反应,且8种单链抗体与未接种cyhv-2之kf细胞均无反应。
[0162]
四、鲫暴发性出血病毒特异性免疫增强多肽活体试验
[0163]
1.毒性测试
[0164]
为确认本试验的第一多肽至第八多肽这8种cyhv-2特异性免疫增强多肽对鱼体是
否具备高度安全性且无不良副作用,本试验在停止给饵24h后,将两组鲫鱼分别以有效浓度的10倍和20倍剂量的多肽进行腹腔注射,与此同时,设置一个腹腔注射等量pbs的对照组,每组25只鲫鱼,8种多肽分别进行试验;并逐日观察28天,确认有无不良反应和存活率,以作为评估8种多肽安全性的标准。
[0165]
结果显示,以10倍和20倍剂量的多肽进行腹腔注射后,观察28天所有试验组的存活率都为100%,没有任何不良反应发生,对照组的情况相同,说明本试验的第一多肽至第八多肽对鱼体的安全性高。
[0166]
3.多肽保护力试验
[0167]
(1)喂饲试验
[0168]
按比例于每克饲料中加入0.5μg的多肽制备试验过程中所投喂之饲料,对照组中不加入任何多肽,本试验共设计了9种投喂饲料,即分别添加第一多肽的饲料、第二多肽的饲料、...第八多肽的饲料,以及不添加任何多肽的常规饲料。因此,本试验的试验分为9组,每组包含55条鲫鱼,体长20
±
1cm,体重150
±
10g,分别投喂对照组饲料及相应添加多肽的饲料,一日三餐,每餐50g饲料,连续投喂14天,分别在第0天、第7天及第14天于每组各随机选取5条鲫鱼测定血清内多肽浓度,其余40条于14天后进行攻毒试验。
[0169]
血清多肽浓度测试:
[0170]
将纯化的e-tag以0.5μg/孔加入到elisa板中,于室温进行包被2h,倾去包被液后以pbs洗涤,4%pbsm溶液进行过夜封闭;次日,倾去封闭液后以pbs洗涤,每孔加入150μl以4%pbsm进行两倍稀释的鲫鱼血清(1:100-1:12800),于30℃孵育1h;以pbst溶液洗涤后,每孔加入150μl以4%pbsm按1:5000稀释之兔抗鲫鱼igm抗体做为二抗,于30℃孵育1h;以pbst溶液洗涤后,每孔加入150μl以4%pbsm按1:5000稀释之hrp/羊抗兔igg抗体做为三抗,于30℃孵育1h;以pbst溶液洗涤后,每孔加入100μl的tmb底物溶液进行显色,最后以2m硫酸终止反应。然后采用酶标仪测定激发波长450nm的值,当稀释倍率的实验样本值除以空白对照值大于3倍时,视该稀释倍率为血清浓度值。血清多肽浓度测试结果如图6所示。
[0171]
图6中,横坐标为第0天、第7天及第14天测定的血清多肽浓度,纵坐标为血清多肽浓度值;第0天、第7天及第14天三组数据中,各组由左至右依序为投喂不加任何多肽的对照组的鲫鱼血清多肽浓度、投喂第一多肽饲料的鲫鱼血清多肽浓度、投喂第二多肽饲料的鲫鱼血清多肽浓度、投喂第三多肽饲料的鲫鱼血清多肽浓度、投喂第四多肽饲料的鲫鱼血清多肽浓度、投喂第五多肽饲料的鲫鱼血清多肽浓度、投喂第六多肽饲料的鲫鱼血清多肽浓度、投喂第七多肽饲料的鲫鱼血清多肽浓度、投喂第八多肽饲料的鲫鱼血清多肽浓度。
[0172]
图6的结果显示,连续投喂7天后,血清中的多肽浓度可以高达1600-3200倍,而14天后更可达到6400-12800倍,证明通过投喂可以有效提高各多肽在鱼只中的含量。
[0173]
攻毒试验:
[0174]
取纯化之病毒液,以0.22μm的滤膜过滤除菌,以每尾1ml的剂量通过腹腔注射接种于实验鱼体内,对照组注射1ml的dmem培养基,对照组及试验组各20条鱼,连续观察14天鱼只存活率。
[0175]
试验结果显示,对照组于攻毒后12天全数死亡,而有使用多肽的组别在试验结束时仍至少有20%的存活率,其中饲喂第二多肽的存活率高达75%,饲喂第五多肽的存活率达70%,饲喂第七多肽的存活率也高达75%。并且,饲喂第二多肽的组别,在第9天时的存活
率高达90%,以后几天陆续出现鱼只死亡,存活率维持在75%;第七多肽组别的情况与第二多肽组别类似;饲喂第五多肽的组别在第11天以后没有出现鱼只死亡,存活率稳定。
[0176]
(2)浸泡试验
[0177]
按比例于每升水体中加入100mg的多肽制备试验过程中所使用的浸泡液,对照组为普通淡水。试验分为9组,每组包含55条鲫鱼,体长20
±
1cm,体重150
±
10g,分别于对照组及相应添加多肽的浸泡液中进行1h浸泡,一日一次,连续进行14天,分别在第0天、第7天及第14天于每组各随机选取5条测定血清内多肽浓度,其余40条于14天后进行攻毒试验。其中,浸泡液的获取方法为,將多肽诱导表达后的发酵液经过均质机以1000bar压力进行细胞破碎,将已破壁的发酵液以12000g于4℃离心30分钟后,取得上清液,即获得含有可溶性多肽的浸泡液,并且,浸泡液中多肽浓度为3μm-30μm。
[0178]
血清多肽浓度测试:测试方法同“(1)喂饲试验”,测试结果如图7所示。图7中,横坐标为第0天、第7天及第14天测定的血清多肽浓度,纵坐标为血清多肽浓度值;第0天、第7天及第14天三组数据中,各组由左至右依序为投喂不加任何多肽的对照组的鲫鱼血清多肽浓度、投喂第一多肽饲料的鲫鱼血清多肽浓度、投喂第二多肽饲料的鲫鱼血清多肽浓度、投喂第三多肽饲料的鲫鱼血清多肽浓度、投喂第四多肽饲料的鲫鱼血清多肽浓度、投喂第五多肽饲料的鲫鱼血清多肽浓度、投喂第六多肽饲料的鲫鱼血清多肽浓度、投喂第七多肽饲料的鲫鱼血清多肽浓度、投喂第八多肽饲料的鲫鱼血清多肽浓度。
[0179]
图7的结果显示,连续投喂7天后,血清中的多肽浓度可以高达800-3200倍,而14天后更可达到6400-12800倍,证明通过浸泡同投喂方式一致,可以有效提高各多肽在鱼只中的含量。
[0180]
攻毒试验:测试方法同“(1)喂饲试验”。试验结果显示,对照组于攻毒后11天全数死亡,而有使用多肽的组别在试验结束时仍至少有15%的存活率,其中饲喂第二多肽的存活率高达75%,饲喂第五多肽的存活率达65%,饲喂第七多肽的存活率也达70%,存活率效果最为显著。
[0181]
以上试验说明,投喂或浸泡本试验的第一多肽至第八多肽中的任意多肽,都能够增强鱼体对cyhv-2的免疫力,从而提高其存活率;特别是第二多肽、第五多肽和第七多肽,存活率效果最为显著。本申请虽然仅仅以鲤鱼进行了试验,但是,可以理解,本申请的特异性免疫增强多肽是针对cyhv-2的,因此凡是cyhv-2感染或由其感染造成的疾病,都可以采用本申请的免疫增强多肽,以增强鱼体对cyhv-2的免疫力,包括但不仅限于鲤鱼及其鲫鱼暴发性出血病、金鱼及其金鱼造血器官坏死病等。
[0182]
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



