一种冰草染色体特异的寡聚核苷酸探针及其应用的制作方法
 2021-02-02 03:02:34|
2021-02-02 03:02:34| 291|
291| 起点商标网
起点商标网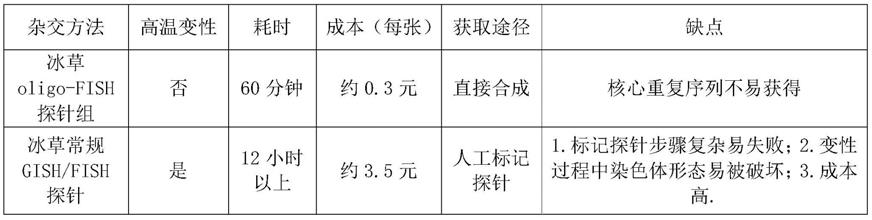
[0001]
本发明属于染色体工程领域,具体涉及一种冰草染色体特异的寡聚核苷酸探针及其应用。
背景技术:
[0002]
gish/fish技术是目前在小麦染色体工程研究中常用的染色体鉴定和分型手段,被广泛的应用于小麦远缘杂交领域,主要用于小麦背景下外源染色体或染色体片段的检测以及不同染色体的区分和界定,但是由于传统的gish/fish技术需要对目标序列进行提取和探针标记等过程,步骤复杂、实验环节多而且成本高,极大的限制了远缘杂交后代材料的鉴定效率。oligo-fish技术是一种利用人工合成带有荧光标签的寡聚核苷酸序列与染色体在非变性条件进行杂交的技术,以其杂交探针易于制备,操作过程简便等特点,目前已被广泛的用于染色体结构变异检测、特定染色体的识别以及不同背景下外源染色体鉴定等研究中。oligo-fish探针主要是在目标染色体的特定区域上产生点状或带状信号来区分和识别不同的染色体。分析和获取探针序列是oligo-fish技术的核心也是杂交成功的关键。
[0003]
随着测序技术的发展,大量物种的全基因组序列被解析出来,通过分析证明基因组中包含大量的重复序列,在高等植物中拟南芥的重复序列比例达到了14%,水稻的重复序列含量约为基因组的35%,而对于基因组较大的二倍体物种或者是多倍体物种重复序列的比例甚至超过80%;玉米基因组大小约为2.18g,其中重复序列含量为84%;黑麦中的重复序列比例甚至超过了90%,而六倍体面包小麦中重复序列的比例也达到了85%。基因组中的重复序列包含众多的序列类型,不同类型的重复序列在序列结构,分布频率以及分布范围上均存在较大的差异,如gypsy类型在小麦基因组重复序列中含量最高,其在染色体端部和着丝粒附近含量相对较少,而在其他区域含量较高,且分布较为均匀;copia类型的重复序列在染色体上也广泛分布,并且在染色体的端部区域分布含量要明显高于其他区域。重复序列在基因组中含量高,类型丰富,分布范围广,尤其在基因组较大的高等植物,是开发oligo-fish探针的理想序列材料。
[0004]
小麦野生近缘植物是小麦遗传改良的重要基因源,而远缘杂交是将小麦野生近缘植物优良性状导入小麦的有效途径,目前通过染色体工程手段已成功实现了小麦族的23个属与普通小麦的远缘杂交,并且获得大量的含有外源染色体或染色体片段的导入系,新创制的导入系携带有近缘植物的优异基因,如抗病、抗逆、产量以及品质等,其中一些性状优良且遗传平衡的导入系已成功地被应用于了小麦的遗传改良实践中并取得了良好的效果,如小麦和黑麦远缘杂交获得t1bl.1rs易位系,兼抗多种病害,且产量性状优异;小麦与簇毛麦远缘杂交后代t6al.6vs易位系,对白粉病生理小种具有广谱抗性。冰草是小麦重要的野生近缘植物之一,同时也是一种优良的牧草,具有多花多粒,耐寒抗旱,兼抗多种病害(锈病、白粉病以及黄矮病等)的优良特性,是小麦遗传改良的最佳供体之一。自实现小麦与冰草的远缘杂交以来,冰草携带的优异基因被大规模地转移到了小麦背景中,并创制出一系列携带冰草优异特性的小麦-冰草衍生系,如小麦-冰草2p附加系ii-9-3携带了高抗叶锈病
和白粉病的冰草基因;小麦-冰草6p附加系4844-12具有优良的产量特性(多花多粒,千粒重高等),并且对条锈病具有较好的抗性;小麦-冰草7p附加系ii-5-1具有千粒重高的特性,这些小麦-冰草衍生系对小麦的遗传改良具有巨大的潜力。
[0005]
目前能在非变性条件下用于冰草染色体检测的oligo-fish探针尚无报道,而已报道的可用于冰草染色体鉴定的常规fish探针多是在特定区域以点状和带状信号对冰草染色体进行识别和区分,检测范围无法覆盖冰草全染色体区域,而且目前用于检测冰草染色体的常规杂交(gish/fish)探针在杂交过程中均要对染色体进行高温处理,耗时长、成本高,这极大的限制了小麦背景中冰草染色体尤其是较小冰草染色体片段的检测效果和效率,因此亟待开发能够覆盖冰草全染色体区域的oligo-fish探针。
技术实现要素:
[0006]
本发明的一个目的是提供一种冰草染色体特异寡聚核苷酸探针。
[0007]
本发明提供的冰草染色体特异寡聚核苷酸探针,其由探针1至探针12组成;
[0008]
所述探针1至探针12的核苷酸序列依次为序列表中序列1至序列12;
[0009]
或,所述探针1至探针12的核苷酸序列依次为序列表中序列1的衍生物至序列12的衍生物。
[0010]
上述寡聚核苷酸探针中,所述各个序列的衍生物为将各个序列中1个或多个核苷酸缺失或取代得到的序列。
[0011]
上述寡聚核苷酸探针中,所述探针1至所述探针12中每条探针末端均标记荧光基团。在本发明的实施例中,每条寡聚核苷酸的5
’
末端用tamra荧光基团标记。
[0012]
含有上述探针的试剂或试剂盒也是本发明保护的范围。
[0013]
上述试剂还包括杂交缓冲液;
[0014]
上述试剂中,所述探针1:所述探针2:所述探针3:所述探针4:所述探针5:所述探针6:所述探针7:所述探针8:所述探针9:所述探针10:所述探针11:所述探针12的摩尔比为92:92:92:92:92:77:77:77:77:77:77:77。
[0015]
上述试剂中,所述各个探针在所述试剂中的浓度如下:
[0016]
探针1在探针杂交液中的浓度为0.092nmol/ml;
[0017]
探针2在探针杂交液中的浓度为0.092nmol/ml;
[0018]
探针3在探针杂交液中的浓度为0.092nmol/ml;
[0019]
探针4在探针杂交液中的浓度为0.092nmol/ml;
[0020]
探针5在探针杂交液中的浓度为0.092nmol/ml;
[0021]
探针6在探针杂交液中的浓度为0.077nmol/ml;
[0022]
探针7在探针杂交液中的浓度为0.077nmol/ml;
[0023]
探针8在探针杂交液中的浓度为0.077nmol/ml;
[0024]
探针9在探针杂交液中的浓度为0.077nmol/ml;
[0025]
探针10在探针杂交液中的浓度为0.077nmol/ml;
[0026]
探针11在探针杂交液中的浓度为0.077nmol/ml;
[0027]
探针12在探针杂交液中的浓度为0.077nmol/ml。
[0028]
上述探针或上述试剂或上述试剂盒在如下1)-6)至少一种中的应用也是本发明保
护的范围:
[0029]
1)鉴定或辅助鉴定冰草染色体;
[0030]
2)鉴定或辅助鉴定含有冰草染色体或染色体片段的小麦;
[0031]
3)鉴定或辅助鉴定待测小麦是否含有冰草染色体或染色体片段;
[0032]
4)制备鉴定或辅助鉴定冰草染色体产品;
[0033]
5)制备鉴定或辅助鉴定含有冰草染色体或染色体片段的小麦产品;
[0034]
6)制备鉴定或辅助鉴定待测小麦是否含有冰草染色体或染色体片段产品。
[0035]
上述应用中,所述含有冰草染色体或染色体片段的小麦为小麦-冰草二体附加系或小麦-冰草小片段易位系;
[0036]
或,所述染色体为全染色体或部分染色体。
[0037]
本发明还有一个目的是提供一种鉴定或辅助鉴定待测小麦是否含有冰草染色体或染色体片段的方法。
[0038]
本发明提供的方法,包括如下步骤:将待测小麦组织制片(在本发明的实施例中用根尖组织制片),用上述冰草染色体特异寡聚核苷酸探针进行原位杂交(直接进行非变性原位杂交,无需高温变性),观察结果:
[0039]
若产生杂交信号,则待测小麦含有或候选含有冰草染色体或染色体片段;
[0040]
若不产生杂交信号,则待测小麦不含有或候选不含有冰草染色体或染色体片段。
[0041]
本发明的目的在于针对常规gish/fish技术的上述缺陷,根据基因组中重复序列特点,利用生物信息学手段开发出一种获取目标物种染色体特异重复序列的方法,并利用生物信息学方法开发出一套可以在非变性条件下快速鉴定小麦背景下冰草染色体和冰草染色体片段的oligo-fish探针,该类探针可以有效解决常规gish/fish技术在冰草染色体鉴定和追踪中探针标记繁琐、价格昂贵等问题。
[0042]
本发明利用生物信息学手段对已有不同类型的冰草基因组序列进行分析,鉴定和挖掘出冰草基因组中含量较高的重复序列,包括逆转座子和dna转座子序列,并通过将小麦全基因组序列和冰草survey sequence序列库进行比对,获得在小麦基因组中无分布或分布较少而在冰草基因组中含量高且分布广的重复序列片段。
[0043]
本发明的另一目的是提供一套染色体特异寡聚核苷酸探针,利用上述方法可以获得大量的冰草染色体特异重复序列,对人工合成后的寡聚核苷酸序列进行非变性原位杂交验证,筛选出了12条杂交效果较好的冰草特异寡聚核苷酸探针,
[0044]
本发明还包括一种冰草寡聚核苷酸探针开发方法,包括如下步骤:
[0045]
1)根据斑点杂交获得的冰草序列、四倍体冰草测序的部分bac文库序列,以及二倍体冰草全基因组测序获得的servey sequence序列,共三类冰草序列,利用repeat masker软件对上述序列进行重复序列的鉴定和注释,得到不同类型的冰草重复序列;
[0046]
2)根据六倍体小麦全基因组测序数据以及其他小麦族植物全基因组测序数据中重复序列分布规律和特点,从步骤1)得到的重复序列类型中选择在全基因组测序数据中含量高并且分布广的冰草重复序列类型;
[0047]
3)利用bedtools将上述2)得到的冰草重复序列分割成60bp的短序列文库;
[0048]
4)利用blast将上述3)得到的短序列文库分别与所述六倍体小麦全基因组测序数据和二倍体冰草的servey sequence序列进行blast比对;将两次比对结果合并分析,筛选
出在小麦中匹配少,而在冰草中含量高的序列片段,即为候选寡聚核苷酸序列。
[0049]
5)对步骤4)得到的候选寡聚核苷酸序列分别按照不同序列长度再进行分割以及比对,并利用在线可视化比对网站b2dsc(http://mcgb.uestc.edu.cn/b2dsc)进行验证,选取片段大小合适的寡聚核苷酸序列。
[0050]
本发明具有如下优点:
[0051]
(1)本发明提供了一种利用不同类型的基因组序列开发目标物种染色体特异的寡聚核苷酸探针的方法,尤其是对无完整参考基因组的物种,可以通过该流程短期内获得目标物种的染色体特异重复序列。
[0052]
(2)本发明提供了一类冰草染色体特异的寡聚核苷酸探针,本发明所述的寡核苷酸探针为冰草特异序列的混合探针,该混合探针有12条冰草染色体特异的寡聚核苷酸序列构成,对该类核苷酸序列进行荧光标记可用于构建探针。
[0053]
(3)本发明提供的混合探针可在冰草染色体上产生强而清晰的信号,属于一种冰草染色体特异的寡聚核苷酸探针。使用该探针进行非变性荧光原位杂交可以快速、准确的鉴定出小麦背景中的冰草整条染色体或染色体片段,不仅省时省力而且重复性好,同时该探针的成本较低,且可以达到与常规基因组原位杂交同样的鉴定效果。
[0054]
本发明中冰草oligo-fish探针组和冰草常规gish/fish探针的对比结果如下表1所示。
[0055]
表1为冰草oligo-fish探针组和冰草常规gish/fish探针的对比结果
[0056]
附图说明
[0057]
图1为oligo-fish的荧光原位杂交的结果图。
[0058]
图2为目前已报道的冰草fish探针在二倍体冰草上的杂交信号分布。
具体实施方式
[0059]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0060]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0061]
实施例1、冰草全染色体区域的oligo-fish探针的筛选和制备
[0062]
1、寡聚核苷酸探针开发
[0063]
1)根据前期斑点杂交获得的冰草序列、四倍体冰草测序的部分bac文库序列,以及二倍体冰草全基因组测序获得的servey sequence序列,共三类冰草序列,利用repeat masker软件对上述序列进行重复序列的鉴定和注释,得到不同类型的冰草重复序列。
[0064]
2)根据六倍体小麦全基因组测序数据以及其他小麦族植物全基因组测序数据中重复序列分布规律和特点,从步骤1)得到的重复序列类型中选择在全基因组测序数据中含
量高并且分布广的冰草重复序列类型;
[0065]
3)利用bedtools将上述2)得到的冰草重复序列滑动分割成60bp的短序列文库;
[0066]
4)利用blast将上述3)得到的短序列文库分别与所述六倍体小麦全基因组测序数据和二倍体冰草的servey sequence序列进行blast比对;将两次比对结果合并分析,筛选出在小麦中匹配少,而在冰草中含量高的序列片段,即为候选寡聚核苷酸序列。
[0067]
5)对步骤4)得到的候选寡聚核苷酸序列分别按照不同序列长度再进行分割以及比对,并利用在线可视化比对网站b2dsc(http://mcgb.uestc.edu.cn/b2dsc)进行验证,选取片段大小合适的寡聚核苷酸序列。
[0068]
得到序列表中序列1至序列12所示的寡聚核苷酸序列。
[0069]
2、探针制备:
[0070]
将1设计出的序列1至序列12所示的寡聚核苷酸序列在上海生工生物公司进行合成,并在每条寡聚核苷酸的5
’
末端用tamra荧光基团进行荧光标记,得到12条覆盖冰草全染色体区域的oligo-fish探针,依次命名为探针1至探针12。
[0071]
实施例2、冰草全染色体区域的oligo-fish探针的应用
[0072]
探针合成后,分别进行非变性原位杂交实验验证探针的杂交效果和最佳杂交浓度。应用这些带有荧光基团的重复序列为探针,与小麦-冰草7p二体附加系ii-5-1(2n=42+2p),二倍体冰草z1842(2n=14,pp)的根尖有丝分裂中期染色体进行原位杂交,以验证这些探针在小麦背景下对冰草染色体的检测效果。通过设置不同杂交液浓度,并进行杂交效果比较确定合适的杂交液浓度。
[0073]
一、根尖制片
[0074]
1、根尖材料的准备
[0075]
1)将供试材料的种子浸于铺有两层滤纸的培养皿中,在25℃条件下浸泡24个小时左右,待供试种子均露白。
[0076]
2)将露白材料中多余的水分倒掉,再放入25℃培养箱中进行恒温培养。
[0077]
3)待供试材料的根组织长至1.5-2.0厘米时,将根尖组织剪下放入湿润的0.5ml离心管中,在试管顶部钻孔,放入笑气罐中充入笑气(n2o),使罐内气压保持在1mpa,处理2个小时,得到笑气处理后的根尖。
[0078]
上述供试材料分别为二倍体冰草z1842(isolation and application of p genome-specific dna sequences of agropyron gaertn.in triticeae[j].planta,2017,245(2):425-437)、小麦-冰草7p二体附加系ii-5-1(transferring desirable genes from agropyron cristatum 7p chromosome into common wheat[j].plos one,2016,11(7):e0159577.)和小麦-冰草小片段易位系wat646(cytological and molecular analysis of wheat
–
agropyron cristatum translocation lines with 6p chromosome fragments conferring superior agronomic traits in common wheat[j].genome,2016,59(10):840-850.)。
[0079]
2、供试材料根尖组织的处理
[0080]
1)将上述1得到的笑气处理后的根尖取出后,加入90%醋酸固定处理8分钟。
[0081]
2)将固定处理后根组织用蒸馏水清洗两遍。
[0082]
3)将清洗后根组织置于70%酒精中,得到处理后根尖组织,可长期于-20℃保存。
[0083]
3、根尖组织制片
[0084]
1)将上述2得到的处理后根尖组织从70%酒精中取出,放入蒸馏水中,用蒸馏水清洗3遍;
[0085]
2)将清洗后的根组织用滤纸吸取多余的水分,用刀片切去根冠,取乳白色分生区组织放入盛有纤维素酶r-10(由日本yakult公司生产,产品货号:9012-54-8)和果胶酶y-23(由日本yakult公司生产,产品货号:p8220-1g)的酶液的离心管中,酶液配方为0.1g果胶酶y-23和0.2g纤维素酶r-10溶解于9.7g的citric buffer溶液,citric buffer溶液由2.94g的柠檬酸三钠和2.94g乙二胺四乙酸溶解于1000ml水制成,每个0.5ml离心管分装15μl酶液,然后置于37℃水浴锅中酶解约60分钟;
[0086]
3)水浴结束后,向管中加入70%酒精溶液轻轻吸打后,吸出后重复一次该步骤,最后保留约30μl的70%酒精溶液。
[0087]
4)使用解剖针将根尖组织在酒精溶液中捣碎,当溶液中无大的片状组织即可,得到捣碎后悬浮液。
[0088]
5)将捣碎后悬浮液进行7000转离心3分钟,取出后倒掉上清液,并将试管置于吸水纸上晾干。
[0089]
6)待试管晾干后向其中加入30μl的冰醋酸,溶解5分钟后,涡旋震荡,利用移液枪对溶液反复吸打多次后,将10μl悬浮液滴入湿润纸盒中的玻片上,悬浮液扩散10分钟以上。
[0090]
7)待扩散完毕后即可取出进行镜检,得到供试材料玻片。
[0091]
二、中期染色体的非变性原位杂交
[0092]
1、探针杂交液的配制
[0093]
1)探针母液
[0094]
按照每nmol探针干粉加50μl的1xte缓冲液的比例分别进行溶解实施例1制备的探针1至探针12,得到每条探针母液,探针母液中每条探针浓度均为20nmol/ml。
[0095]
2xte(ph=8.0)溶液按照如下方法制备:将2.42gtris和0.418gedta溶解于1000ml水中,溶解完成后用盐酸将ph值调至8.0;
[0096]
1xte缓冲液为2xte(ph=8.0)溶液与等体积水混合稀释后得到的溶液。
[0097]
2)探针工作液及缓冲液
[0098]
探针工作液:按照每10μl探针母液加190μl缓冲液的比例进行稀释,得到探针工作液,其中每条探针的浓度均为1nmol/ml;共得到12条探针的工作液。
[0099]
上述缓冲液是将4xssc(ph=7.0)与2xte(ph=7.0)按体积比1:1混合配制得到;
[0100]
2xte(ph=7.0)按照如下方法制备:将2.42g的tris和0.418g的edta溶解于1000ml水中,溶解完成后用盐酸将ph值调至7.0;
[0101]
4xssc(ph=7.0)按照如下方法制备:将35g氯化钠和17.6g柠檬酸钠溶解于1000ml水中,溶解完成后用盐酸将ph值调至7.0。
[0102]
3)混合探针工作液及杂交液
[0103]
混合探针工作液由12条的探针工作液混合而成,其中探针1、探针2、探针3、探针4、探针5的工作液每种各12μl,探针6、探针7、探针8、探针9、探针10、探针11、探针12工作液每种各10μl,将上述探针工作液按此比例均匀混合制成混合探针工作液;
[0104]
探针杂交液由12条探针和缓冲液组成,且12条探针在探针杂交液中的浓度分别如
下:探针1在探针杂交液中的浓度为0.092nmol/ml;探针2在探针杂交液中的浓度为0.092nmol/ml;探针3在探针杂交液中的浓度为0.092nmol/ml;探针4在探针杂交液中的浓度为0.092nmol/ml;探针5在探针杂交液中的浓度为0.092nmol/ml;探针6在探针杂交液中的浓度为0.077nmol/ml;探针7在探针杂交液中的浓度为0.077nmol/ml;探针8在探针杂交液中的浓度为0.077nmol/ml;探针9在探针杂交液中的浓度为0.077nmol/ml;探针10在探针杂交液中的浓度为0.077nmol/ml;探针11在探针杂交液中的浓度为0.077nmol/ml;探针12在探针杂交液中的浓度为0.077nmol/ml;
[0105]
探针杂交液中的缓冲液由4xssc(ph=7.0)与2xte(ph=7.0)等体积混合。
[0106]
上述探针杂交液按照如下方法制备:1μl的混合探针工作液和9μl的缓冲液(4xssc与2xte 1:1等体积混合液)混合而成。
[0107]
上述探针配制过程均在避光条件下完成。
[0108]
2、非变性原位杂交
[0109]
将上述一制备的供试材料玻片放入交联仪中交联固定,总能量为1250mj,将交联后的玻片放于暗处,每张玻片加入10μl的探针杂交液,盖上盖玻片并尽量避免产生气泡。将玻片放入湿润的杂交盒中,于42℃杂交炉中杂交约一个小时即可完成杂交。
[0110]
3、洗脱以及荧光检测
[0111]
将上述2杂交完成后的玻片放入2xssc溶液(将上述4xssc与等体积的水混合溶解后即为2xssc溶液)中浸泡洗脱(室温)2分钟,取出后尽快用吸水纸吸除玻片上附着的洗脱液,加入dapi(含vector的抗褪色剂)进行复染,盖上盖玻片置于荧光显微镜下进行荧光信号检测,荧光显微镜为蔡司image z2全制动荧光显微镜,采用cy3荧光通道进行信号采集,图像由metafer4软件系统生成输出。
[0112]
结果如图1所示,
[0113]
a为oligo混合探针在二倍体冰草z1842(2n=14,p基因组)染色体上的信号分布,b为二倍体冰草z1842在dapi复染后染色体形态,图a与图b比较说明该oligo混合探针信号覆盖了冰草14条染色体的所有区域,荧光信号分布相对一致。
[0114]
c为oligo混合探针在小麦-冰草7p二体附加系ii-5-1上的杂交效果,该探针可在小麦背景下准确地识别出冰草染色体,并且冰草染色体荧光信号明显。
[0115]
小麦-冰草7p二体附加系ii-5-1已用常规杂交方法证明其包含有两条冰草染色体,具体见文献:lu m,lu y,li h,et al.transferring desirable genes from agropyron cristatum 7p chromosome into common wheat[j].plos one,2016,11(7):e0159577.
[0116]
d为利用oligo混合探针对小麦-冰草小片段易位系wat646的检测效果,该探针可在小麦背景下对冰草染色体片段进行鉴定,该探针在冰草染色体片段上荧光信号清晰明显。
[0117]
小麦-冰草小片段易位系wat646已用常规杂交方法证明其包含有冰草染色体片段,具体见文献:song l,lu y,zhang j,et al.cytological and molecular analysis of wheat
–
agropyron cristatum translocation lines with 6p chromosome fragments conferring superior agronomic traits in common wheat[j].genome,2016,59(10):840-850。
[0118]
因此,可以通过如下方法鉴定或辅助鉴定待测小麦是否含有冰草染色体或染色体片段;
[0119]
用12条探针(探针1至探针12)对待测小麦进行非变性原位杂交,观察结果:
[0120]
若产生杂交信号,则待测小麦含有或候选含有冰草染色体或染色体片段;
[0121]
若不产生杂交信号,则待测小麦不含有或候选不含有冰草染色体或染色体片段。
[0122]
对比例:
[0123]
用目前已报道的冰草fish探针对二倍体冰草进行杂交(见文献the agropyron cristatum karyotype,chromosome structure and cross-genome homoeology as revealed by fluorescence in situ hybridization with tandem repeats and wheat single-gene probe),具体如下:
[0124]
1.配制探针杂交液:将1μl的fish杂交探针加入到9μl的杂交缓冲液,缓冲液由4xssc(ph=7.0)与2xte(ph=7.0)等体积混合,
[0125]
2.加杂交液:将杂交液加到交联过的染色体玻片上,盖好盖玻片,并放入湿润的铝盒内。
[0126]
3.变性:将铝盒放在100℃水浴下变性5min。
[0127]
4.杂交:将玻片放于提前预热的杂交盒中,在55℃下,杂交12小时以上。
[0128]
5.杂交后的洗脱:将杂交后的玻片浸泡于2
×
ssc溶液中,盖玻片和非特异性探针会在溶液中脱落。
[0129]
6.染色:洗脱后的片子每张加10μl dapi,盖上盖玻片,避光保存
[0130]
fish探针为acri_cl78(genbank号:mg323512.1,提交日期:2018-6-18)和fish探针cdna 3s-3(genbank号:ak454130.1,提交日期:2017-10-4);fish探针为探针45s(genbank号:x07841.1,提交日期:1991-4-10)和cdna 3s-3;
[0131]
结果如图2所示,a为探针acri_cl78和cdna 3s-3在二倍体冰草中的杂交效果,图上的亮斑和亮带为探针在冰草染色体上的杂交信号(箭头所指);b为探针45s和cdna3s-3在二倍体冰草中的杂交效果,图上的亮斑和亮带为探针在冰草染色体上的杂交信号(箭头所指),可以看出,这些探针只能在冰草染色体上的部分区域产生信号而其余位置无法检测,并且该类型探针只能采用常规的变性杂交方式进行实验,即加入探针杂交液后,将玻片样品放入沸水中处理5分钟,再放入55℃杂交炉中处理12小时以上,耗时较长且成本高。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



