肿瘤功能突变和表位负荷作为免疫治疗反应的改进的预测性生物标志的制作方法
 2021-02-02 03:02:45|
2021-02-02 03:02:45| 389|
389| 起点商标网
起点商标网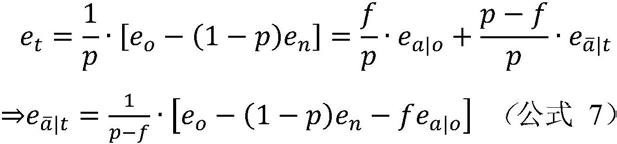
[0001]
本公开总体上涉及用于预测肿瘤对免疫疗法的反应的方法和系统。
背景技术:
[0002]
如果癌细胞对特定的免疫疗法处置有反应,则该免疫疗法可能是一种针对癌症的有效的处置。如果癌细胞对特定的免疫疗法没有反应,所述处置可能给患者带来毒性和不良副作用,而不会带来任何好处。因此,当处置患者时,确定或估计肿瘤对特定免疫疗法处置的反应性可能是非常有益的。
[0003]
肿瘤突变负荷和肿瘤新抗原负荷是免疫疗法反应的预测性生物标志物的实例。肿瘤突变负荷(tml),也称为肿瘤突变负担(tmb),可以定义为肿瘤基因组中体细胞、非同义、外显子突变的总数。该信息可以例如通过诸如全外显子组测序(wes)的测序来获得,或者可以使用靶向测序面板来估计。
[0004]
肿瘤新抗原负荷可以定义为样本中预测的新抗原总数。一些肿瘤特异性的体细胞突变会导致突变的肽或抗原出现在肿瘤细胞表面发现的主要组织相容性复合体(mhc)分子上,从而潜在地被免疫系统识别。这些肿瘤特异性抗原,称为新抗原,可以通过例如计算分析来预测。
[0005]
通常,肿瘤突变负荷与肿瘤新抗原负荷之间存在线性正相关。由于大量的新抗原表示更高的诱导抗肿瘤免疫反应的机会,因此肿瘤新抗原负荷是预测免疫疗法反应(例如免疫检查点封锁免疫疗法)的有用生物标志。肿瘤突变负荷也是预测免疫疗法反应的有用生物标志,并且在某些情况下可作为肿瘤新抗原负荷的替代物。
[0006]
但是,目前用于预测肿瘤对免疫疗法反应的方法和系统并未考虑到可用信息的全部补充,因此无法提供完整的预测。例如,虽然已知肿瘤突变负荷和肿瘤新抗原负荷是免疫治疗反应的有效生物标志,但是这些方法仍将所有突变均等对待,尽管事实是突变在肿瘤中的比例各不相同且具有不同的功能影响。
技术实现要素:
[0007]
在考虑到在肿瘤内发现的特定突变的同时,仍然需要预测肿瘤对免疫疗法的反应的方法和系统。
[0008]
本公开涉及用于预测肿瘤对免疫疗法的反应的方法和系统。本文的各种实施例和实施方案针对两种相关的方法,其利用关于肿瘤特异性突变的信息来生成高精度的免疫疗法预测。在这两种方法中,都获得并分析了有关来自患者的肿瘤样本和非肿瘤样本的遗传信息。通过比较来自肿瘤样本的基因组信息和来自非肿瘤样本的基因组信息来识别肿瘤特异性突变,并确定或估计肿瘤内肿瘤特异性突变的频率。还分析肿瘤样本以确定患者的肿瘤的肿瘤纯度。
[0009]
在第一种方法中,确定或估计每个肿瘤特异性突变的致病性。然后,使用基于变体
的量度的总和来计算肿瘤功能突变负荷评分,其与针对每个肿瘤特异性突变的所确定的肿瘤纯度、所确定的突变型等位基因频率、所确定的等位基因/外显子/基因表达和/或所确定的致病性进行调整相组合。利用肿瘤功能突变负荷评分来预测患者的肿瘤对免疫疗法处置的反应,并基于该预测来选择或设计处置过程。
[0010]
在第二种方法中,计算包括肿瘤特异性突变将表现为新抗原出现的可能性的新抗原评分,计算包括所述突变将被患者的t细胞识别的可能性的t细胞反应评分,以及/或者计算包括所述突变将被患者的b细胞受体识别的可能性的b细胞表位评分。然后,使用基于变体的量度的总和来计算肿瘤新表位负荷评分,所述基于变体的量度与针对个肿瘤特异性突变中的每个的所确定的肿瘤纯度、所确定的突变型等位基因频率、所确定的等位基因/外显子/基因表达、新抗原评分、t细胞反应性评分和/或b细胞表位评分的调整进行组合。利用所述肿瘤新表位负荷评分来预测患者的肿瘤对免疫疗法处置的反应,并基于该预测来选择或设计处置的过程。
[0011]
通常,在一个方面中,提供了一种预测肿瘤对免疫疗法的反应的方法。所述方法包括:(i)分析从患者的肿瘤获得的肿瘤样本,包括对所述肿瘤样本的遗传信息的至少部分进行测序,其中,所述肿瘤样本包含通过一个或多个突变而区分的多个不同基因组所述突变中的至少一些在所述肿瘤样本内以可变的量存在;(ii)分析从患者获得的非肿瘤样本,包括对所述非肿瘤样本的遗传信息的至少部分进行测序;(iii)通过比较来自肿瘤样本的遗传信息与来自非肿瘤样本的遗传信息,来识别仅在肿瘤样本中发现的一个或多个肿瘤特异性突变;(iv)分析来自所述肿瘤样本的遗传信息,以确定针对所识别的一个或多个肿瘤特异性突变的突变型等位基因频率;(v)分析来自所述肿瘤样本的遗传信息,以确定所述患者的肿瘤的肿瘤纯度;(vi)确定针对所识别的一个或多个肿瘤特异性突变中的至少一个的致病性;(vii)根据以下项来计算所识别的一个或多个肿瘤特异性突变中至少一个的肿瘤功能突变负荷评分:(1)一个或多个肿瘤特异性突变的所确定的突变型等位基因频率和/或所确定的等位基因特异性表达、外显子表达或基因表达;(2)所确定的肿瘤纯度;以及(3)所确定的致病性;(viii)基于所述肿瘤功能突变负荷评分,预测所述患者的肿瘤对免疫疗法处置的反应;并且(ix)基于所述预测来确定针对所述患者的处置。
[0012]
根据一个实施例,计算肿瘤功能突变负荷评分(l
m
)包括以下公式:
[0013][0014]
其中,i是肿瘤特异性突变,f是基于测量结果v
i
、a
i
和e
i
来对变体的存在或表达进行量度的函数,其中,v
i
是确定的变异等位基因频率(vaf),a
i
是等位基因特异性表达,并且e
i
是肿瘤特异性突变i的基因/外显子表达。根据一个实施例,例如,通过将它们的值除以确定的肿瘤纯度来针对特定样本的纯度调整这些测量结果。s
i
是肿瘤特异性突变i的确定的致病性。
[0015]
根据一个实施例,如果针对突变i没有致病性可用,则s
i
=1。
[0016]
根据一个实施例,所述方法还包括以下步骤:从患者获得多个样本,包括来自患者肿瘤的样本和非肿瘤样本。
[0017]
根据一个实施例,确定针对肿瘤特异性突变的致病性的步骤包括查询致病性数据
库。
[0018]
根据另一方面,是一种预测肿瘤对免疫疗法的反应的方法。所述方法包括:(i)分析从患者的肿瘤获得的肿瘤样本,包括对所述肿瘤样本的遗传信息的至少部分进行测序,其中,所述肿瘤样本包含通过一个或多个突变而区分的多个不同基因组所述突变中的至少一些在所述肿瘤样本内以可变的量存在;(ii)分析从患者获得的非肿瘤样本,包括对所述非肿瘤样本的遗传信息的至少部分进行测序;(iii)通过比较来自肿瘤样本的遗传信息与来自非肿瘤样本的遗传信息,来识别仅在肿瘤样本中发现的一个或多个肿瘤特异性突变;(iv)分析来自所述肿瘤样本的遗传信息,以确定针对所识别的一个或多个肿瘤特异性突变的突变型等位基因频率;(v)分析来自所述肿瘤样本的遗传信息,以确定所述患者的肿瘤的肿瘤纯度;(vi)确定以下中的一项或多项:(1)针对所识别的一个或多个肿瘤特异性突变中的至少一个的新抗原评分,包括所述突变将表现为新抗原的可能性;(2)针对所识别的一个或多个肿瘤特异性突变中的至少一个的t细胞反应性评分,包括所述突变将被患者的t细胞识别的可能性;以及(3)针对所识别的一个或多个肿瘤特异性突变中的至少一个的b细胞表位评分,包括所述突变将被患者的b细胞受体识别的可能性;(vii)根据以下项来计算所识别的一个或多个肿瘤特异性突变中至少一个的肿瘤新表位负荷评分:(1)新抗原评分、t细胞反应性评分和/或b细胞表位评分中的一项或多项;(2)所确定的肿瘤纯度;以及(3)针对所识别的一个或多个肿瘤特异性突变的所确定的变异等位基因频率和/或所确定的等位基因特异性表达、外显子表达或基因表达;(viii)基于所述肿瘤新表位负荷评分,预测所述患者的肿瘤对免疫疗法处置的反应;并且(ix)基于所述预测来确定针对所述患者的处置。
[0019]
根据一个实施例,计算肿瘤新表位负荷评分(l
n
)包括以下公式:
[0020][0021]
其中,i是肿瘤特异性突变,f是基于测量结果v
i
、a
i
和e
i
,来对变体的存在或表达进行量度的函数,其中,v
i
是确定的变异等位基因频率(vaf),a
i
是等位基因特异性表达,并且e
i
是针对肿瘤特异性突变i的突变基因/外显子表达。根据一个实施例,例如通过将它们的值除以确定的肿瘤纯度来针对样本的纯度调整这些测量结果。n
i
是新抗原评分,r
i
是t细胞反应性评分,并且b
i
是b细胞表位评分。
[0022]
根据一个实施例,所述方法还包括对针对肿瘤的t细胞免疫反应进行加权以产生t细胞免疫反应权重,其中,肿瘤新表位负荷评分的计算还包括t细胞免疫反应权重。根据一个实施例,所述方法还包括对针对肿瘤的b细胞免疫反应进行加权以产生b细胞免疫反应权重,其中,肿瘤新表位负荷评分的计算还包括b细胞免疫反应权重。根据一个实施例,计算肿瘤新表位负荷评分(l
n
)包括以下公式:
[0023][0024]
其中,i是肿瘤特异性突变,f是基于测量结果v
i
、a
i
和e
i
,来对变体的存在或表达进行量度的函数,其中,v
i
是确定的变异等位基因频率(vaf),a
i
是等位基因特异性表达,并且e
i
是针对肿瘤特异性突变i的突变基因/外显子表达。根据一个实施例,例如通过将它们的值除以确定的肿瘤纯度来针对样本的纯度调整这些测量结果。n
i
是新抗原评分,r
i
是t细胞
反应性评分,b
i
是b细胞表位评分,w
t
是t细胞免疫反应的权重,并且w
b
是b细胞免疫反应的权重。
[0025]
根据一个实施例,所述方法还包括分析肿瘤样本或非肿瘤样本以表征患者的hla类型,其中,新抗原评分至少部分地基于患者的hla类型。
[0026]
根据一个方面的是一种被配置为预测肿瘤对免疫疗法的反应的系统。所述系统包括:处理器,其被配置为:(i)通过比较来自肿瘤样本的遗传信息与来自非肿瘤样本的遗传信息,来识别仅在肿瘤样本中发现的一个或多个肿瘤特异性突变;(ii)分析来自所述肿瘤样本的遗传信息,以确定针对所识别的一个或多个肿瘤特异性突变的突变型等位基因频率;(iii)分析来自所述肿瘤样本的遗传信息,以确定所述患者的肿瘤的肿瘤纯度;(iv)确定针对所识别的一个或多个肿瘤特异性突变中的至少一个的致病性;(v)根据以下项来计算所识别的一个或多个肿瘤特异性突变中至少一个的肿瘤功能突变负荷评分:(1)一个或多个肿瘤特异性突变的所确定的突变型等位基因频率和/或所确定的等位基因特异性表达、外显子表达或基因表达;(2)所确定的肿瘤纯度;以及(3)所确定的致病性;并且(vi)基于所述肿瘤功能突变负荷评分,预测所述患者的肿瘤对免疫疗法处置的反应;以及用户接口,其被配置为向用户提供所述预测。
[0027]
根据一个实施例,所述系统包括病原性数据库,其中,所述处理器被配置为使用来自所述病原性数据库的数据来确定病原性。
[0028]
根据一个方面的是一种被配置为预测肿瘤对免疫疗法的反应的系统。所述系统包括:处理器,其被配置为:(i)通过比较来自肿瘤样本的遗传信息与来自非肿瘤样本的遗传信息,来识别仅在肿瘤样本中发现的一个或多个肿瘤特异性突变;(ii)分析来自所述肿瘤样本的遗传信息,以确定针对所识别的一个或多个肿瘤特异性突变的突变型等位基因频率;(iii)分析来自所述肿瘤样本的遗传信息,以确定所述患者的肿瘤的肿瘤纯度;(iv)确定以下中的一项或多项:针对所识别的一个或多个肿瘤特异性突变中的至少一个的新抗原评分,包括所述突变将表现为新抗原的可能性;针对所识别的一个或多个肿瘤特异性突变中的至少一个的t细胞反应性评分,包括所述突变将被患者的t细胞识别的可能性;以及针对所识别的一个或多个肿瘤特异性突变中的至少一个的b细胞表位评分,包括所述突变将被患者的b细胞受体识别的可能性;(v)根据以下项来计算所识别的一个或多个肿瘤特异性突变中至少一个的肿瘤新表位负荷评分:(1)新抗原评分、t细胞反应性评分和/或b细胞表位评分中的一项或多项;(2)所确定的肿瘤纯度;以及(3)针对所识别的一个或多个肿瘤特异性突变的所确定的变异等位基因频率和/或所确定的等位基因特异性表达、外显子表达或基因表达;并且(vi)基于所述肿瘤新表位负荷评分,预测所述患者的肿瘤对免疫疗法处置的反应;以及用户接口,其被配置为向用户提供所述预测。
[0029]
应当理解,上述概念和以下更详细讨论的额外概念的所有组合(假设的这些概念不是相互不一致的)被预期为是本文中公开的发明主题的一部分。尤其地,权利要求的主题的所有组合均预期为本文公开的发明主题的部分。还应该理解,本文中明确采用的术语,其也可以出现在通过引用并入的任何公开中,应该赋予与本文中公开的具体概念最符合的含义。
[0030]
参考下文描述的(一个或多个)实施例,各实施例的这些和其他方面将变得显而易见并得以阐述。
附图说明
[0031]
在附图中,相同的附图标记一般指不同视图中的相同部分。同样,附图不一定按比例,而是重点在于图示各实施例的原理。
[0032]
图1是根据一个实施例的用于预测肿瘤对免疫疗法的反应的方法的流程图。
[0033]
图2是根据一个实施例的用于预测肿瘤对免疫疗法的反应的方法的流程图。
[0034]
图3是根据一个实施例的用于预测肿瘤对免疫疗法的反应的方法的流程图。
[0035]
图4是根据一个实施例的用于预测肿瘤对免疫疗法的反应的方法的流程图。
[0036]
图5是根据一个实施例的用于预测肿瘤对免疫疗法的反应的方法的流程图。
[0037]
图6是根据实施例的用于确定肿瘤纯度的方法的流程图。
[0038]
图7是根据一个实施例的用于预测肿瘤对免疫疗法的反应的系统的示意表示。
[0039]
图8是根据一个实施例的肿瘤纯度的示意图。
具体实施方式
[0040]
本公开描述了用于将关于肿瘤特异性突变的信息结合到免疫疗法决策中的系统和方法的各种实施例。更一般而言,申请人已经认识并意识到,提供一种预测肿瘤对免疫疗法反应的系统将是有益的。使用该系统,获得并分析关于来自患者的肿瘤样本和非肿瘤样本的遗传信息。通过比较来自肿瘤样本的基因组信息和来自非肿瘤样本的基因组信息来识别肿瘤特异性突变,并确定或估计肿瘤内肿瘤特异性突变的频率。还分析肿瘤样本以确定患者的肿瘤的肿瘤纯度。
[0041]
根据第一实施例,确定或估计针对每个肿瘤特异性突变的致病性。然后,使用针对每个肿瘤特异性突变的确定的频率、确定的肿瘤纯度和确定的致病性之和来计算肿瘤功能突变负荷评分。利用肿瘤功能突变负荷评分来预测患者的肿瘤对免疫疗法处置的反应,并基于该预测来选择或设计处置过程。
[0042]
根据第二实施例,计算包括肿瘤特异性突变将表现为新抗原出现的可能性的新抗原评分,计算包括所述突变将被所述患者的t细胞识别的可能性的t细胞反应评分,并且计算包括所述突变将所述被患者的b细胞受体识别的可能性的b细胞表位评分。然后,使用基于变体的量度的总和来计算肿瘤新表位负荷评分,所述基于变体的量度与针对个肿瘤特异性突变中的每个的确定的肿瘤纯度、所确定的突变型等位基因频率和/或所确定的等位基因/外显子/基因表达、新抗原评分、t细胞反应性评分和/或b细胞表位评分的调整进行组合。利用所述肿瘤新表位负荷评分来预测患者的肿瘤对免疫疗法处置的反应,并基于该预测来选择或设计处置的过程。
[0043]
参考图1,在一个实施例中,是用于预测肿瘤对免疫疗法的反应的方法100的流程图。结合附图描述的方法仅作为示例提供,并且应被理解为不限制本公开的范围。在该方法的步骤110,提供被配置或设计为提供肿瘤免疫疗法反应预测或估计的系统。肿瘤免疫疗法反应预测或估计系统可以是本文描述或以其他方式设想的任何系统。
[0044]
在该方法的步骤112,从患者获得肿瘤样本。肿瘤样本可以是从患者的肿瘤、或从怀疑是或包含肿瘤的组织或位置获得的任何样本。肿瘤可以被定义为例如多个癌细胞,并且可以是集中的或扩散的。可以使用任何用于细胞收集的方法或系统来收集肿瘤样本,例如通过活检或其他肿瘤收集方法。
[0045]
在该方法的步骤114,从患者获得非肿瘤样本。可以从患者的任何位置或组织,优选地不可能包含肿瘤细胞的任何位置或组织提供非肿瘤样本。例如,非肿瘤样本可以是皮肤细胞、血细胞、唾液细胞或任何其他类型的细胞。可以使用任何用于细胞收集的方法或系统来收集非肿瘤样本。
[0046]
在该方法的步骤120,通过对肿瘤样本的基因组信息的至少部分进行测序来分析从患者获得的肿瘤样本。从自肿瘤获得的癌细胞中提取遗传物质,例如dna和rna,并对遗传物质进行测序。测序可以是全基因组测序、全外显子组测序、靶向外显子组测序、靶向snp分析和/或任何其他类型的测序。测序可被设计为基于例如携带突变等位基因的读段的部分来进行突变型等位基因频率检测和/或定量。以这种方式,测序识别了在肿瘤样本中发现的突变,并且可以同时定量在肿瘤样本中那些突变的发生率。
[0047]
根据一个实施例,肿瘤样本包含通过一个或多个突变而区分的多个不同基因组,其中,至少一些突变以可变的量存在于肿瘤样本内。在本领域中众所周知,遗传突变促进了癌症的发展。另外,在本领域中众所周知,随着疾病的进展,癌细胞中会出现更多的突变。细胞的快速、不受抑制的增殖导致可以增强疾病进展的突变。这些突变还充当癌症的标志或识别符,并且可以充当针对癌症处置的靶标。
[0048]
通过测序获得的遗传信息可以立即使用和/或可以被存储用于下游分析。遗传信息可以通过测序仪获得,作为肿瘤免疫疗法反应预测或估计系统的一部分,或者可以通过单独的测序仪获得,并传递给肿瘤免疫疗法反应预测或估计系统。
[0049]
在该方法的步骤130,通过对非肿瘤样本的基因组信息的至少部分进行测序来分析从患者获得的非肿瘤样本。从获得自患者的非癌细胞中提取遗传物质,例如dna和rna,并对遗传物质进行测序。测序可以是全基因组测序、全外显子组测序、靶向外显子组测序、靶向snp分析和/或任何其他类型的测序。通过测序获得的遗传信息可以立即使用和/或可以被存储用于下游分析。根据一个实施例,使用与用于肿瘤样本相同的平台或测序方法对非肿瘤样本进行测序,以允许更全面地比较肿瘤和非肿瘤样本。遗传信息可以通过测序仪获得,作为肿瘤免疫疗法反应预测或估计系统的一部分,或者可以通过单独的测序仪获得,并传递给肿瘤免疫疗法反应预测或估计系统。
[0050]
在该方法的步骤140,将从肿瘤样本获得的遗传信息与来自非肿瘤样本的遗传信息进行比较。可以使用任何用于比较遗传信息的方法来执行此操作。来自两个样本的遗传信息可以直接比较,和/或可以与参考序列比较。该比较将识别仅在肿瘤样本内发现的一个或多个突变。这些突变可以是外显子突变,也可以是非外显子突变。
[0051]
在该方法的步骤150,分析从肿瘤样本获得的遗传信息,以确定仅在肿瘤样本内发现的所识别的突变的频率。例如,可以从获得自肿瘤样本的测序信息中获得所识别的突变的变异等位基因频率(vaf)。该信息可以在对来自肿瘤样本的遗传物质进行测序期间获得,或者可以在测序后通过分析存储的测序信息来获得。根据一个实施例,通过相对于涵盖突变的位置并且不包括突变等位基因的读段的百分比来定量、追踪或以其他方式计数涵盖突变位置且包括突变等位基因的读段的百分比,来确定或估计等位基因频率。用于确定、估计或量化等位基因频率的许多其他方法是可能的。
[0052]
在该方法的步骤160,分析从肿瘤样本获得的遗传信息,以确定或表征患者肿瘤的肿瘤纯度。肿瘤纯度可以定义为例如肿瘤内异质性或癌细胞与非癌细胞的混合物,和/或肿
瘤内异质性或癌细胞亚群的混合物。这些亚群可以例如通过不同的突变来表征。可以由病理学家和/或通过一个或多个算法对基因组数据的分析来估计,计算或以其他方式表征肿瘤纯度。例如,可以对算法进行编程、训练或设计,以使用突变、拷贝数畸变和/或其他标记来区分亚群,以计算样本中最可能的基因组集合及其比例。考虑肿瘤纯度可能是免疫疗法的重要组成部分。如果肿瘤样本包含大量亚群,则仅考虑一个或某些人群可能会产生有关免疫疗法的结果的误导性信息。
[0053]
因此,方法100从患者的肿瘤和非肿瘤样本中获得遗传信息,并提供:(1)肿瘤纯度的表征;(2)对一个或多个肿瘤特异性突变的识别;以及(3)所识别的肿瘤特异性突变的频率信息。该信息在下面描述的方法200和300中使用。
[0054]
参考图2,在一个实施例中,是用于预测肿瘤对免疫疗法的反应的方法200的流程图。该方法开始于输入信息,例如经由方法100获得的信息,包括对肿瘤纯度的表征,对一个或多个肿瘤特异性突变的识别以及所识别的肿瘤特异性突变的频率信息。方法200可以利用本文描述或以其他方式设想的肿瘤免疫疗法反应预测或估计系统,以及其他可能的系统。
[0055]
在该方法的步骤210,系统确定所识别的一个或多个肿瘤特异性突变的致病性。除了其他可能的定义外,病原性可以例如定义为突变对癌症维持的影响,癌症进展,或癌症对处置的抗性的测量结果或表征以及其他定义。致病性可以基于关于突变的任何可用信息。致病性也可以或者替代地基于突变的分析以及与相似突变的比较。例如,突变可能没有可用的致病性信息,或者可能没有足够的致病性信息,但是建模者、分类器或算法可以确定该突变与另一个突变足够相似,从而致病性也将相似。因此,致病性可以基于对突变的分类。
[0056]
根据一个实施例,系统可以查询关于与致病性信息相关联的突变的信息的数据库或与之通信。例如,系统可以与远程数据库连接或以其他方式查询或从远程数据库获得信息。根据另一个实施例,所述系统可以包括这样的数据库。该数据库可以包括突变列表以及关于这些突变中的每个的致病性的信息。值得注意地,数据库可以指示不存在与特定突变相关联的已知致病性。检索、导出或生成关于突变的致病性的信息的许多其他方法也是可能的。
[0057]
例如,可以使用诸如sift,polyphen2,gerp,phylop等已知的致病性分析方法来确定致病性。可以对这些方法中的一个或多个的致病性评分进行加权和/或组合以产生单个评分。致病性评分也可以标准化。
[0058]
在该方法的步骤220,系统将肿瘤功能突变负荷评分计算为关于以下信息的总和:(i)确定的肿瘤纯度;(ii)针对所识别的肿瘤特异性突变确定的突变型等位基因频率信息和/或针对所识别的肿瘤特异性突变的等位基因、外显子和/或基因表达;和/或(iii)确定的肿瘤特异性突变的致病性。例如,根据一个实施例,肿瘤功能突变负荷评分(l
m
)使用以下公式计算:
[0059]
l
m
=∑
i
[f(v
i
,a
i
,e
i
)
·
s
i
]
ꢀꢀꢀꢀꢀꢀꢀ
(公式1)
[0060]
其中,i是在肿瘤样本中识别的肿瘤特异性突变的指标;f是基于根据它们的可用性和用户的选择的测量结果v
i
、a
i
和e
i
的任意组合对变体的存在或表达进行量度的函数;v
i
是变异等位基因频率(vaf),a
i
是等位基因特异性表达,并且e
i
是突变i的基因/外显子表达。根据一个实施例,以下是函数f的一些示例。例如,如果表达数据不可用,则f=v
i
。再举一个
示例,如果等位基因特定的表达可用,则f=a
i
。再举一个示例,如果等位基因特异性表达不可用,并假定等位基因的表达与携带替代等位基因的细胞比例和基因/外显子的整体表达成比例,则f=v
i
·
e
i
。
[0061]
根据一个实施例,所有这些措施应该针对样本的肿瘤纯度进行调整。并且s
i
是标准化的致病性/保存评分。较高的评分应指示突变的较强的功能影响或破坏作用。s
i
的值如果不可用则可以被设置。如公式1中所示,肿瘤功能突变负荷评分(l
m
)是关于在肿瘤样本中识别出的一个或多个肿瘤特异性突变的相关信息的总和。
[0062]
因此,肿瘤功能突变负荷评分通过单个突变的评分存在与预测的功能影响的乘积来衡量单个突变的效果。然后,所有突变的聚合效应由它们的乘积之和给出。
[0063]
根据一个实施例,方法200因此得到肿瘤功能突变负荷评分(l
m
)如下文参考方法400所述,可用于预测或估计患者的采样肿瘤对免疫疗法的反应。
[0064]
参考图3,在一个实施例中,是用于预测肿瘤对免疫疗法的反应的方法300的流程图。该方法开始于输入信息,例如经由方法100获得的信息,包括对肿瘤纯度的表征,对一个或多个肿瘤特异性突变的识别以及所识别的肿瘤特异性突变的频率信息。方法300可以利用本文描述或以其他方式设想的肿瘤免疫疗法反应预测或估计系统,以及其他可能的系统。
[0065]
在该方法的步骤310,系统确定所识别的肿瘤特异性突变的新抗原评分,其中新抗原评分包括该突变将作为新抗原出现在肿瘤细胞表面的可能性。根据一个实施例,新抗原评分是二元值,其中,为一的值指示预测的新抗原突变(意味着该突变将出现在肿瘤细胞的表面),而为零的值指示该突变不是新抗原突变(意味着该突变不会出现在肿瘤细胞的表面)。根据一个实施例,可以使用患者的hla类型和/或生物信息学工具例如epijen,wapp,netctl和/或netctlpan以及其他工具或算法来计算估计新抗原评分。根据一个实施例,如果信息不可用或不能确定,则可以将新抗原评分设置为一或者忽略。
[0066]
根据一个任选的实施例,在该方法的步骤312,系统从肿瘤样本和/或非肿瘤样本中表征患者的hla类型。可以使用诸如optitype,polysolver,phlat和/或hlaforest等工具从ngs数据自动确定患者的hla类型。然后,在计算针对肿瘤特异性突变的新抗原评分时,可以在该方法的步骤310中利用该信息。
[0067]
在该方法的步骤320,系统确定所识别的肿瘤特异性突变的t细胞反应性评分,其中该t细胞反应性评分包括该突变将被患者的t细胞识别以诱导抗肿瘤免疫反应的可能性。根据一个实施例,t细胞反应评分是二元值,其中,为一的值指示所述突变被预测为产生免疫反应,并且为零的值指示该突变被预测为不会导致免疫反应。在许多其他方法中,可以使用生物信息学工具或算法(例如popi和/或popisk等)来计算或推断t细胞反应性评分。根据一个实施例,如果信息不可用或不能确定,则可以将新t细胞反应性评分设置为一或者忽略。
[0068]
在该方法的步骤330,系统确定所识别的肿瘤特异性突变的b细胞表位评分,其中该b细胞表位评分包括该突变将被患者的b细胞受体识别的可能性。b细胞受体是具有广泛抗原特异性的膜结合免疫球蛋白,并且每个b细胞产生单一特异性的免疫球蛋白。根据一个实施例,b细胞表位评分是二元值,其中,为一的值指示该突变被预测为被患者的b细胞受体识别,并且为零的值指示该突变被预测为将不被患者的b细胞受体识别。在许多其他方法
中,可以使用生物信息学工具或算法(例如cobepro,bcpred和/或用于连续序列表位(~85%的已记录b细胞表位)的fbcpred和用于不连续序列表位epmeta,等等)来计算或推断b细胞表位评分。根据一个实施例,如果信息不可用或不能确定,则可以将新b细胞表位评分设置为一或者忽略。
[0069]
在该方法的步骤340,系统将肿瘤新表位负荷评分计算为关于确定的肿瘤纯度、所识别的肿瘤特异性突变的频率和表达信息、计算的新抗原评分、t细胞反应性评分和/或b细胞表位评分的信息的总和,如本文中所描述或以其他方式预想的那样。
[0070]
根据一个实施例,肿瘤新表位负荷评分(l
n
)使用以下公式来计算:
[0071]
l
n
=∑
i
[f(v
i
,a
i
,e
i
)
·
(n
i
·
r
i
+b
i
)]
ꢀꢀꢀꢀ
(公式2)
[0072]
其中,i是在肿瘤样本中识别的肿瘤特异性突变的指标;f是基于根据它们的可用性和用户的选择的测量结果v
i
、a
i
和e
i
的任意组合来对变体的存在或表达进行量度的函数,v
i
是变异等位基因频率(vaf),a
i
是等位基因特异性表达,并且e
i
是突变i的基因/外显子表达;n
i
是新抗原评分;r
i
是t细胞反应性评分;并且b
i
是b细胞表位评分。所有这些措施都可以针对样本的肿瘤纯度进行调整。根据一个实施例,以下是函数f的一些示例。例如,如果表达数据不可用,则f=v
i
。再举一个示例,如果等位基因特定的表达可用,则f=a
i
。再举一个示例,如果等位基因特异性表达不可用,并假定等位基因的表达与携带替代等位基因的细胞比例和基因/外显子的整体表达成比例,则f=v
i
·
e
i
。
[0073]
因此,肿瘤新表位负荷评分通过分数存在与抗原决定其预测评分的乘积来对诱导单个突变的免疫反应的能力进行量度,所述评分可以是t细胞(n
i
·
r
i
)和b细胞(b
i
)免疫原性的加权平均值。对于t细胞免疫反应,它主要包括通过hla途径和t细胞识别和反应进行的整合抗原处理。与t细胞不同,b细胞可以识别其b细胞受体具有特异性的可溶性抗原,然后使用mhc ii类分子处理该抗原并呈递肽。然后,所有突变的聚合效应由它们的乘积之和给出。根据一个实施例,用于表位预测评分的公式可以被能够有效地测量预测由突变诱导的免疫反应的任何其他公式代替。
[0074]
根据一个实施例,肿瘤新表位负荷评分可以还包括分别针对t细胞和b细胞免疫反应的用户定义的权重。这些权重的值取决于各种因素,例如特定疾病中t细胞和b细胞的相对重要性、分析的假定和假设、预测评分的鲁棒性以及其他因素。例如,如果假设是研究中的免疫反应仅取决于t细胞反应性,而b细胞的参与可忽略不计,则用户可以将t细胞权重设置为1,并将b细胞权重设置为0。
[0075]
因此,在该方法的任选的步骤350,系统确定针对肿瘤的t细胞免疫反应的加权因子,从而产生t细胞免疫反应权重。这可以由用户基于例如肿瘤特异性突变的身份以及其他方法来定义。
[0076]
类似地,在该方法的可选步骤360,系统确定针对肿瘤的b细胞免疫反应的加权因子,从而产生b细胞免疫反应的权重。这可以由用户基于例如肿瘤特异性突变的身份以及其他方法来定义。
[0077]
根据一个实施例,在该方法的步骤340处的肿瘤新表位负荷评分的计算还包括t细胞免疫反应权重和b细胞免疫反应权重。因此,肿瘤新表位负荷评分(l
n
)可以使用以下公式计算:
[0078]
l
n
=∑
i
[f(v
i
,a
i
,e
i
)
·
(w
t
·
n
i
·
r
i
+w
b
·
b
i
)]
ꢀꢀꢀꢀ
(公式3)
[0079]
其中,w
t
是t细胞免疫反应的权重,w
b
是b细胞免疫反应的权重。如果研究中的免疫反应仅取决于t细胞反应性,而b细胞的参与可忽略不计,则用户可以设置w
t
=1和w
b
=0。类似地,如果研究中的免疫反应仅取决于b细胞的参与,而t细胞的参与则可忽略不计,则用户可以设置w
t
=0和w
b
=1。因此,w
t
和w
b
可以被设置为0到1之间的任何值。
[0080]
根据一个实施例,方法300因此得到肿瘤新表位负荷评分(l
n
如下文参考方法400所述,可用于预测或估计患者的采样肿瘤对免疫疗法的反应。
[0081]
参考图4,在一个实施例中,是用于预测肿瘤对免疫疗法的反应的方法400的流程图。该方法从输入信息开始,例如在方法200中计算的肿瘤功能突变负荷评分(l
m
)和/或在方法300中计算的肿瘤新抗原表位评分(l
n
)。方法400可以利用本文描述或以其他方式设想的肿瘤免疫疗法反应预测或估计系统,以及其他可能的系统。
[0082]
在该方法的步骤410,系统基于肿瘤功能突变负荷评分和/或肿瘤新表位负荷评分来预测患者的肿瘤对免疫疗法处置的反应。根据一个实施例,肿瘤功能突变负荷评分和/或肿瘤新表位负荷评分的输出是直接转化为患者肿瘤对免疫疗法处置的预测反应的数值或其他值。根据另一个实施例,肿瘤功能突变负荷评分和/或肿瘤新表位负荷评分的输出是经过额外分析或解读以提供患者肿瘤对免疫疗法处置的预测反应的数值或其他值。
[0083]
在该方法的步骤420,医师,临床医师或其他用户利用来自步骤410的预测来生成或以其他方式告知针对患者的处置。例如,所述预测可能指示处置x不太可能在肿瘤中产生足够的免疫反应。类似地,所述预测可能指示处置y可能会在肿瘤中产生足够的免疫反应。因此,医师或临床医师可以使用预测来选择处置y而不是处置x。
[0084]
根据本文描述或以其他方式设想的方法的一个示例实施方式,临床医师计划对癌症患者使用抗pd1免疫疗法,但希望首先使用肿瘤新表位负荷评分来预测治疗反应。从患者的肿瘤块和血液样本中进行组织活检,并对肿瘤样本和血液样本进行全外显子组测序(wes)。通过对生成的测序数据进行读段比对和变异调用,可以使用血液样本作为匹配的正常参考来识别体细胞突变及其变异等位基因频率(vaf)。使用wes数据来计算活检的肿瘤纯度。通过使用免疫信息学工具的组合来计算地获得n
i
和r
i
的值以评估每个体细胞突变的免疫原性。由于抗pd1治疗的有效性主要取决于t细胞的免疫反应,w
t
被设置为1并且w
b
被设置为0。使用公式2或3计算患者的肿瘤新表位负荷评分。在相同的诊断、临床分期和年龄范围下,所得的肿瘤新表位负荷评分高于患者群的75%,指示患者对抗pd1治疗产生积极反应的可能性很高。然后,临床医师决定为患者实施抗pd1免疫疗法。
[0085]
根据本文描述或以其他方式设想的方法的另一示例实施方式,治疗的有效性可能需要来自t细胞和b细胞的协同免疫反应。在同种异体造血干细胞移植(allosct)的情况下,对患者进行化学疗法和放射疗法,之后,所述患者接受灌注相容供体的造血干细胞。这种灌注的好处是移植物抗白血病(gvl)效应,其中供体细胞表现出对残留恶性细胞的免疫反应。研究表明,在一种这样的情况下,可以通过针对常染色体抗原ptk2b的协同cd4+t细胞和b细胞反应来部分解释这种作用。在这种情况下,w
t
可以被设置为0.5并且w
b
可以被设置为0.5,或在两个免疫反应之间进行另一个此类权重分配,以更好地估计肿瘤新表位负荷评分。
[0086]
参考图5,在一个实施例中,其是流程图500,用于计算肿瘤功能突变负荷评分(tfml)550和肿瘤新表位负荷评分(tnl)560。根据一个实施例,肿瘤免疫疗法反应预测或估计系统利用流程图500的工作流程、输入和/或组成来生成肿瘤功能突变负荷评分或肿瘤新
表位负荷评分。根据一个实施例,系统接收输入的肿瘤样本和非肿瘤样本,和/或从肿瘤样本和非肿瘤样本获得的遗传信息510作为输入。该系统还可以接收病原性信息520作为输入,或者可以包括包含病原性信息的数据库。该系统利用所描述的输入和公式1(530)来生成功能性肿瘤负载突变评分550。该系统利用所描述的输入和公式2或3(540),以生成肿瘤新表位负荷评分560。值得注意的是,对于肿瘤功能突变负荷评分(tfml)或肿瘤新表位负荷评分(tnl),并不是流程图500中包含的每个组成/步骤/元素都是必需的。
[0087]
参考图6,在一个实施例中,其是根据一个实施例的用于确定肿瘤纯度的流程图600。快速有效地抑制正常细胞在基因组(例如突变负荷或vaf)、转录组(例如基因表达)、表观遗传学(例如甲基化)、蛋白质组学或其他定量数据中引入的噪声信号,可以更准确地确定它们在肿瘤细胞中的存在/丰度,并减轻了后续数据分析中肿瘤纯度的混淆作用。
[0088]
根据一个实施例,如图1中示意性地描绘,如图8所示,肿瘤样本/活检将包括具有分数p(即肿瘤纯度)的肿瘤细胞和正常细胞(1-p)。携带特定突变等位基因的肿瘤细胞比例为f。根据旨在计算肿瘤纯度的实施例,可以确定和定义特定变量。应该注意的是,肿瘤细胞是指来自肿瘤组织的异常细胞的一部分,其由肿瘤和正常细胞的混合物组成。
[0089]
根据一个实施例,例如,对于每个体细胞突变,肿瘤纯度计算可包括以下变量:v
o
=在肿瘤组织中的观察到的突变等位基因的变异等位基因频率;以及v
t
=肿瘤细胞中的突变等位基因的经调整的等位基因频率。对于每个基因:e
n
=正常细胞(即匹配的正常组织)中的标准化表达水平;e
o
=在肿瘤组织中的观察到的标准化表达水平;e
a|o
=在肿瘤组织中的观察到的标准化等位基因特异性表达水平;e
t
=在肿瘤细胞中的经调整的标准化表达水平;e
a|t
=在肿瘤细胞中的经调整的归一化突变体-等位基因特异性表达水平;并且=肿瘤细胞中的经调整的归一化参考-等位基因特异性表达水平。
[0090]
根据一个实施例,可以出于肿瘤纯度计算的目的假定:肿瘤纯度p是已知的,并且可以由病理学家或基因组数据的计算分析来估计;e
n
是从同一患者的匹配正常组织中获得的正常细胞的表达,或者是整个人群的正常组织中的平均值;并且v
o
,e
o
和e
a|o
是由生物信息学工具从dna和rna/蛋白质组学数据生成的组织平均数据。肿瘤细胞中突变等位基因的vaf可以根据以下公式计算:
[0091]
v
t
=v
o
/p
ꢀꢀꢀ
(公式4)
[0092][0093]
为了肿瘤纯度计算的目的,可以进一步假设每个细胞仅携带一个拷贝的突变,那么样本中携带特定突变的细胞比例为:
[0094]
f=2v
o
ꢀꢀꢀꢀꢀꢀꢀ
(公式6)
[0095]
为了肿瘤纯度计算的目的,可以进一步假定体细胞突变等位基因仅存在于肿瘤细胞中,然后e
a|t
=e
a|o
。由于e
t
也由给出,基于公式(5),得到以下关系:
[0096][0097]
通过应用公式4-7,可以调整基因组和转录组数据中的肿瘤纯度,并减轻其在随后的数据分析中的混淆作用。
[0098]
尽管该分析主要集中在肿瘤纯度的调整上,但公式(5)可以很容易地泛化为支持对多个细胞亚群的调整:
[0099][0100]
其中,q
i
和e
i
分别是亚群i中细胞和基因表达的分数,k是亚群的总数,t表示需要评估其表达谱的目标亚群的指标,并且
[0101]
根据一个实施例,所述过程可以被使用以针对其进行调整或基于肿瘤纯度。第一步可以是估计组织样本的肿瘤纯度p。已经有许多为此目的的基于基因组和转录组数据的反卷积的计算工具和方法。在匹配的正常样本可用后,可以通过对dna测序数据运行变体检出物(例如gatk)来识别体细胞突变,并使用以下公式来简单计算样本中观察到的突变型等位基因频率(vaf):
[0102][0103]
其中,t_ref_count是带有参考等位基因的读段的数目,t_alt_count是带有肿瘤样本中替代/突变等位基因的读段的数目。公式4然后可以被应用以在肿瘤细胞中找到它们的vaf。这些纯度调整后的vaf值可用于研究和评估突变负担和肿瘤进展。
[0104]
通过进行微阵列或rna测序,基因或蛋白质表达e
o
和e
n
可以分别针对肿瘤和匹配的正常组织获得。如果没有合适的正常组织,也可以通过使用其他个体正常组织的平均表达来估计e
n
。具有已知的肿瘤纯度,然后可以使用公式5来计算肿瘤细胞中的基因/蛋白质表达。通过消除肿瘤纯度的混杂效应,此类纯度调整的表达数据可提高下游分析的鲁棒性。
[0105]
对于rna测序数据,可以使用gatk,alleleseq和allim等工具进一步计算肿瘤组织中的等位基因特异性表达(ase)。然后可以通过应用公式6和7来计算肿瘤细胞中参考等位基因的特异性表达。通过排除由于肿瘤细胞与正常细胞之间的差异而引起的任何差异表达,这可以使得能够更有效地研究肿瘤细胞中突变的顺式作用。用于调整基因组和转录组数据中的肿瘤纯度的流程图在图6中示出。
[0106]
根据一个实施例,所述过程可用于计算或分析新兴细胞亚群的基因表达。例如,可以在两个不同的时间点从患者的同一部位获得两次组织活检,并且可能需要研究在此期间出现的任何新细胞亚群的基因表达谱。假设在第二个样本中发现了一个新的体细胞突变,其vaf为v
o
并进一步假设该突变仅与新的亚群相关。在这种情况下,新亚群的细胞比例通过公式6而被估计为2v
o
,假设每个细胞仅携带一个拷贝的突变等位基因。然后可以通过应用公式5来获得新亚群的基因表达谱如下:
[0107]
[0108]
其中,e1和e2分别是在第一和第二时间点的基因表达值。
[0109]
根据一个实施例,所述过程可以用于调整已知细胞类型的基因表达谱。例如,已知目标细胞亚群t被k种其他细胞类型所污染,每种类型都具有明确定义的基因表达特征。通过反卷积,可以估计针对每个细胞类型i的分数q
i
。作为替代,q
i
也可以通过组织学图像分析来估计。由于针对每种细胞类型i已知平均表达谱e
i
,我们可以通过应用公式8来计算感兴趣的细胞亚群的基因表达谱如下:
[0110][0111]
参考图7,在一个实施例中,是用于预测肿瘤对免疫疗法的反应的方系统700的示意表示。系统700包括经由一个或多个系统总线710互连的处理器720、存储器727、用户接口740、通信接口750和存储器760中的一个或多个。在一些实施例中,例如其中系统包括或实现测序器或测序平台的那些实施例,硬件可以包括额外的测序硬件715,其可以是任何测序器或测序平台。应该理解,图7在一些方面构成抽象,并且系统700的部件的实际组织可能与图示的不同并且更复杂。
[0112]
根据一个实施例,系统700包括能够执行存储在存储器727或存储设备760中的指令或以其他方式处理数据的处理器720。处理器720执行该方法的一个或多个步骤,并且可以包括在本文中描述或以其他方式设想的一个或多个模块。处理器720可以由一个或多个模块形成,并且可以包括例如存储器727。处理器720可以采取任何合适的形式,包括但不限于微处理器、微控制器、多个微控制器、电路、现场可编程门阵列(fpga)、专用集成电路(asic)、单个处理器或多个处理器。
[0113]
存储器727可以采用任何合适的形式,包括非易失性存储器和/或ram。存储器727可以包括各种存储器,例如高速缓存或系统存储器。这样,存储器727可以包括静态随机存取存储器(sram)、动态ram(dram)、闪存、只读存储器(rom)或其他类似的存储器设备。存储器可以存储操作系统等。处理器使用ram来临时存储数据。根据一个实施例,操作系统可以包含代码,所述代码在由处理器执行时控制系统700的一个或多个部件的操作。显而易见的是,在处理器以硬件实现本文描述的一个或多个功能的实施例中,可以省略在其他实施例中描述为与此类功能相对应的软件。
[0114]
用户接口740可以包括用于实现与诸如管理员的用户的通信的一个或多个设备。用户接口可以是允许传达和/或接收信息的任何设备或系统,并且可以包括用于接收用户命令的显示器、鼠标和/或键盘。在一些实施例中,用户接口740可以包括命令行接口或图形用户接口,其可以经由通信接口750呈现给远程终端。用户接口可以与系统的一个或多个其他部件一起定位,或者可以位于远离系统的位置并且经由有线和/或无线通信网络进行通信。
[0115]
通信接口750可以包括用于实现与其他硬件设备的通信的一个或多个设备。例如,通信接口750可以包括被配置为根据以太网协议进行通信的网络接口卡(nic)。另外,通信接口750可以实现tcp/ip栈,用于根据tcp/ip协议进行通信。用于通信接口750的各种替代或附加硬件或配置将是显而易见的。
[0116]
存储设备760可以包括一个或多个机器可读存储介质,诸如只读存储器(rom),随机存取存储器(ram),磁盘存储介质,光存储介质,闪存设备或类似的存储介质。在各种实施
例中,存储设备760可以存储用于由处理器720执行的指令或者处理器720可以操作的数据。例如,存储设备760可以存储用于控制系统700的各种操作的操作系统761。在系统700实现测序器并且包括测序硬件715的情况下,存储设备760可以包括用于操作测序硬件715的测序指令762。根据一个实施例,存储设备760可以包括如本文所描述或以其他方式设想的致病性数据库764。
[0117]
显而易见的是,存储在存储器760中的各种信息可以额外地或替代地存储在存储器727中。在这方面,存储器727还可以被认为构成存储设备,并且存储设备760可以被认为是存储器。各种其他布置将是显而易见的。此外,存储器727和存储器760都可以被认为是非瞬态机器可读介质。如本文中所使用的,术语非瞬态将被理解为排除瞬态信号但包括所有形式的存储设备,包括易失性和非易失性存储器。
[0118]
虽然系统700被示出为包括每个所描述的部件中的一个,但是在各种实施例中各种部件可以是多个。例如,处理器720可以包括多个微处理器,所述多个微处理器被配置为独立地执行本文描述的方法,或者被配置为执行本文描述的方法的步骤或子例程,使得多个处理器协作以实现本文中描述的功能。此外,在云计算系统中实现系统700的情况下,各种硬件组件可以属于单独的物理系统。例如,处理器720可以包括第一服务器中的第一处理器和第二服务器中的第二处理器。许多其他变型和配置是可能的。
[0119]
根据一个实施例,处理器720包括一个或多个模块以执行本文中描述或以其他方式设想的方法的一个或多个功能或步骤。例如,处理器720可以包括肿瘤特异性突变模块722(识别和变异频率),肿瘤纯度模块723,致病性模块724,新抗原模块725和/或t细胞/b细胞模块726,以及其他可能的模块。
[0120]
根据一个实施例,肿瘤特异性突变模块722识别一个或多个肿瘤特异性突变,和/或确定肿瘤特异性突变的频率。肿瘤特异性突变模块722可以将从肿瘤样本获得的遗传信息与从非肿瘤样本获得的遗传信息进行比较,以识别仅在肿瘤样本中发现的一个或多个突变。肿瘤特异性突变模块722还可以分析从肿瘤样本获得的遗传信息,以确定仅在肿瘤样本内发现的所识别的突变的频率。该信息可以在对来自肿瘤样本的遗传物质进行测序期间获得,或者可以在测序后通过分析存储的测序信息来获得。根据一个实施例,通过相对于涵盖突变的位置并且不包括突变等位基因的读段的百分比来定量、追踪或以其他方式计数涵盖突变位置且包括突变等位基因的读段的百分比,来确定或估计等位基因频率。用于确定、估计或量化等位基因频率的许多其他方法是可能的。
[0121]
根据一个实施例,处理器720包括肿瘤纯度模块723。肿瘤纯度模块723分析从肿瘤样本获得的遗传信息,以确定或表征患者肿瘤的肿瘤纯度。根据一个实施例,可以通过一个或多个算法对基因组数据的分析来估计、计算或以其他方式表征肿瘤纯度。例如,可以对算法进行编程、训练或设计,以使用突变、拷贝数畸变和/或其他标记来区分亚群,以计算样本中最可能的基因组集合及其比例。
[0122]
根据一个实施例,处理器720包括致病性模块724。根据一个实施例,致病性模块724可以计算或采集针对所识别的一个或多个肿瘤特异性突变的致病性。例如,致病性可以基于关于突变的任何可用信息。因此,病原性模块724可以与诸如病原性数据库764的病原性数据库通信,其可以是系统700的部件或者可以远离系统700。致病性还可以或基于致病性模块724对突变的分析。例如,突变可能没有致病性信息可用,或者可能没有足够的致病
性信息可用,但是致病性模块724可以确定该突变与另一突变足够相似,使得致病性也将相似。
[0123]
根据一个实施例,处理器720包括新抗原模块725。根据一个实施例,新抗原模块725确定针对所识别的肿瘤特异性突变的新抗原评分,其中,新抗原评分包括该突变将作为新抗原出现在肿瘤细胞表面的可能性。新抗原模块725可以利用患者的hla类型和/或生物信息学工具,例如epijen,wapp,netctl和/或netctlpan,以及其他工具或算法,来计算新抗原评分。
[0124]
根据一个实施例,处理器720包括t细胞/b细胞模块726。根据一个实施例,t细胞/b细胞模块726确定所识别的肿瘤特异性突变的t细胞反应性评分,其中,t细胞反应性评分包括该突变将被患者的t细胞识别以诱导抗肿瘤免疫反应的可能性。在许多其他方法中,t细胞反应性评分可以由t细胞/b细胞模块726使用生物信息学工具或算法(例如,popi和/或popisk)来计算或推断。
[0125]
根据一个实施例,t细胞/b细胞模块726确定所识别的肿瘤特异性突变的b细胞表位评分,其中,b细胞表位评分包括该突变将被患者的b细胞受体识别的可能性。在许多其他方法中,b细胞表位评分可以由t细胞/b细胞模块726使用生物信息学工具或算法(例如cobepro,bcpred和/或fbcpred用于连续序列表位)来计算或推断(记录的b细胞表位的~85%),以及用于不连续序列表位的epmeta等。
[0126]
本文中定义并使用的所有定义,均应被理解为支配词典定义、通过引用并入的文件中的定义和/或所定义术语的普通意义。
[0127]
如在本文中在说明书和权利要求书中使用的词语“一”和“一个”,除非明确地另行指出,应被理解为意指“至少一个”。
[0128]
如在本文中说明书和权利要求书中使用的短语“和/或”应当理解为是指如此结合的元件中的“一个或两者”,即元件在某些情况下结合存在,并且在其他情况中分离地存在。以“和/或”列出的多个元件应以相同的方式来解释,即如此连接的“一个或多个”元件。任选地可以存在除“和/或”子句特别标识的元素之外的其它元素,无论是与专门标识的那些元件相关或不相关。
[0129]
如在本文中在说明书和权利要求中所使用的,“或”应理解为具有与以上定义的“和/或”相同的含义。例如,当分离列表中的项目时,“或”或者“和/或”应被解释为包含性的,即,包括若干元件或元件的列表中的至少一个,但也包括多于一个,以及任选地,额外的未列出的项目。只有明确指出相反的项,例如“只有一个”或“确切地一个”,或者在权利要求书中使用“由
……
组成”时,将指的是包括若干元件或元件的列表中的确切的一个元件。一般来说,本文中使用的术语“或”仅在以排他性项(即“一个或另一个但不是两者”)为前序时应被解释为指示排他性的替代方案,例如“任一”,“中的一个”,“中的仅一个”或“中的确切的一个”。
[0130]
本文在说明书和权利要求书中使用的,短语“至少一个”,在对一个或多个元件的列举的引用中,应被理解为意指选自所述列举的元件中的所述元件的一个或多个的至少一个元件,但不必须包含所述元件的列举中具体列出的每个和每一个元件中的至少一个,并且不排除所述列举的元件中元件的任意组合。该定义还允许任选地存在除了在短语“至少一个”所指的元素列表中具体标识的元素之外的元素,无论是与专门识别的元素相关或不
相关的元素。
[0131]
还应当理解,除非明确地指出相反,否则在本文所主张的任何包括多于一个步骤或动作的方法中,方法的步骤或动作的顺序不一定限制到方法的步骤或动作被记载的顺序。
[0132]
在权利要求书以及上述说明书中,所有过渡性短语如“包括”,“包含”,“承载”,“具有”,“含有”,“涉及”,“持有”将被理解为开放式的,即意味着包括但不限于此。只有过渡短语“由
……
组成”和“基本上由
……
组成”应分别是封闭或半封闭的过渡短语。
[0133]
尽管本文中已描述并图示了几个创新实施例,但本领域技术人员将容易地预想多种其他方式和/或结构,用于执行所述功能和/或获得所述结果和/或本文描述的优点中的一个或多个,并且这样的变型和/或更改中的每个均被示为在本文描述的创新实施例的范围内。更一般地,本领域技术人员将容易地认识到,本文描述的所有参数、尺寸、材料和配置均意图为示范性的,并且实际参数、尺寸、材料和/或配置将取决于特定的应用或所述创新的教导被用于的应用。本领域技术人员将认识到或能够使用不超过常规实验来确定本文所述的具体创造性实施例的许多等价方案。因此,应当理解,前述实施例仅以示例的方式呈现,并且在所附权利要求及其等价方案的范围内,创造性实施例可以以与具体描述和要求保护的不同的方式来实践。本公开的创新实施例涉及本文描述的每个个体特征、系统、物品、材料、成套设备和/或方法。此外,两个或多个这样的特征、系统、物品、材料、成套设备和/或方法的任意组合,如果这样的特征、系统、物品、材料、成套设备和/或方法不相互抵触的话,均被包括在本公开的创新范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



