一种利用生物酶法提取黑木耳多糖的方法与流程
 2021-02-02 02:02:17|
2021-02-02 02:02:17| 417|
417| 起点商标网
起点商标网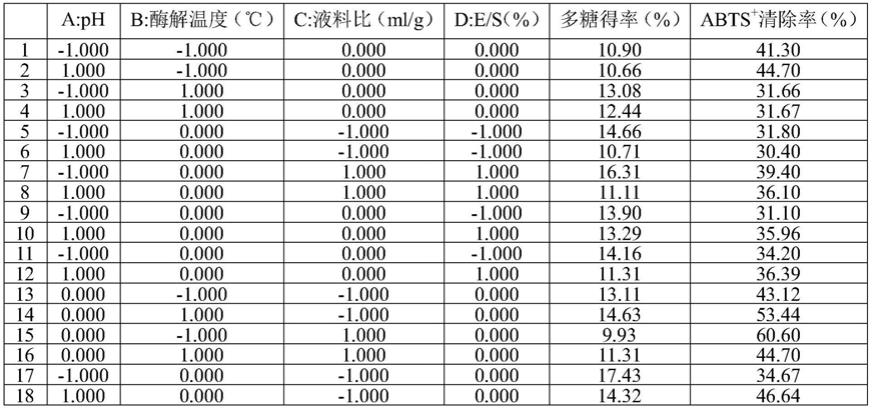
一种利用生物酶法提取黑木耳多糖的方法
(一)技术领域
[0001]
本发明涉及一种黑木耳多糖的酶法提取方法。
(二)
背景技术:
[0002]
黑木耳(auricularia auricula)是我国重要的药食胶质真菌,其子实体干重的60%以上为多糖类物质,具有降血糖、降血脂、免疫调节、抗氧化等多种功能。2017年我国黑木耳总产量达638.84万吨,但只有约6%的产量用于产品精深加工,影响着产业的可持续发展。制约黑木耳多糖提取以及进一步精深加工的主要原因为,黑木耳细胞壁不同于植物细胞壁,多层紧密及其复杂的网状细胞壁结构使其极其复杂坚韧。
[0003]
目前传统的真菌多糖提取方法主要有热水浸提法、临界水萃取法、化学法、物理法、机械法、生物酶法、多种方法协同复合提取法等,这些方法也适合黑木耳多糖的提取与制备。其中,热水浸提是较为简单的提取方法,与其他方法相比,其简单的操作方式更适合制备多糖用于深入研究其结构及活性。化学法包括热酸浸提、热碱浸提等,该法剧烈的反应条件下获得较高得率的同时会造成多糖活性片段降解,生物活性降低。机械法破壁过程中物料可保持为常温或低温,避免破壁产生的高温导致的物料活性成份破坏,保证原料有效成份的完整性,且其不易引入杂质,没有破壁介质,不会对物料造成污染,但对设备要求较高,能耗相对较大。
[0004]
生物酶法可针对天然真菌细胞壁上的特定位点在相对吻合的反应条件下精准高效破壁这一特点近年来受到广泛关注。由于不同种类酶的破壁位点不同,破壁效果存在一定程度差异。如骆嘉原等利用生物酶法提取黑木耳多糖,综合考虑黑木耳多糖的降血糖活性与多糖得率,选择糖化酶、木瓜蛋白酶与果胶酶作为黑木耳多糖生物转化的酶制剂,总加酶量700u/g、三种酶配比1:1:1、料液比1:60、ph 5.0、酶解时间1.5h、酶解温度50℃,黑木耳多糖得率可达32.57%。赵玉红等采用正交试验法优化纤维素酶法提取黑木耳多糖工艺,黑木耳多糖得率可达到9.29%。刘立梅等发现果胶酶在加酶量为1.1%,浸提时间2.5h,料水比1:60,酶解ph值5.0,最适温度50℃时,黑木耳多糖的提取率为11.6%。张立娟等发现蛋白酶反应的最适ph值为6.5,添加量为2%,反应时间60min,此条件下黑木耳多糖提取率为17.2%。鲜乔等采用中心组合试验法优化得出在几丁质酶添加量400u/g,ph 8.0,提取温度42℃、提取时间1.65h,液料比98ml/g时多糖提取率可达11.78%
[5]
。娄在祥等采用超声协同复合酶法对黑木耳多糖提取工艺进行优化,得出料液比1:50,浸提时间2.5h,浸提温度80℃,超声波功率125w,超声波复合酶作用时间60min,作用温度50℃,纤维素酶用量390u/g,中性蛋白酶用量650u/g时,黑木耳多糖提取率可达10.41%。韩春然等以中性蛋白酶和纤维素酶复合提取黑木耳中的粗多糖。郑钧予等采用绿色木酶、果胶酶与纤维素酶三种复合酶辅助提取黑木耳多糖,最佳工艺条件为控制料液比(g/ml)1:40,ph 7.0,酶解温度40℃,酶解时间3.0h,黑木耳多糖提取率为4.353%。
[0005]
黑木耳是一种比较独特的食药用菌,其多糖具有极高的药用价值。针对黑木耳极其坚韧与多层次的细胞壁结构特征,本发明根据担子菌纲黑木耳细胞壁的结构特点与分子
组成(细胞壁包含甘露糖蛋白、β-(1,3)-葡聚糖、β-(1,6)-葡聚糖、少量几丁质),分别采用5种不同的生物酶,以多糖得率与abts
+
清除率为响应值,辅以bbd的设计方法优化提取条件,sem扫描电镜观察生物酶作用于细胞壁的表面特征,以获得高得率强生物活性(自由基清除率、抗氧化应激、减脂)的黑木耳多糖,可实现黑木耳加工的新利用。
(三)
技术实现要素:
[0006]
本发明目的是提供一种黑木耳多糖的生物酶法提取方法,以黑木耳为原料,以多糖得率与abts
+
自由基清除率为响应值,利用不同种类酶的破壁位点差异,通过bbd的设计方法与sem扫描电镜,获得高得率强生物活性(自由基清除率、抗氧化应激、减脂)的黑木耳多糖的方法。
[0007]
本发明采用的技术方案是:
[0008]
本发明提供一种利用生物酶法提取黑木耳多糖的方法,所述方法为:
[0009]
(1)将黑木耳粉加入去离子水中,加入纤维素酶与木瓜蛋白酶,在45-80℃、ph4.0-8.0条件下提取1-5h;(2)再加入β-葡聚糖酶或甘露聚糖酶或中性蛋白酶中的一种,在45-80℃、ph2.0-9.0条件下提取1-5h;(3)然后加热至沸15min灭酶,离心(8000rpm离心20min),取上清液,加入2-6倍(优选4倍)体积的95%乙醇,4℃静置10h后,离心(3000rpm离心10min);(4)取沉淀,溶解于2-7倍(优选5倍)体积去离子水中后,采用sevag法脱蛋白至上层280nm没有吸收峰,浓缩至原体积的1/3,冷冻干燥(初始温度为-30℃,真空度为80pa),获得黑木耳多糖。
[0010]
进一步,优选步骤(1)提取条件为:55℃、ph 5.3条件下提取3.0h。
[0011]
进一步,步骤(1)所述去离子水用量以黑木耳粉重量计为30~70ml/g(优选60ml/g);所述纤维素酶与黑木耳粉重量比为0.06~0.12:1(优选0.08:1);所述木瓜蛋白酶与黑木耳粉重量比为0.04~0.12:1(优选0.12:1)。
[0012]
进一步,步骤(1)所述黑木耳粉加入之前按如下方法预处理:将黑木耳粉溶解于去离子水中,25℃溶胀8~16h,然后在-20℃冰箱中冷冻50~70min(优选60min),20℃恒温水浴锅中解冻,进行2~4次(优选3次)冻融循环,获得预处理后的黑木耳粉;所述黑木耳粉是将黑木耳粉碎过150-200目筛;所述去离子水体积用量以黑木耳粉重量计为28~32ml/g(优选30ml/g)。
[0013]
进一步,步骤(2)所述β-葡聚糖酶与黑木耳粉重量比为0.04~0.12:1(优选0.04-0.06:1);所述甘露聚糖酶与黑木耳粉重量比为0.01~0.12:1(优选0.015:1);所述中性蛋白酶与黑木耳粉重量比为0.04~0.12:1(优选0.04:1)。
[0014]
进一步,步骤(2)加入β-葡聚糖酶的提取条件为:55℃、ph 5.3条件下提取2h;加入甘露聚糖酶的提取条件为:70℃、ph 2.8条件下提取2h;加入中性蛋白酶的提取条件为:50℃、ph 9.0条件下提取2h。
[0015]
进一步,步骤(4)所述用sevag法脱蛋白按如下步骤进行:将沉淀溶于去离子水后,置于分液漏斗中,加入sevag试剂(氯仿:正丁醇=4:1,v:v),上下剧烈振荡2min后,置于铁架台上静置至上下分层,取上层,在280nm处检测是否有吸收峰,继续用sevag试剂洗脱至上层在280nm没有吸收峰;所述sevag试剂每次加入量为去离子水体积的1/4。
[0016]
进一步,步骤(4)冷冻干燥条件为初始温度为-30℃,真空度为80pa。
[0017]
进一步,所述纤维素酶活力50u/mg,木瓜蛋白酶活力10u/mg,β-葡聚糖酶活力50u/mg。
[0018]
本发明方法还提供所述黑木耳多糖在提高体外抗氧化性(abts
+
清除率、dpph自由基清除率与过氧化氢清除率)、秀丽隐杆线虫的抗氧化应激能力中的应用,同时涉及黑木耳多糖在提高降脂活性中的应用。
[0019]
与现有方法相比,本发明的有益效果主要体现在:
[0020]
1.同时以多糖得率与abts
+
自由基清除率为指标进行响应面优化,保证所制得产品纯度高,其中多糖含量可高达35%以上,且体外抗氧化活性与秀丽隐杆线虫体内抗甲基紫精氧化应激活性及降脂活性高;
[0021]
2.针对担子菌纲黑木耳胶质菌细胞壁呈多层网状,质地坚韧的结构特点,以及其细胞壁的分子组成(细胞壁包含甘露糖蛋白、β-(1,3)-葡聚糖、β-(1,6)-葡聚糖、少量几丁质)特点,细胞壁内所含有的多糖类物质很难透过细胞壁,利用不同种类生物酶的破壁位点差异,结合bbd的设计方法与sem扫描电镜的细胞壁破壁形态,充分保证细胞壁的破碎效果,形成疏松多孔的状态,有利于壁内多糖的溶出与自由基清除能力、抗氧化应激、减脂等生物活性的改善。
[0022]
3.不同生物酶的合理复配可以进一步改善黑木耳胶质菌坚韧的细胞壁,同时酶法提取制备的产品无异味、感官性状好。生物酶的复配组成与生物酶处理的先后顺序至关重要,经超声结合酶,再酶法再超声的改性处理工艺,可使黑木耳多糖的提取得率达36.43%,对abts
+
清除率为98.32%、dpph自由基清除率为92.74%,过氧化氢清除率为66.56%;并可使甲基紫精胁迫下线虫存活时间延长至600min,线虫体内的sod(超氧化物岐化酶)活力与cat(过氧化氢酶)活力分别达81.7u/mgprot与22.6u/mgprot,甘油三酯含量降至3.53mmol/l,且均与阴性对照组比较差异显著(p<0.05)。纤维素酶复合木瓜蛋白酶+β-葡聚糖酶的提取方式可使黑木耳多糖的提取得率、体外抗氧化性(abts
+
清除率、dpph自由基清除率与过氧化氢清除率)、秀丽隐杆线虫的抗氧化应激能力与降脂活性明显提高,多糖的提取得率与体外抗氧化能力比传统的采用热水提取的黑木耳多糖分别提高了9.36倍、1.27倍、2.38倍、2.67倍;sod与cat分别比传统的采用热水提取的黑木耳多糖提高了2.51倍与3.10倍,甘油三酯比传统的采用热水提取的黑木耳多糖降低了1.50倍。多糖的提取得率与体外抗氧化能力比传统的机械粉碎的粗粉提取的黑木耳多糖分别提高了1.39倍、1.03倍、1.06倍、1.11倍;sod与cat分别比机械粉碎粗粉提取的黑木耳多糖提高了1.28倍与1.30倍,甘油三酯比机械粉碎粗粉提取的黑木耳多糖降低了1.44倍。多糖的提取得率与体外抗氧化能力比不经反复冻融提取的黑木耳多糖分别提高了1.31倍、1.04倍、1.13倍、1.10倍;sod与cat分别比不经反复冻融提取的黑木耳多糖提高了1.05倍与1.17倍,甘油三酯比不经反复冻融提取的黑木耳多糖降低了1.21倍。多糖的提取得率与体外抗氧化能力比三种酶复合同时提取黑木耳多糖分别提高了1.21倍、1.06倍、1.03倍、1.07倍;sod与cat分别比三种酶复合同时提取的黑木耳多糖提高了1.04倍与1.15倍,甘油三酯比三种酶复合同时提取的黑木耳多糖降低了1.12倍。多糖的提取得率与体外抗氧化能力比三种酶依次提取的黑木耳多糖分别提高了1.26倍、1.09倍、1.14倍、1.27倍;sod与cat分别比三种酶依次提取的黑木耳多糖提高了1.16倍与1.43倍,甘油三酯比三种酶依次提取的黑木耳多糖降低了1.04倍。该工艺条件温和,绿色环保,符合保健食品的生产要求。
(四)附图说明
[0023]
图1为不同单因素(料液比、ph、温度、加酶量)对甘露聚糖酶提取黑木耳多糖的得率与abts
+
清除率的影响。
[0024]
图2甘露聚糖酶提取黑木耳多糖对多糖得率的响应面图。
[0025]
图3甘露聚糖酶提取黑木耳多糖对多糖abts
+
清除率的响应面图。
[0026]
图4不同单因素对木瓜蛋白酶提取黑木耳多糖的得率与abts
+
清除率。
[0027]
图5木瓜蛋白酶提取黑木耳多糖对多糖得率的响应面图。
[0028]
图6木瓜蛋白酶提取黑木耳多糖对多糖abts
+
清除率的响应面图。
[0029]
图7不同单因素对纤维素酶提取黑木耳多糖的得率与abts
+
清除率。
[0030]
图8纤维素酶提取黑木耳多糖对多糖得率的响应面图。
[0031]
图9纤维素酶提取黑木耳多糖对多糖abts
+
清除率的响应面图。
[0032]
图10不同单因素对β-葡聚糖酶提取黑木耳多糖的得率与abts
+
清除率。
[0033]
图11 β-葡聚糖酶提取黑木耳多糖对多糖得率的响应面图。
[0034]
图12 β-葡聚糖酶提取黑木耳多糖对多糖abts
+
清除率的响应面图。
[0035]
图13不同单因素对中性蛋白提取酶黑木耳多糖的得率与abts
+
清除率。
[0036]
图14中性蛋白酶提取黑木耳多糖对多糖得率的响应面图。
[0037]
图15中性蛋白酶提取黑木耳多糖对多糖abts
+
清除率的响应面图。
[0038]
图16黑木耳细胞壁表面特征电镜图片(注:1、2、3、4、5、6、7分别代表黑木耳粉、热水浸提木耳、甘露聚糖酶提、中性蛋白酶提、β-葡聚糖酶提、纤维素酶提、木瓜蛋白酶提;a、b、c、d对应1000、3000、5000、10000四种放大倍数)。
[0039]
图17纤维素酶提多糖、木瓜蛋白酶提多糖与β-葡聚糖酶提多糖对线虫体内抗氧化物酶(sod与cat)酶活的影响。
[0040]
图18苯酚-硫酸法测定葡萄糖含量的标准曲线。
(五)具体实施方式
[0041]
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
[0042]
实施例1
[0043]
1材料与试剂
[0044]
黑木耳(黑龙江省萝北县延军农场小兴安岭产)。使用前,置于50℃烘箱烘干,粉碎,筛选目数为150~200目的黑木耳粉,备用。
[0045]
苯酚、浓硫酸、氢氧化钠、乙醇、磷酸二氢钠、磷酸氢二钠、磷酸二氢钾、过硫酸钾、氯仿、正丁醇、丙酮、硫酸亚铁、氯化亚铁、氯化铁、铁氰化钾、乙二胺四乙酸(edta)、葡萄糖、1,1-二苯基-2-苦肼基(dpph)、双氧水、菲咯嗪(ferrozine)、尼罗红荧光染料、抗坏血酸(vc)、阿伐他汀钙、2,2-联氮-二(3-乙基-苯并噻唑啉磺酸-6)铵盐(abts),实验所用水为去离子水。
[0046]
n2野生型秀丽隐杆线虫(caenorhabditis elegans)和大肠杆菌(escherichia coli)op50由浙江大学动物科学学院惠赠。
[0047]
中性蛋白酶(100u/mg)、甘露聚糖酶(10u/mg)、木瓜蛋白酶(10u/mg)、β-葡聚糖酶
(50u/mg)与纤维素酶(活力50u/mg),均购自源叶生物科技股份有限公司。
[0048]
2实验仪器
[0049]
jp-250a-2型高速多功能粉碎机,上海市久品工贸有限公司;fa224上海舜宇恒平科学仪器有限公司;hh-s数显恒温水浴锅,金坛市国旺实验仪器厂;sha-b数显恒温振荡器,常州天瑞仪器有限公司;l535-1低速离心机,湖南湘仪实验仪器开发有限公司;tg16-ws台式高速离心机,湖南湘仪离心机仪器有限公司;紫外可见光分光光度计i3,海能仪器;shz-d(ⅲ)型循环水式多用真空泵,郑州科率仪器设备有限公司;vs-840k-u洁净工作台,苏州安泰空气技术有限公司;智能生化培养箱,宁波海曙赛福实验仪器厂;re-52旋转蒸发仪,上海亚荣生化仪器厂;dhg-9240a电热恒温鼓风干燥箱,上海精密实验设备有限公司。
[0050]
3实验方法
[0051]
3.1黑木耳粉
[0052]
将黑木耳子实体粉碎过150~200目筛,即为黑木耳粉。
[0053]
3.2生物酶法提取黑木耳多糖工艺的优化
[0054]
分别采用中性蛋白酶、甘露聚糖酶、β-葡聚糖酶、木瓜蛋白酶与纤维素酶,以酶解温度、料液比、加酶量(e/s)、酶解ph、酶解时间为单因素,以abts
+
清除率以及多糖得率为响应值进行单因素实验,具体方法如下:
[0055]
(1)酶解温度:称取黑木耳粉(过150~200目筛)10g,分别加入0.02g(e/s为2%,即酶与黑木耳粉的质量比)的中性蛋白酶、甘露聚糖酶、β-葡聚糖酶、木瓜蛋白酶或纤维素酶,按1g/50ml料液比加入去离子水,调节ph7.0,每种酶控制温度分别为20℃、30℃、40℃、50℃、60℃或70℃,提取2h后放入100℃沸水浴中灭酶2min,8000rpm离心20min。滤渣加入与第一次相同质量的中性蛋白酶、甘露聚糖酶、β-葡聚糖酶、木瓜蛋白酶或纤维素酶,同样条件下第二次提取,将两次上清液合并后混合均匀,记录两次合并的体积。取1.0ml上清液,采用苯酚-硫酸法检测上清液中多糖含量,并折算为得率。
[0056]
(2)料液比:称取黑木耳粉(过150~200目筛)10g,加入e/s为2%的中性蛋白酶、甘露聚糖酶、β-葡聚糖酶、木瓜蛋白酶或纤维素酶,分别按1/30、1/40、1/50、1/60、1/70、1/80或1/90(g/ml)料液比加入去离子水,调节ph7.0,控制温度为50℃,提取2h。其他步骤同步骤(1)。
[0057]
(3)加酶量(e/s):称取黑木耳粉10g(过150~200目筛),加入e/s分别为0.5%、1.0%、2.0%、4.0%、8.0%与16.0%的中性蛋白酶、甘露聚糖酶、β-葡聚糖酶、木瓜蛋白酶或纤维素酶,按1/50(g/ml)料液比加入去离子水,调节ph7.0,控制温度为50℃,提取2h。其他步骤同步骤(1)。
[0058]
(4)ph:称取黑木耳粉10g(过150~200目筛),加入e/s为2%的中性蛋白酶、甘露聚糖酶、β-葡聚糖酶、木瓜蛋白酶或纤维素酶,按1/50(g/ml)料液比加入去离子水,调节ph分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0或9.0,控制温度为50℃,提取2h。其他步骤同步骤(1)。
[0059]
(5)酶解时间:称取黑木耳粉10g(过150~200目筛),加入e/s为2%的中性蛋白酶、甘露聚糖酶、β-葡聚糖酶、木瓜蛋白酶或纤维素酶,按1/50(g/ml)料液比加入去离子水,调节ph7.0,控制温度为50℃,酶解时间分别控制为1h、2h、3h、4h与5h。其他步骤同步骤(1)。
[0060]
(6)多糖含量检测方法:参照gb/t 15672-2009。
[0061]
多糖得率(%)=[c*v*f*10-6
/m*(1-w)]*100。
[0062]
式中,c—根据标准曲线(图18)得到的待测多糖样品的浓度(μg/ml);v—两次提取合并的多糖样品的体积(ml);f—稀释倍数;m—黑木耳粉的质量(g);w—黑木耳粉的含水量(%)。
[0063]
3.3响应面设计
[0064]
根据单因素结果,选取影响黑木耳多糖得率与abts
+
清除率显著的三个因素为自变量,黑木耳多糖得率与abts
+
清除率为响应值,采用box-behnken design方法(三因素三水平)设计响应面实验。
[0065]
3.4扫描电镜(sem)观察黑木耳料渣
[0066]
按5种酶最优条件分别提取黑木耳多糖,取离心后黑木耳料渣2g在20ml体积浓度2.5%的戊二醛水溶液中4℃固定过夜,倒掉固定液,用磷酸缓冲液(0.1m,ph7.0)漂洗三次,每次15min;再用1%锇酸溶液固定样品1.5h,倒掉固定液;用磷酸缓冲液(0.1m,ph7.0)漂洗三次,每次15min。用梯度浓度乙醇(30%、50%、70%、80%、90%、95%)水溶液对样品进行脱水处理,每种浓度处理15min,再用100%乙醇处理一次20min。将样品置于临界点干燥仪(leica em cpd300)中干燥,mc1000离子溅射仪(icn sputter)上镀膜,itachi su8010型场发射扫描电镜(sem)中观察。
[0067]
同样条件下,用黑木耳子实体及热水浸提物代替黑木耳料渣进行检测。热水浸提物为:取1g黑木耳粉,按料液比1g/60ml加入去离子水,80℃水浴搅拌提取4h,8000rpm离心20min,取滤渣。
[0068]
3.5体外抗氧化指标检测
[0069]
5种酶按照最优条件提取黑木耳多糖,取提取后的上清液,即为黑木耳多糖粗提液。
[0070]
按上述方法制备黑木耳多糖粗提液285ml,加入4倍体积的95%乙醇,4℃静置10h后,3000rpm离心10min,取沉淀,溶解于60ml去离子水中后,采用sevag法脱蛋白至280nm没有吸收峰,浓缩至体积为20ml,即为黑木耳多糖液,按3.2(6)的方法检测多糖含量后,用去离子水稀释成多糖含量0.5mg/ml的多糖溶液,测定以下抗氧化指标:
[0071]
(1)abts
+
清除率的测定。制备abts工作液,即将abts储备液(1ml,7.4mmol/l)与k2s2o8(1ml,2.6mmol/l)储备液混匀,静置过夜。取1.0ml abts工作液,用pbs(ph 7.4)稀释至734nm处吸光度值为0.7
±
0.02,即为使用液。取1.0ml多糖溶液(0.5mg/ml),与abts使用液4ml混合均匀,常温避光静置6min,于734nm波长测吸光度。95%乙醇代替样品做为空白,与样品等浓度的vc溶液作阳性对照。abts
+
清除率的计算公式如下:清除率=(a
空白-a
样品
)/a
空白
×
100%。
[0072]
(2)dpph自由基清除率的测定。取2ml多糖溶液(0.5mg/ml)于试管中,加入dpph(0.1mmol/l)的无水乙醇溶液2ml,于涡旋振荡器上混合均匀,室温下避光静置30min。517nm处测定吸光度,记为a
样品
。去离子水代替多糖溶液做空白,记为a
空白
;去离子水代替dpph试剂做对照,记为a
对照
;与样品等浓度的vc溶液作阳性对照。dpph自由基清除率的计算公式如下:
[0073]
清除率=(a
空白-a
样品
+a
对照
)/a
空白
×
100%
[0074]
(3)过氧化氢清除率。用紫外分光光度法测定多糖样品对h2o2的猝灭能力,依次在试管中加入1.0ml pbs缓冲液(0.1mol/l,ph 7.4),0.5ml、0.5mg/ml多糖溶液,3.0ml h2o2(40nmol/l),充分混合均匀,230nm处测定吸光度值(记为a1),按照下式计算过氧化氢清除
率。同样条件下,用等量水替换多糖溶液,记为a0;将用等量水替换h2o2,记为a2。
[0075]
清除率(%)=[a
0-(a
1-a2)]/a0×
100%
[0076]
式中:a0为水、pbs、h2o2反应后吸光度;a1为将a0中水换成黑木耳多糖;a2为将a1中h2o2去除。
[0077]
3.6体内生物活性指标检测
[0078]
秀丽隐杆线虫(caenorhabditis elegans)生长培养基(ngm培养基)的配制:1000ml的ngm培养基含2.5g蛋白胨,3g nacl,17g琼脂,25mlpbs缓冲液(ph 6.0,1m),975ml去离子水,灭菌后加入1ml胆固醇水溶液(5mg/ml),1mlmgso4水溶液(1m),1mlcacl2水溶液(1m)。
[0079]
1000ml的lb培养基含10g胰化蛋白胨、5g酵母提取物、10g nacl,以5m naoh调至中性,溶剂为蒸馏水。
[0080]
1000ml的m9缓冲液含l5.12 g na2hpo4·
12h2o、3g kh2po4、5g nacl、0.25g mgso4·
7h2o。
[0081]
裂解液:0.5ml去离子水,0.3ml naclo,0.2ml 10mol/l naoh水溶液,现配现用。
[0082]
线虫培养:e.coli op50接种于lb液体培养基中,37℃摇床培养过夜后,置于4℃备用。秀丽隐杆线虫n2接种于涂布了e.coli op50且细菌生长良好的ngm培养基上,于20℃恒温培养72h后,可见培养基上有大量成虫和幼虫。
[0083]
线虫同步化:选择线虫生长良好的平板,吸取1.5ml m9缓冲液于平板上,洗涤平板数次直至将大部分虫体洗下,吸取1ml线虫悬浊液于1.5ml ep管中,3000rpm离心1min,弃去上清液,用0.25ml去离子水复溶沉淀。然后加入0.15ml裂解液,漩涡振荡5min,4000rpm离心1min,弃去上清液,再加入1ml m9缓冲液复溶,涡旋洗涤,4000rpm离心1min,重复洗涤直至无次氯酸钠的味道。将裂解出的虫卵置于未涂布op50的ngm培养基上,于20℃培养箱中培养16h后,为l1期线虫。用m9缓冲液将虫体洗下,置于已涂布op50的ngm培养基上,在20℃培养箱中培养48h,得同步化完成的l4期线虫。
[0084]
甲基紫精诱导的抗氧化应激实验:将涂布有op50的ngm培养基平板,设置阴性对照组、阳性对照组及多糖组,阴性对照组加入150μl的m9缓冲液,阳性对照组加入150μl的vc水溶液(0.5mg/ml),多糖组加入150μl的0.5mg/ml多糖溶液(3.5方法制备)。分别挑取30条同步化处理后l4期的线虫至每个平板上,于20℃培养48h。然后将线虫转移至含83mg/ml甲基紫精水溶液的96孔板中,于20℃培养,从转移时刻起开始计时,转移时记为0分钟,每隔40min记录线虫存活数目。
[0085]
黑木耳多糖对线虫体内抗氧化物酶[超氧化物歧化酶(sod)与过氧化氢酶(cat)]酶活影响:选择同步化后l4期线虫生长良好的平板,切块接种于涂布了e.coli op50且细菌生长良好ngm培养基平板上,于20℃恒温培养5d。用m9缓冲液将线虫洗下,转移至新的ngm平板上。设置空白对照组、阳性对照组(vc)与黑木耳多糖组,分别加入相同体积(150μl)的m9缓冲液、0.5mg/ml的vc水溶液、0.5mg/ml的黑木耳多糖溶液(3.5方法制备),20℃培养48h。每组取1个平板的线虫量,使用m9缓冲溶液清洗线虫3次后,加入m9缓冲溶液制成线虫悬浊液。各组样品按照上述步骤处理后,严格按照南京建成生物工程所cat和sod测试盒说明书要求的操作。另取30μl样品,按照bca蛋白浓度测定试剂盒操作方法测定蛋白含量,计算相对含量。
[0086]
黑木耳多糖对线虫体内脂肪的影响:选择同步化后l4期线虫生长良好的平板,切块接种于涂布了e.coli op50且细菌生长良好的ngm培养基平板上,于20℃恒温培养5d。用m9缓冲液将线虫洗下,转移至新的含1.0mol/l葡萄糖的ngm培养基平板上,于20℃恒温培养3d。设置正常对照组(正常线虫,没有加葡萄糖培养的线虫)、阴性对照组、阳性对照组(阿伐他汀钙)与黑木耳多糖组,分别加入相同体积(150μl)的m9缓冲液、0.5mg/ml的阿伐他汀钙水溶液、0.5mg/ml的黑木耳多糖溶液(3.5方法制备),继续20℃培养48h。每组取1个平板的线虫量,使用m9缓冲溶液清洗线虫3次后,加入m9缓冲溶液制成线虫悬浊液。各组样品按照上述步骤处理后,严格按照南京建成生物工程所甘油三酯测试盒说明书要求的操作。
[0087]
4实验结果
[0088]
4.1生物酶法提取黑木耳多糖工艺优化
[0089]
4.1.1甘露聚糖酶提取黑木耳多糖的单因素实验及响应面优化
[0090]
料液比、体系ph值、酶解温度与加酶量(e/s)对黑木耳多糖提取得率与abts
+
清除率的影响见图1。
[0091]
由于酶解时间对黑木耳多糖得率与abts
+
清除率的影响趋势完全相反,且不同时间点不存在显著性差异,故酶解时间固定为2h。在其它4种单因素试验基础上,根据中心组合试验原理,采用design-expert.v8.0.6软件设计了四因素三水平响应面分析试验。响应面实验因素水平见表1,实验设计及结果见表2,回归模型的显著性分析及差异分析见表3与表4。
[0092]
表1甘露聚糖酶提取黑木耳多糖的实验设计因素水平表
[0093]
编码水平a:phb:酶解温度(℃)c:液料比(ml/g)d:e/s(%)-11.050602.002.560703.014.070804.0
[0094]
表2甘露聚糖酶提取黑木耳多糖实验设计及及实验结果
[0095]
[0096][0097]
表3甘露聚糖酶提取黑木耳多糖得率的回归模型分析
[0098]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel78.99145.644.210.0055a-ph6.3916.394.780.0463b-温度8.4518.456.310.0249c-料液比46.69146.6934.87<0.0001d-e/s0.1510.150.110.7468ab0.04010.0400.0300.8652ac0.8110.810.610.4496ad1.2511.250.940.3495bc0.004910.00490.003660.9526bd0.2710.270.200.6631cd0.01610.0160.0120.9155a26.3016.304.710.0477b28.3118.316.210.0259c24.7614.763.560.0802d20.04510.0450.0340.8574residual18.74141.34
ꢀꢀ
lack of fit14.58101.461.400.3989
[0099]
表4甘露聚糖酶提取黑木耳多糖自由基清除率的回归模型分析
[0100]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel965.861468.992.600.0420a-ph67.40167.402.540.1330b-温度65.89165.892.490.1371c-料液比14.67114.670.550.4690d-e/s47.40147.401.790.2023ab2.8912.890.110.7461ac8.8518.850.330.5724ad1.7811.780.0670.7991bc171.871171.876.490.0232bd4.3314.330.160.6922cd0.9010.900.0340.8562a210.01110.010.380.5486
b2161.041161.046.080.0272c2184.371184.376.960.0195d2131.121131.124.950.0430residual370.881426.49
ꢀꢀ
lack of fit336.411033.643.900.1006
[0101]
表3的分析表明,多糖得率结果经统计分析,模型p值为0.0055,说明模型显著。r2为0.8082,调整r2为0.6165,c.v值为8.72%,失拟项p值为0.3989不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序为x3>x2>x1>x4。表4的分析表明,abts
+
清除率结果经统计分析,模型p值为0.0420,说明模型显著。r2为0.7226,调整r2为0.4451,c.v值为13.05%,失拟项p值为0.1006,不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序x1>x2>x4>x3(x1、x2、x3、x4分别代表ph、温度、料液比、e/s)。
[0102]
甘露聚糖酶提取黑木耳多糖的得率与abts
+
清除率的响应面图见图2与图3。
[0103]
响应面优化最优条件为提取温度70℃、料液比1/80、ph2.81、e/s 3%条件下多糖溶出率可达15.572%,abts
+
清除率为50.455%。结合实际实验室条件,最优调整为:温度70℃、时间2h、e/s 3%、ph 2.8、料液比1/80。为了进一步验证该模型与实际情况的有效性与准确性,按响应面试验优选出的提取条件进行3次平行实验,黑木耳多糖得率可以达到17.16%
±
0.43%,abts
+
清除率达51.2%
±
3.15%,与预测值一致,说明响应面分析方法可靠,与实际情况拟合较好,从而验证了回归方程的有效性。
[0104]
4.1.2木瓜蛋白酶提取黑木耳多糖的单因素实验及响应面优化
[0105]
酶解温度、体系ph值与加酶量(e/s)对黑木耳多糖提取得率与abts
+
清除率的影响见图4。
[0106]
由于不同水平的酶解时间与料液比对黑木耳多糖得率与abts
+
清除率的影响不存在差异,故酶解时间固定为3h,料液比固定为1g:60ml。在其它3种单因素试验基础上,根据中心组合试验原理,采用design-expert.v8.0.6软件设计了三因素三水平响应面分析试验。响应面实验因素水平见表5,实验设计及结果见表6,回归模型的显著性分析及差异分析见表7与表8。
[0107]
表5木瓜蛋白酶提取黑木耳多糖的实验设计因素水平表
[0108]
编码水平a:酶解温度(℃)b:e/s(%)c:ph-1404.04.00508.05.016012.06.0
[0109]
表6木瓜蛋白酶提取黑木耳多糖实验设计及及实验结果
[0110] a:酶解温度(℃)b:e/s(%)c:ph多糖得率(%)abts
+
清除率(%)1-1.000-1.0000.00017.4049.6321.000-1.0000.00013.8645.903-1.0001.0000.00017.9249.2541.0001.0000.00019.0648.585-1.0000.000-1.00016.2346.90
61.0000.000-1.00015.8044.227-1.0000.0001.00016.0749.2581.0000.0001.00015.4451.5090.000-1.000-1.00014.5154.52100.0001.000-1.00018.1061.20110.000-1.0001.00013.9154.02120.0001.0001.00017.9161.64130.0000.0000.00015.3756.45140.0000.0000.00015.5156.95150.0000.0000.00016.6255.28160.0000.0000.00017.5451.09170.0000.0000.00017.2554.77
[0111]
表7木瓜蛋白酶提取黑木耳多糖得率的回归模型分析
[0112][0113][0114]
表8木瓜蛋白酶提取黑木耳多糖自由基清除率的回归模型分析
[0115]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel352.29939.145.180.0206a-温度2.8812.880.380.5564b-e/s34.57134.574.580.0697c-ph11.45111.451.520.2580ab2.3012.300.300.5986ac6.0816.080.800.3995bc0.2210.220.0290.8690a2284.951284.9537.730.0005b211.48111.481.520.2575c26.9616.960.920.3689residual52.8777.55
ꢀꢀ
lack of fit31.59310.531.980.2593
[0116]
表7的分析表明,多糖得率结果经统计分析,模型p值为0.0206,说明模型显著。r2为0.8767,调整r2为0.7181,c.v值为4.94%,失拟项p值为0.2593不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序为x2>x1>x3。表8的分析表明,abts
+
清除率结果经统计分析,模型p值为0.0206,说明模型显著。r2为0.7340,调整
r2为0.3920,c.v值为7.74%,失拟项p值为0.2593,不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序x2>x3>x1(x1、x2、x3分别代表温度、e/s、ph)。
[0117]
木瓜蛋白酶提取黑木耳多糖的得率与abts
+
清除率的响应面图见图5与图6。
[0118]
响应面优化最优条件为提取温度52.14℃、ph5.56、e/s 12.0%条件下多糖溶出率可达18.4205%,abts
+
清除率为59.6491%。结合实际实验室条件,最优调整为:温度53℃、时间3h、e/s 12.0%、ph 5.3、料液比1/60。为了进一步验证该模型与实际情况的有效性与准确性,按响应面试验优选出的提取条件进行3次平行实验,黑木耳多糖得率可以达到18.86%
±
1.76%,abts
+
清除率达61.35%
±
2.86%,与预测值一致,说明响应面分析方法可靠,与实际情况拟合较好,从而验证了回归方程的有效性。
[0119]
4.1.3纤维素酶提取黑木耳多糖的单因素实验及响应面优化
[0120]
酶解温度、酶解时间与料液比对黑木耳多糖提取得率与abts
+
清除率的影响见图7。
[0121]
由于不同水平的体系ph值与加酶量(e/s)对黑木耳多糖得率与abts
+
清除率的影响不存在差异,故体系ph值固定为4.8,加酶量(e/s)固定为8.0%。在其它3种单因素试验基础上,根据中心组合试验原理,采用design-expert.v8.0.6软件设计了三因素三水平响应面分析试验。响应面实验因素水平见表9,实验设计及结果见表10,回归模型的显著性分析及差异分析见表11与表12。
[0122]
表9纤维素酶提取黑木耳多糖的实验设计因素水平表
[0123]
编码水平a:料液比(g/ml)b:酶解时间(h)c:酶解温度(℃)-11/3014501/5035511/70565
[0124]
表10纤维素酶提取黑木耳多糖实验设计及及实验结果
[0125][0126][0127]
表11纤维素酶提取黑木耳多糖得率的回归模型分析
[0128]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel56.6896.305.420.0183
a-温度39.92139.9234.350.0006b-e/s0.9810.980.840.3890c-ph5.0715.074.360.0751ab0.6210.620.530.4901ac0.7410.740.640.4512bc0.3310.330.280.6103a20.06210.0620.0530.8244b20.1510.150.130.7262c28.7218.727.500.0290residual8.1471.16
ꢀꢀ
lack of fit6.3332.114.660.0855
[0129]
表12纤维素酶提取黑木耳多糖自由基清除率的回归模型分析
[0130]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel435.60948.404.250.0347a-温度57.08157.085.020.0601b-e/s36.68136.683.220.1156c-ph91.40191.408.030.0253ab0.5310.530.0460.8359ac6.6616.660.590.4693bc0.07810.0780.006890.9362a2110.151110.159.680.0170b246.40146.404.080.0832c296.11196.118.450.0228residual79.64711.38
ꢀꢀ
lack of fit61.12320.374.400.0931
[0131]
表11的分析表明,多糖得率结果经统计分析,模型p值为0.0183,说明模型显著。r2为0.8745,调整r2为0.7131,c.v值为7.67%,失拟项p值为0.0855不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序为x1>x3>x2。表12的分析表明,abts
+
清除率结果经统计分析,模型p值为0.0347,说明模型显著。r2为0.8454,调整r2为0.6467,c.v值为7.99%,失拟项p值为0.0931,不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序x3>x1>x2(x1、x2、x3分别代表料液比、时间、提取温度)。
[0132]
纤维素酶提取黑木耳多糖的得率与abts
+
清除率的响应面图见图8与图9。
[0133]
响应面优化最优条件为提取温度56.83℃、料液比1:57.76,时间3.08h条件下多糖溶出率可达15.4074%,abts
+
清除率为42.894%。结合实际实验室条件,最优调整为:温度55℃、时间3.0h、e/s 8%、ph 4.8、料液比1/60。为了进一步验证该模型与实际情况的有效性与准确性,按响应面试验优选出的提取条件进行3次平行实验,黑木耳多糖得率可以达到19.28%
±
1.055%,abts
+
清除率达44.62%
±
3.01%,与预测值一致,说明响应面分析方法可靠,与实际情况拟合较好,从而验证了回归方程的有效性。
[0134]
4.1.4 β-葡聚糖酶提取黑木耳多糖的单因素实验及响应面优化
[0135]
料液比、体系ph值与加酶量(e/s)对黑木耳多糖提取得率与abts
+
清除率的影响见图10。
[0136]
由于不同水平的酶解温度与酶解时间对黑木耳多糖得率与abts
+
清除率的影响不存在差异,故酶解温度固定为55℃,酶解时间固定为2h。在其它3种单因素试验基础上,根据中心组合试验原理,采用design-expert.v8.0.6软件设计了三因素三水平响应面分析试验。响应面实验因素水平见表13,实验设计及结果见表14,回归模型的显著性分析及差异分析见表15与表16。
[0137]
表13 β-葡聚糖酶提取黑木耳多糖的实验设计因素水平表
[0138]
编码水平a:料液比(g/ml)b:e/s(%)c:ph值-11/304.03.001/608.05.011/9012.07.0
[0139]
表14 β-葡聚糖酶提取黑木耳多糖实验设计及及实验结果
[0140] a:料液比(g/ml)b:e/s(%)c:ph值多糖得率(%)abts
+
清除率(%)1-1.000-1.0000.0008.3445.9621.000-1.0000.00018.0136.063-1.0001.0000.0009.2453.2641.0001.0000.00017.7741.445-1.0000.000-1.0007.8951.7061.0000.000-1.00013.4544.747-1.0000.0001.0008.7443.5381.0000.0001.00018.3935.3690.000-1.000-1.00014.9840.05100.0001.000-1.00016.6249.58110.000-1.0001.00010.8144.22120.0001.0001.00018.8339.18130.0000.0000.00012.5642.48140.0000.0000.00014.4942.14150.0000.0000.00015.3544.05160.0000.0000.00014.5245.06170.0000.0000.00014.6544.22
[0141]
表15 β-葡聚糖酶提取黑木耳多糖得率的回归模型分析
[0142]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel193.24921.476.210.0125a-温度139.591139.5940.380.0004b-e/s13.36113.363.860.0900c-ph1.8311.830.530.4906ab0.3210.320.0940.7683ac4.1914.191.210.3075
bc10.17110.172.940.1301a220.10120.105.810.0467b24.2714.271.240.3029c20.1910.190.0560.8203residual24.2073.46
ꢀꢀ
lack of fit18.7336.244.570.0882
[0143]
表16 β-葡聚糖酶提取黑木耳多糖自由基清除率的回归模型分析
[0144]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel333.47937.057.220.0081a-温度169.741169.7433.060.0007b-e/s36.85136.857.180.0316c-ph70.69170.6913.770.0075ab0.9210.920.180.6845ac0.3710.370.0710.7971bc53.07153.0710.340.0147a21.4311.430.280.6141b20.00023710.0002370.0000460.9948c20.4910.490.0950.7671residual35.9375.13
ꢀꢀ
lack of fit29.8339.946.520.0509
[0145]
表15的分析表明,多糖得率结果经统计分析,模型p值为0.0125,说明模型显著。r2为0.8887,调整r2为0.7456,c.v值为13.41%,失拟项p值为0.0882不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序为x1>x2>x3。表16的分析表明,abts
+
清除率结果经统计分析,模型p值为0.0081,说明模型显著。r2为0.9027,调整r2为0.7777,c.v值为5.18%,失拟项p值为0.0509,不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序x1>x3>x2(x1、x2、x3分别代表料液比、e/s、ph)。
[0146]
β-葡聚糖酶提取黑木耳多糖的得率与abts
+
清除率的响应面图见图11与图12。
[0147]
响应面优化最优条件为料液比1:61.97、ph值3.53、加酶量12.0%条件下多糖溶出率可达15.378%,abts
+
清除率为50.095%。结合实际实验室条件,最优调整为:温度50℃、时间2h、e/s 12.0%、ph 4.0、料液比1:60。为了进一步验证该模型与实际情况的有效性与准确性,按响应面试验优选出的提取条件进行3次平行实验,黑木耳多糖得率可以达到14.20%
±
0.3262%,abts
+
清除率达50.24%
±
3.42%,与预测值一致,说明响应面分析方法可靠,与实际情况拟合较好,从而验证了回归方程的有效性。
[0148]
4.1.5中性蛋白酶提取黑木耳多糖的单因素实验及响应面优化
[0149]
料液比、酶解温度与体系ph值对黑木耳多糖提取得率与abts
+
清除率的影响见图13。
[0150]
由于不同水平的加酶量与酶解时间对黑木耳多糖得率与abts
+
清除率的影响不存在差异,故加酶量固定为8.0%,酶解时间固定为2h。在其它3种单因素试验基础上,根据中心组合试验原理,采用design-expert.v8.0.6软件设计了三因素三水平响应面分析试验。
响应面实验因素水平见表17,实验设计及结果见表18,回归模型的显著性分析及差异分析见表19与表20。
[0151]
表17中性蛋白酶提取黑木耳多糖的实验设计因素水平表
[0152]
编码水平a:酶解温度(℃)b:料液比(g/ml)c:ph-130℃1/505.0050℃1/707.0170℃1/909.0
[0153]
表18中性蛋白酶提取黑木耳多糖实验设计及及实验结果
[0154][0155][0156]
表19中性蛋白酶提取黑木耳多糖得率的回归模型分析
[0157]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel72.1598.0211.820.0018a-温度2.9312.934.320.0764b-e/s52.74152.7477.73<0.0001c-ph0.6710.670.990.3525ab2.5912.593.820.0915ac0.1810.180.260.6258bc1.1711.171.720.2312a26.7016.709.870.0163b20.4210.420.610.4597c24.4314.436.530.0378residual4.7570.68
ꢀꢀ
lack of fit0.3930.130.120.9431
[0158]
表20中性蛋白酶提取黑木耳多糖自由基清除率的回归模型分析
[0159]
sourcesum of squaresdfmean squaref valuep-value prob>fmodel485.76953.9710.820.0024a-温度18.54118.543.720.0952b-e/s164.891164.8933.060.0007
c-ph5.8115.811.170.3161ab2.3912.390.480.5114ac2.0912.090.420.5383bc17.94117.943.600.0998a2233.681233.6846.850.0002b24.2114.210.840.3889c222.08122.084.430.0735residual34.9274.99
ꢀꢀ
lack of fit13.2534.420.820.5485
[0160]
表19的分析表明,多糖得率结果经统计分析,模型p值为0.0018,说明模型显著。r2为0.9382,调整r2为0.8588,c.v值为6.92%,失拟项p值为0.9431不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序为x2>x1>x3。表20的分析表明,abts
+
清除率结果经统计分析,模型p值为0.0024,说明模型显著。r2为0.9329,调整r2为0.8467,c.v值为3.50%,失拟项p值为0.5485,不显著。表明实验方法可靠,模型达到很好的拟合。根据f值可知,试验因素影响多糖得率的顺序x2>x1>x3(x1、x2、x3分别代表温度、料液比、ph)。
[0161]
中性蛋白酶提取黑木耳多糖的得率与abts
+
清除率的响应面图见图14与图15。
[0162]
响应面优化最优条件为酶解温度48.59℃、料液比74.71、ph值9.0条件下多糖溶出率可达12.963%,abts
+
清除率为65.921%。结合实际实验室条件,最优调整为:温度50℃、料液比75、ph 9.0、时间2h、e/s 12.0%。为了进一步验证该模型与实际情况的有效性与准确性,按响应面试验优选出的提取条件进行3次平行实验,黑木耳多糖得率可以达到14.19%
±
2.22%,abts
+
清除率达68.31%
±
2.76%,与预测值一致,说明响应面分析方法可靠,与实际情况拟合较好,从而验证了回归方程的有效性。
[0163]
综合上述实验结果,5种生物酶的最优提取工艺参数如下:
[0164]
甘露聚糖酶:温度70℃、时间2.0h、e/s 3.0%、ph 2.8、料液比1g/80ml;
[0165]
木瓜蛋白酶:温度53℃、时间3.0h、e/s 12.0%、ph 5.3、料液比1g/60ml;
[0166]
纤维素酶:温度55℃、时间3.0h、e/s 8.0%、ph 4.8、料液比1g/60ml;
[0167]
β-葡聚糖酶:温度55℃、时间2.0h、e/s 12.0%、ph 4.0、料液比1g/60ml;
[0168]
中性蛋白酶:温度50℃、时间2.0h、e/s 8.0%、ph 9.0、料液比1g/75ml。
[0169]
4.2扫描电镜(sem)观察黑木耳细胞壁表面特征
[0170]
黑木耳子实体、热水浸提物以及5种酶在最优提取条件下提取的黑木耳料渣的sem图像见图16。黑木耳子实体胞壁及菌丝体完好;热水浸提料渣菌丝体表面有轻微破裂。甘露聚糖酶很难观察到完整菌丝体,推测是较低ph与较高温度组合加剧了酶作用的剧烈程度。中性蛋白酶提取菌丝体清晰可见,推测该酶处理过程较为温和,多糖从表面微小的蛋白裂口中溶出。β-葡聚糖酶处理料渣电镜下的颗粒状物质为溶出多糖在前处理过程中结块所致,该酶反应条件温和,相比与木瓜蛋白酶等得率较低,菌丝体也保持了较好的完整性。纤维素酶以及木瓜蛋白酶得率均接近于20%,下图中其菌丝体破碎开口清晰可见,破壁彻底,与得率结果吻合。
[0171]
4.3五种酶法制备的黑木耳多糖的体外抗氧化效果对比
[0172]
5种生物酶法在最优条件下制备的多糖,abts
+
清除率、dpph自由基清除率与过氧化氢清除率见下表21。
[0173]
表21几种黑木耳多糖的体外抗氧化效果
[0174] abts
+
清除率(%)dpph自由基清除率(%)过氧化氢清除率(%)水提多糖67.25
±
1.0628.91
±
0.8414.92
±
0.31甘露聚糖酶提多糖51.07
±
1.2126.08
±
1.0523.01
±
0.68木瓜蛋白酶提多糖80.15
±
2.0391.65
±
1.6930.06
±
0.71纤维素酶提多糖95.16
±
2.3791.06
±
2.0356.32
±
1.02β-葡聚糖酶提多糖88.24
±
1.7280.37
±
1.1634.26
±
1.23中性蛋白酶提多糖87.13
±
1.3659.17
±
2.0630.32
±
0.63vc对照95.61
±
1.8190.74
±
0.8677.24
±
1.14
[0175]
表21表明,除甘露聚糖酶提多糖,其它酶法制备的黑木耳多糖,对abts
+
、dpph自由基与过氧化氢的清除率均优于水提多糖。另外4种酶提多糖中,纤维素酶提多糖的抗氧化效果最优,木瓜蛋白酶提多糖与β-葡聚糖酶提多糖的抗氧化效果也较优,中性蛋白酶提多糖对dpph自由基清除率相对弱。以下选取纤维素酶提多糖、木瓜蛋白酶提多糖与β-葡聚糖酶提多糖,进一步检测其对秀丽隐杆线虫抗氧化应激、线虫体内抗氧化物酶的酶活以及线虫体内脂肪的影响。
[0176]
4.4三种酶法制备的黑木耳多糖体内生物活性对比
[0177]
4.4.1三种酶法制备的黑木耳多糖的抗氧化应激效果
[0178]
纤维素酶提取多糖、木瓜蛋白酶提取多糖与β-葡聚糖酶提取多糖对线虫抗甲基紫精氧化应激的效果见下表22。
[0179]
表22三种酶法制备的黑木耳多糖对线虫抗甲基紫精氧化应激的效果
[0180][0181][0182]
注:同一时间(即同一行)各组间存在显著差异时用不同字母表示(p<0.05);各组间没有差异用相同字母表示(p>0.05)
[0183]
氧化应激指体内的氧化系统与抗氧化水平失衡,体内氧自由基生成过多无法被清除,导致机体过度氧化而造成组织功能损害的一类反应。大量研究证明,氧化应激是临床上肿瘤、糖尿病、衰老等多种疾病的主要发病原因。由表22,83.33mg/ml甲基紫精氧化应激下,与m9对照组相比,各多糖组的线虫寿命均延长。与m9组相比,木瓜蛋白酶提多糖除120、160、200、320min外,其余各时间段均可使线虫寿命显著延长(p<0.05);β-葡聚糖酶提多糖可显
著延长80、240、280及360min以后的存活时间(p<0.05);纤维素酶提多糖具有较好的抗氧化应激作用,能显著延长蠕虫从240min到实验结束(560min)的存活时间(p<0.05)。同时,纤维素酶提多糖对延长甲基紫精胁迫下线虫存活时间的作用不低于vc。上述实验表明3种酶法制备的多糖均具有较好地抗氧化应激的作用。
[0184]
4.4.2三种酶法制备的黑木耳多糖对线虫体内抗氧化物酶活的影响效果
[0185]
纤维素酶提多糖、木瓜蛋白酶提多糖与β-葡聚糖酶提多糖对线虫体内抗氧化物酶(sod与cat)酶活的影响效果见图17。
[0186]
超氧化物是自由基产生的主要来源,而sod是对抗细胞呼吸过程中线粒体产生的超氧化物自由基和其他细胞来源如nadph氧化酶产生的超氧化物的一种重要的酶,可将高活性的超氧自由基转化为过氧化氢,因此,sod在细胞抵抗氧化损伤的第一防线起着重要作用。cat作为细胞内的抗氧化酶,在保护机体免受自由基损伤方面起着至关重要的作用。sod能将超氧自由基转化为过氧化氢,cat则使过氧化氢分解为h2o和o2,与sod共同构成完整的抗氧化链,从而达到保护机体的目的。由图17可知,与阴性对照组(m9)比较,纤维素酶提多糖、木瓜蛋白酶提多糖与β-葡聚糖酶提多糖均可显著提高线虫体内sod酶活(p<0.01),且这3种多糖组线虫体内的sod酶活均高于阳性对照组(vc),但木瓜蛋白酶提多糖组的sod活性与阳性对照无显著差异,纤维素酶提多糖组与β-葡聚糖酶提多糖组的sod活性显著高于阳性对照组(p<0.05)。与阴性对照组(m9)比较,纤维素酶提多糖、木瓜蛋白酶提多糖与β-葡聚糖酶提多糖均可显著提高线虫体内cat酶活(p<0.01),且这3种多糖组线虫体内的cat酶活均显著高于阳性对照组(p<0.05);说明3种酶法制备的黑木耳多糖均具有较好地提高线虫体内抗氧化物酶酶活的效果。
[0187]
4.4.2三种酶法制备的黑木耳多糖对线虫体内脂肪的影响效果
[0188]
纤维素酶提多糖、木瓜蛋白酶提多糖与β-葡聚糖酶提多糖对线虫体内甘油三脂的影响见表23。
[0189]
表23三种酶法制备的黑木耳多糖对线虫体内甘油三脂的影响
[0190][0191]
注:各组间存在显著差异时用不同字母表示(p<0.05);各组间没有差异用相同字母表示(p>0.05)
[0192]
线虫在含有葡萄糖培养基的高糖环境下生长时,其体内甘油三酯含量明显升高。由表23可知,线虫高糖环境下培养后,阴性对照组线虫体内甘油三酯的含量与正常线虫比较显著升高,不同生物酶提多糖均有不同程度降低线虫体内甘油三酯的效果,其中纤维素酶提多糖与β-葡聚糖酶提多糖可以显著降低甘油三酯含量(p<0.05),表明其对线虫体内脂质的积累有所缓解。
[0193]
4.5黑木耳多糖酶法制备工艺的确定
[0194]
综合4.1的最优提取工艺参数、4.2的体外抗氧化效果、4.3的细胞壁的破壁程度的实验结果,优选纤维素酶、木瓜蛋白酶与β-葡聚糖酶三种酶制备黑木耳多糖,制备方法如下:黑木耳先经预处理(粉碎、过150~200目筛、3次冻融循环),先将纤维素酶与木瓜蛋白酶
按最佳的加酶量的一半加入预处理后的黑木耳中,然后在作用温度55℃、ph 5.3、料液比1g/60ml条件下作用3.0h,对黑木耳细胞壁进行充分有效破壁;进而将体系ph调至4.0,按e/s 6.0%加入作用温和的β-葡聚糖酶在其它条件保持不变的条件下作用2h。
[0195]
实施例2
[0196]
黑木耳预处理:取10g黑木耳粉(过150~200目筛)加入600ml去离子水中,25℃溶胀12h,然后在-20℃冰箱中冷冻60min,20℃恒温水浴锅中解冻,进行3次冻融循环预处理,再冷冻干燥(初始温度为-30℃,真空度为80pa)后,得到预处理后的黑木耳粉10g。
[0197]
黑木耳多糖提取:取预处理后的黑木耳粉10g,加入600ml去离子水,再加入0.4g纤维素酶与0.6g木瓜蛋白酶(即按最佳的加酶量的一半),然后在作用温度55℃、ph 5.3、料液比1g/60ml条件下作用3.0h,对黑木耳细胞壁进行充分有效破壁;按e/s 6.0%加入作用温和的β-葡聚糖酶0.6g,在其它条件保持不变的条件下(55℃、ph 5.3)作用2h。然后加热至沸15min灭酶,8000rpm离心20min,取上清液,加入4倍体积的95%乙醇,4℃静置10h后,3000rpm离心10min,取沉淀,溶解于600ml去离子水中后,采用sevag法脱蛋白,具体为:沉淀去离子水溶液置于分液漏斗中,加入sevag试剂(氯仿:正丁醇=4:1,v:v)15ml,上下剧烈振荡2min后,置于铁架台上静置至上下分层,取上层,在280nm处检测是否有吸收峰,继续用sevag试剂洗脱至上层在280nm没有吸收峰,将上层浓缩至体积为200ml,获得黑木耳多糖液,冷冻干燥(初始温度为-30℃,真空度为80pa),获得黑木耳多糖3.43g。
[0198]
采用实施例1中3.2的检测方法,黑木耳多糖得率平均值为36.43%;采用实施例1中3.5的检测方法,黑木耳多糖对abts
+
清除率为98.32%、dpph自由基清除率为92.74%,过氧化氢清除率为66.56%;采用实施例1中3.6的检测方法,黑木耳多糖可使甲基紫精胁迫下线虫存活时间延长至600min,sod活力与cat活力分别达81.7u/mgprot与22.6u/mgprot,甘油三酯含量降至3.53mmol/l,且均与阴性对照组比较差异显著(p<0.05)。
[0199]
比较例1
[0200]
将10g黑木耳粉(150-200目筛),按料液比1g:60ml加入去离子水600ml,25℃溶胀12h,然后在-20℃冰箱中冷冻60min,20℃恒温水浴锅中解冻,进行3次冻融循环预处理,再冷冻干燥(初始温度为-30℃,真空度为80pa)后,得到预处理后的黑木耳粉10g。
[0201]
预处理后的黑木耳粉10g加入去离子水600ml,在80℃条件下提取4h,离心(8000rpm,20min),取上清液,加入4倍体积的95%乙醇,4℃静置过夜后,3000rpm离心10min,取沉淀,溶解于60ml去离子水中后,采用实施例2sevag法脱蛋白至280nm没有吸收峰,浓缩至体积为20ml后,冷冻干燥(初始温度为-30℃,真空度为80pa),获得水提法黑木耳多糖0.389g,多糖得率、体外抗氧化性与体内生物活性分析测试同实施例1,结果见表24。
[0202]
表24不同处理提取黑木耳多糖的得率及体内外生物活性指标
[0203]
[0204][0205]
由表24可知,黑木耳多糖的提取工艺对多糖的提取得率及体外抗氧化性影响很大,纤维素酶复合木瓜蛋白酶+β-葡聚糖酶的提取方式可使黑木耳多糖的提取得率、体外抗氧化性与体内生物活性明显提高,其中提取得率与体外抗氧化性比传统的采用热水提取的黑木耳多糖分别提高了9.36倍、1.27倍、2.38倍、2.67倍;甲基紫精胁迫下线虫存活时间比传统的采用热水提取的黑木耳多糖增加了120min,sod与cat分别比传统的采用热水提取的黑木耳多糖提高了2.51倍与3.10倍,甘油三酯比传统的采用热水提取的黑木耳多糖降低了1.50倍。
[0206]
比较例2
[0207]
将实施例2中,黑木耳粉改为过40目筛,其他操作同实施例2,黑木耳多糖的提取得率、体外抗氧化性与体内生物活性指标见表25。
[0208]
表25不同处理提取黑木耳多糖的得率及体内外生物活性指标
[0209][0210]
由表25可知,黑木耳预处理工艺对多糖的提取得率及体内外生物活性均有一定影响,粉碎后过150-200目筛的预处理方式可使黑木耳多糖的提取得率及体外抗氧化性提高,比传统的机械粉碎的粗粉提取的黑木耳多糖分别提高了1.39倍、1.03倍、1.06倍、1.11倍;甲基紫精胁迫下线虫存活时间比机械粉碎粗粉提取的黑木耳多糖增加了120min,sod与cat分别比机械粉碎粗粉提取的黑木耳多糖提高了1.28倍与1.30倍,甘油三酯比机械粉碎粗粉提取的黑木耳多糖降低了1.44倍。
[0211]
比较例3
[0212]
将实施例2黑木耳预处理改为:取10g黑木耳粉(过150~200目筛)溶解于600ml去离子水中,溶胀12h,不经反复冻融处理,其他同实施例2,黑木耳多糖的提取得率、体外抗氧化性与体内生物活性指标见表26。
[0213]
表26不同处理提取黑木耳多糖的得率及体内外生物活性指标
[0214][0215][0216]
由表26可知,黑木耳预处理工艺对多糖的提取得率及体内外生物活性均有一定影响,粉碎过150-200目筛后,经3次冻融循环的预处理方式可使黑木耳多糖的提取得率及体外抗氧化性提高,比不经反复冻融提取的黑木耳多糖分别提高了1.31倍、1.04倍、1.13倍、1.10倍;甲基紫精胁迫下线虫存活时间比不经反复冻融提取的黑木耳多糖增加了40min,sod与cat分别比不经反复冻融提取的黑木耳多糖提高了1.05倍与1.17倍,甘油三酯比不经反复冻融提取的黑木耳多糖降低了1.21倍。
[0217]
比较例4
[0218]
将10g黑木耳粉(同实施例2)采用实施例2方法预处理后,同时加入0.4g纤维素酶、0.6g木瓜蛋白酶与0.6gβ-葡聚糖酶;木瓜蛋白酶与β-葡聚糖酶的加酶量为6.0%,纤维素酶加酶量为4.0%,然后在作用温度(55℃)、最佳ph 5.3、最佳料液比1/60条件下作用3.0h。采用实施例1方法检测黑木耳多糖的提取得率、体外抗氧化性与体内生物活性指标,见表27。
[0219]
表27不同处理提取黑木耳多糖的得率及体内外生物活性指标
[0220][0221]
由表27可知,黑木耳多糖的提取工艺对多糖的提取得率及体内外生物活性均有一定影响,纤维素酶复合木瓜蛋白酶+β-葡聚糖酶的提取方式可使黑木耳多糖的提取得率及体外抗氧化性明显提高,比三种酶复合同时提取黑木耳多糖分别提高了1.21倍、1.06倍、1.03倍、1.07倍;甲基紫精胁迫下线虫存活时间比三种酶复合同时提取的黑木耳多糖增加了40min,sod与cat分别比三种酶复合同时提取的黑木耳多糖提高了1.04倍与1.15倍,甘油三酯比三种酶复合同时提取的黑木耳多糖降低了1.12倍。
[0222]
比较例5
[0223]
实施例2方法预处理后的黑木耳粉10g,加入去离子水600ml,再加入0.4g纤维素酶,在55℃、ph4.8条件下提取3h;然后加入0.6g木瓜蛋白酶,在53℃、ph5.3条件下提取3h;最后加入0.6gβ-葡聚糖酶,在55℃、ph4.0条件下提取2h。采用实施例1方法检测黑木耳多糖的提取得率、体外抗氧化性与体内生物活性指标,见表28。
[0224]
表28不同处理提取黑木耳多糖的得率及体内外生物活性指标
[0225][0226][0227]
由表28可知,黑木耳多糖的提取工艺对多糖的提取得率及体外抗氧化性有一定影响,纤维素酶复合木瓜蛋白酶+β-葡聚糖酶的提取方式可使黑木耳多糖的提取得率及体外抗氧化性明显提高,比三种酶依次提取黑木耳多糖分别提高了1.26倍、1.09倍、1.14倍、1.27倍;甲基紫精胁迫下线虫存活时间比三种酶依次提取的黑木耳多糖增加了80min,sod与cat分别比三种酶依次提取的黑木耳多糖提高了1.16倍与1.43倍,甘油三酯比三种酶依次提取的黑木耳多糖降低了1.04倍。
[0228]
实施例3
[0229]
准确称取20g黑木耳粉(150~200目筛)溶解于560ml去离子水中,溶胀16h,然后在-20℃冰箱中冷冻50min,20℃恒温水浴锅中解冻,进行4次冻融循环,然后冷冻干燥(初始温度为-30℃,真空度为80pa)后,得到预处理后的黑木耳粉20g。
[0230]
预处理后的黑木耳粉20g,加入0.8g纤维素酶与1.2g木瓜蛋白酶(即按最佳的加酶量的一半)和1200ml去离子水,然后在作用温度45℃、ph 4.0、料液比1/60条件下作用1.0h,对黑木耳细胞壁进行充分有效破壁;然后按e/s 4.0%加入作用温和的β-葡聚糖酶0.8g,在45℃、ph 4.0的条件下作用2h。同实施例2方法制备黑木耳多糖6.54g,多糖得率平均值为35.06%,abts
+
清除率为97.12%、dpph自由基清除率为91.23%,过氧化氢清除率为65.39%;黑木耳多糖可使甲基紫精胁迫下线虫存活时间延长至600min,sod活力与cat活力分别达80.3u/mgprot与20.7u/mgprot,甘油三酯含量降至3.71mmol/l。
[0231]
实施例4
[0232]
准确称取20g黑木耳粉(150~200目筛)溶解于640ml去离子水中,溶胀8h,然后在-20℃冰箱中冷冻70min,20℃恒温水浴锅中解冻,进行4次冻融循环,然后冷冻干燥(初始温度为-30℃,真空度为80pa)后,得到预处理后的黑木耳粉20g。
[0233]
预处理后的黑木耳粉20g,加入0.8g纤维素酶与1.2g木瓜蛋白酶(即按最佳的加酶
量的一半)和1200ml去离子水,然后在作用温度60℃、ph 6.0、料液比1/60条件下作用5.0h,对黑木耳细胞壁进行充分有效破壁;然后按e/s 4.0%加入作用温和的β-葡聚糖酶0.8g,在60℃、ph 6.0的条件下作用2h。同实施例2方法制备黑木耳多糖6.70g,多糖得率平均值为35.63%,abts
+
清除率为97.43%、dpph自由基清除率为91.78%,过氧化氢清除率为65.12%;黑木耳多糖可使甲基紫精胁迫下线虫存活时间延长至560min,sod活力与cat活力分别达81.1u/mgprot与21.3u/mgprot,甘油三酯含量降至3.66mmol/l。
[0234]
实施例5
[0235]
准确称取20g黑木耳粉(150~200目筛)溶解于600ml去离子水中,溶胀10h,然后在-20℃冰箱中冷冻70min,20℃恒温水浴锅中解冻,进行2次冻融循环,然后冷冻干燥(初始温度为-30℃,真空度为80pa)后,得到预处理后的黑木耳粉20g。
[0236]
预处理后的黑木耳粉20g,加入0.8g纤维素酶与1.2g木瓜蛋白酶(按最佳的加酶量的一半)和1200ml去离子水,然后在作用温度50℃、ph 5.0、料液比1/60条件下作用3.0h,对黑木耳细胞壁进行充分有效破壁;然后按e/s 5.0%加入作用温和的β-葡聚糖酶1.0g,在50℃、ph 5.0的条件下作用2h。同实施例2方法制备的黑木耳多糖6.62g,多糖得率平均值为35.11%,abts
+
清除率为98.03%、dpph自由基清除率为91.97%,过氧化氢清除率为65.88%;黑木耳多糖可使甲基紫精胁迫下线虫存活时间延长至600min,sod活力与cat活力分别达80.7u/mgprot与20.1u/mgprot,甘油三酯含量降至3.59mmol/l。
[0237]
实施例6
[0238]
准确称取20g黑木耳粉(150~200目筛)溶解于600ml去离子水中,溶胀10h,然后在-20℃冰箱中冷冻70min,20℃恒温水浴锅中解冻,进行3次冻融循环,然后冷冻干燥(初始温度为-30℃,真空度为80pa)后,得到预处理后的黑木耳粉20g。
[0239]
预处理后的黑木耳粉20g,加入0.8g纤维素酶与1.2g木瓜蛋白酶(按最佳的加酶量的一半)和1200ml去离子水,然后在作用温度50℃、ph 5.0、料液比1/60条件下作用3.0h,对黑木耳细胞壁进行充分有效破壁;然后按e/s 1.5%加入甘露聚糖酶0.3g,在70℃、ph 2.8的条件下作用2h。同实施例2方法制备的黑木耳多糖5.44g,多糖得率平均值为29.87%,abts
+
清除率为96.27%、dpph自由基清除率为90.12%,过氧化氢清除率为61.21%;黑木耳多糖可使甲基紫精胁迫下线虫存活时间延长至560min,sod活力与cat活力分别达80.0u/mgprot与20.2u/mgprot,甘油三酯含量降至3.65mmol/l。
[0240]
实施例7
[0241]
准确称取20g黑木耳粉(150~200目筛)溶解于600ml去离子水中,溶胀10h,然后在-20℃冰箱中冷冻70min,20℃恒温水浴锅中解冻,进行3次冻融循环,然后冷冻干燥(初始温度为-30℃,真空度为80pa)后,得到预处理后的黑木耳粉20g。
[0242]
预处理后的黑木耳粉20g,加入0.8g纤维素酶与1.2g木瓜蛋白酶(按最佳的加酶量的一半)和1200ml去离子水,然后在作用温度50℃、ph 5.0、料液比1/60条件下作用3.0h,对黑木耳细胞壁进行充分有效破壁;然后按e/s 4.0%加入中性蛋白酶0.8g,在50℃、ph 9.0的条件下作用2h。同实施例2方法制备的黑木耳多糖5.85g,多糖得率平均值为31.25%,abts
+
清除率为96.01%、dpph自由基清除率为92.46%,过氧化氢清除率为62.17%;黑木耳多糖可使甲基紫精胁迫下线虫存活时间延长至560min,sod活力与cat活力分别达81.3u/mgprot与20.6u/mgprot,甘油三酯含量降至3.61mmol/l。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



