一种谷氨酸脱氢酶突变体及其应用的制作方法
 2021-02-02 02:02:47|
2021-02-02 02:02:47| 438|
438| 起点商标网
起点商标网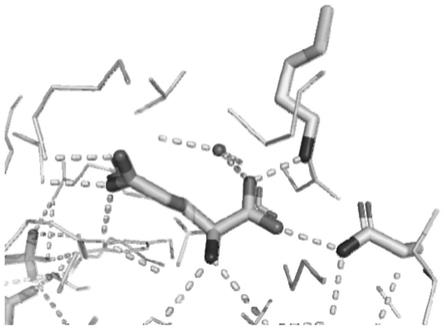
[0001]
本发明涉及一种谷氨酸脱氢酶突变体及其应用,属于酶工程和微生物工程技术领域。
背景技术:
[0002]
sacubitrii是抗心衰药物entrento的一个有效成分药物,一脑啡肽酶抑制剂,它和缬沙坦,血管紧张素ⅱ受体阻断剂组成的复方制剂,用以减少风险心力衰竭患者的心血管死亡及住院治疗慢性心力衰竭(nyhaii-iv级)和射血分数降低。光学纯的(r)-4-氨基戊酸是化合物sacubitril的手性砌块;此外(r)-4-氨基戊酸本身是一种γ-氨基酸,可用于合成具有生理活性或特殊结构杂交肽的研究;这使得(r)-4-氨基戊酸具有重要的应用价值。利用工程谷氨酸脱氢酶对4-氧代戊酸进行不对称还原胺化是生产(r)-4-氨基戊酸具潜力的绿色反应。谷氨酸脱氢酶只消耗廉价的还原剂即可一步催化4-氧代戊酸生成(r)-4-氨基戊酸,其副产物仅为水,其产物的ee值达到95%以上。
[0003]
到目前为止,还尚未看到(r)-4-氨基戊酸的生物合成途径报道。在化学法合成中,往往存在过程繁琐,产物光学纯度低的问题。因此,急需找到一种高效的生物法合成(r)-4-氨基戊酸的方法。
技术实现要素:
[0004]
为解决上述技术问题,本发明提供了一种谷氨酸脱氢酶突变体,所述突变体为以下(1)-(9)任一:
[0005]
(1)将出发氨基酸序列如seq id no.1所示的谷氨酸脱氢酶的第116位氨基酸赖氨酸及第348位氨基酸天冬酰胺进行突变得到的;
[0006]
(2)将出发氨基酸序列如seq id no.2所示的谷氨酸脱氢酶的第114位氨基酸赖氨酸及第348位氨基酸天冬酰胺进行突变得到的;
[0007]
(3)将出发氨基酸序列如seq id no.3所示的谷氨酸脱氢酶的第114位氨基酸赖氨酸及第349位氨基酸天冬酰胺进行突变得到的;
[0008]
(4)将出发氨基酸序列如seq id no.4所示的谷氨酸脱氢酶的第112位氨基酸赖氨酸及第344位氨基酸天冬酰胺进行突变得到的;
[0009]
(5)将出发氨基酸序列如seq id no.5所示的谷氨酸脱氢酶的第104位氨基酸赖氨酸及第326位氨基酸天冬酰胺进行突变得到的;
[0010]
(6)将出发氨基酸序列如seq id no.6所示的谷氨酸脱氢酶的第102位氨基酸赖氨酸及第338位氨基酸天冬酰胺进行突变得到的;
[0011]
(7)将出发氨基酸序列如seq id no.7所示的谷氨酸脱氢酶的第101位氨基酸赖氨酸及第340位氨基酸天冬酰胺进行突变得到的;
[0012]
(8)将出发氨基酸序列如seq id no.8所示的谷氨酸脱氢酶的第102位氨基酸赖氨酸及第346位氨基酸天冬酰胺进行突变得到的;
[0013]
(9)将出发氨基酸序列如seq id no.9所示的谷氨酸脱氢酶的第113位氨基酸赖氨酸及第349位氨基酸天冬酰胺进行突变得到的。
[0014]
在本发明的一种实施方式中,所述突变体为以下(1)-(9)任一:
[0015]
(1)将出发氨基酸序列如seq id no.1所示的谷氨酸脱氢酶的第116位氨基酸由赖氨酸突变为丝氨酸,并将第348位氨基酸由天冬酰胺突变为亮氨酸,命名为k116s/n348l;
[0016]
或将出发氨基酸序列如seq id no.1所示的谷氨酸脱氢酶的第116位氨基酸由赖氨酸突变为谷氨酸,并将第348位氨基酸由天冬酰胺突变为蛋氨酸,命名为k116e/n348m;
[0017]
或将出发氨基酸序列如seq id no.1所示的谷氨酸脱氢酶的第116位氨基酸由赖氨酸突变为谷氨酰胺,并将第348位氨基酸由天冬酰胺突变为蛋氨酸,命名为k116q/n348m;
[0018]
(2)将出发氨基酸序列如seq id no.2所示的谷氨酸脱氢酶的第114位氨基酸由赖氨酸突变为丝氨酸,并将第348位氨基酸由天冬酰胺突变为亮氨酸,命名为k114s/n348l;
[0019]
或将出发氨基酸序列如seq id no.2所示的谷氨酸脱氢酶的第114位氨基酸由赖氨酸突变为谷氨酸,并将第348位氨基酸由天冬酰胺突变为蛋氨酸,命名为k114e/n348m;
[0020]
或将出发氨基酸序列如seq id no.2所示的谷氨酸脱氢酶的第114位氨基酸由赖氨酸突变为谷氨酰胺,并将第348位氨基酸由天冬酰胺突变为蛋氨酸,命名为k116q/n348m;
[0021]
(3)将出发氨基酸序列如seq id no.3所示的谷氨酸脱氢酶的第114位氨基酸由赖氨酸突变为丝氨酸,并将第349位氨基酸由天冬酰胺突变为亮氨酸,命名为k114s/n349l;
[0022]
或将出发氨基酸序列如seq id no.3所示的谷氨酸脱氢酶的第114位氨基酸由赖氨酸突变为谷氨酸,并将第349位氨基酸由天冬酰胺突变为蛋氨酸,命名为k114e/n349m;
[0023]
或将出发氨基酸序列如seq id no.3所示的谷氨酸脱氢酶的第114位氨基酸由赖氨酸突变为谷氨酰胺,并将第349位氨基酸由天冬酰胺突变为蛋氨酸,命名为k116q/n349m;
[0024]
(4)将出发氨基酸序列如seq id no.4所示的谷氨酸脱氢酶的第112位氨基酸由赖氨酸突变为丝氨酸,并将第344位氨基酸由天冬酰胺突变为亮氨酸,命名为k112s/n344l;
[0025]
或将出发氨基酸序列如seq id no.4所示的谷氨酸脱氢酶的第112位氨基酸由赖氨酸突变为谷氨酸,并将第344位氨基酸由天冬酰胺突变为蛋氨酸,命名为k112e/n344m;
[0026]
或将出发氨基酸序列如seq id no.4所示的谷氨酸脱氢酶的第112位氨基酸由赖氨酸突变为谷氨酰胺,并将第344位氨基酸由天冬酰胺突变为蛋氨酸,命名为k112q/n344m;
[0027]
(5)将出发氨基酸序列如seq id no.5所示的谷氨酸脱氢酶的第104位氨基酸由赖氨酸突变为丝氨酸,并将第326位氨基酸由天冬酰胺突变为亮氨酸,命名为k104s/n326l;
[0028]
或将出发氨基酸序列如seq id no.5所示的谷氨酸脱氢酶的第104位氨基酸由赖氨酸突变为谷氨酸,并将第326位氨基酸由天冬酰胺突变为蛋氨酸,命名为k104e/n326m;
[0029]
或将出发氨基酸序列如seq id no.5所示的谷氨酸脱氢酶的第104位氨基酸由赖氨酸突变为谷氨酰胺,并将第326位氨基酸由天冬酰胺突变为蛋氨酸,命名为k104q/n326m;
[0030]
(6)将出发氨基酸序列如seq id no.6所示的谷氨酸脱氢酶的第102位氨基酸由赖氨酸突变为丝氨酸,并将第338位氨基酸由天冬酰胺突变为亮氨酸,命名为k102s/n338l;
[0031]
或将出发氨基酸序列如seq id no.6所示的谷氨酸脱氢酶的第102位氨基酸由赖氨酸突变为谷氨酸,并将第338位氨基酸由天冬酰胺突变为蛋氨酸,命名为k102e/n338m;
[0032]
或将出发氨基酸序列如seq id no.6所示的谷氨酸脱氢酶的第102位氨基酸由赖氨酸突变为谷氨酰胺,并将第338位氨基酸由天冬酰胺突变为蛋氨酸,命名为k102q/n338m;
[0033]
(7)将出发氨基酸序列如seq id no.7所示的谷氨酸脱氢酶的第101位氨基酸由赖氨酸突变为丝氨酸,并将第340位氨基酸由天冬酰胺突变为亮氨酸,命名为k101s/n340l;
[0034]
或将出发氨基酸序列如seq id no.7所示的谷氨酸脱氢酶的第101位氨基酸由赖氨酸突变为谷氨酸,并将第340位氨基酸由天冬酰胺突变为蛋氨酸,命名为k101e/n340m;
[0035]
或将出发氨基酸序列如seq id no.7所示的谷氨酸脱氢酶的第101位氨基酸由赖氨酸突变为谷氨酰胺,并将第340位氨基酸由天冬酰胺突变为蛋氨酸,命名为k101q/n340m;
[0036]
(8)将出发氨基酸序列如seq id no.8所示的谷氨酸脱氢酶的第102位氨基酸由赖氨酸突变为丝氨酸,并将第346位氨基酸由天冬酰胺突变为亮氨酸,命名为k102s/n346l;
[0037]
或将出发氨基酸序列如seq id no.8所示的谷氨酸脱氢酶的第102位氨基酸由赖氨酸突变为谷氨酸,并将第346位氨基酸由天冬酰胺突变为蛋氨酸,命名为k102e/n346m;
[0038]
或将出发氨基酸序列如seq id no.8所示的谷氨酸脱氢酶的第102位氨基酸由赖氨酸突变为谷氨酰胺,并将第346位氨基酸由天冬酰胺突变为蛋氨酸,命名为k102q/n346m;
[0039]
(9)将出发氨基酸序列如seq id no.9所示的谷氨酸脱氢酶的第113位氨基酸由赖氨酸突变为丝氨酸,并将第349位氨基酸由天冬酰胺突变为亮氨酸,命名为k113s/n349l;
[0040]
或将出发氨基酸序列如seq id no.9所示的谷氨酸脱氢酶的第113位氨基酸由赖氨酸突变为谷氨酸,并将第349位氨基酸由天冬酰胺突变为蛋氨酸,命名为k113e/n349m;
[0041]
或将出发氨基酸序列如seq id no.9所示的谷氨酸脱氢酶的第113位氨基酸由赖氨酸突变为谷氨酰胺,并将第349位氨基酸由天冬酰胺突变为蛋氨酸,命名为k113q/n349m。
[0042]
在本发明的一种实施方式中,编码氨基酸序列分别如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6、seq id no.7、seq id no.8、seq id no.9所示的谷氨酸脱氢酶的基因的核苷酸序列分别为seq id no.10、seq id no.11、seq id no.12、seq id no.13、seq id no.14、seq id no.15、seq id no.16、seq id no.17、seq id no.18所示。
[0043]
本发明还提供了携带上述基因的重组质粒。
[0044]
在本发明的一种实施方式中,所述重组质粒以pet-28a为表达载体。
[0045]
本发明还提供了一种重组细胞,所述重组细胞携带上述基因,或携带上述重组质粒。
[0046]
在本发明的一种实施方式中,所述重组细胞以细菌或真菌为宿主细胞。
[0047]
在本发明的一种实施方式中,所述重组细胞以大肠杆菌为宿主细胞。
[0048]
本发明还提供了上述谷氨酸脱氢酶突变体的制备方法,所述方法为:将上述重组细胞接入到lb培养基中,于37℃条件下培养至菌密度od达到0.5-0.7后,加入iptg诱导剂,于17℃诱导15-17h后收集菌液,将得到的菌液离心收集菌体,将得到的菌体经重悬、破碎后得到细胞破碎液,将细胞破碎液离心收集上清液,分离上清液中的谷氨酸脱氢酶突变体。
[0049]
本发明还提供了一种(r)-4-氨基戊酸的合成方法,所述方法为:将上述突变体加入到含有葡萄糖脱氢酶、4-氧代戊酸、葡萄糖和nh4cl-nh3·
h2o缓冲液的反应体系中进行反应得到。
[0050]
在本发明的一种实施方式中,所述方法为:将0.3-1.0u/ml上述突变体的纯酶液添加至含有20~50mmol/l 4-氧代戊酸、30~75mmol/l葡萄糖、0.5-1.5mmol/l nadph和0.5-3m nh4cl-nh3·
h2o(ph 8.5)反应液中,得到反应体系;将反应体系置于30℃和200rpm条件
下进行反应,制备得到(r)-4-氨基戊酸。
[0051]
在本发明的一种实施方式中,所述方法为:将0.5u/ml上述突变体的纯酶液添加至含有20~50mmol/l 4-氧代戊酸、30~75mmol/l葡萄糖、1mmol/l nadph和1m nh4cl-nh3·
h2o(ph 8.5)反应液中,得到反应体系;将反应体系置于30℃和200rpm条件下进行反应,制备得到(r)-4-氨基戊酸。
[0052]
本发明还提供了上述谷氨酸脱氢酶突变体,或上述基因,或上述重组质粒,或上述重组细胞在制备(r)-4-氨基戊酸中的应用。
[0053]
有益效果
[0054]
(1)采用本发明提供的方法提供了一种全新的生物法合成(r)-4-氨基戊酸的方法;以终浓度为0.8mol/l 4-氧代戊酸进行活力测定,其中,野生型谷氨酸脱氢酶无可测量的催化活力,而本发明的突变体均有催化活力,并且突变体k116s/n348l,k116e/n348m,k116q/n348m的催化活力分别可达1.87u/mg,3.16u/mg,4.55u/mg,证明本发明的技术方案实现了4-氧代戊酸的催化活力从无到有并提高的过程。
[0055]
(2)本发明构建了一种生物法制备(r)-4-氨基戊酸的方法,并且突变体k116q/n348m在较高的底物浓度下(1.2mol/l),依然可以有效催化底物4-氧代戊酸生产(r)-4-氨基戊酸,并且转化率可高达99%,相比较于目前已报道的化学法合成(r)-4-氨基戊酸的方法,本发明所提供的生物法合成(r)-4-氨基戊酸绿色、环保、高效,具有广泛的工业应用前景。
附图说明
[0056]
图1:源于牛肝的谷氨酸脱氢酶的晶体结构(pdb:6dhd)及关键作用点分析。
[0057]
图2:不同来源的谷氨酸脱氢酶序列比对及关键位点保守性分析。
[0058]
图3:重叠延伸pcr构建突变文库示意图。
[0059]
图4:ec-gdh各优势突变株蛋白电泳图。
[0060]
图5:部分高通量筛选优势突变株复筛相对酶活比较。
具体实施方式
[0061]
下面结合具体实施例,对本发明进行进一步的阐述。
[0062]
下述实施例中涉及的培养基如下:
[0063]
lb液体培养基:酵母粉5g/l,胰蛋白胨10g/l,nacl 10g/l。
[0064]
lb固体培养基:酵母粉5g/l,胰蛋白胨10g/l,nacl 10g/l,琼脂粉15g/l。
[0065]
下述实施例所涉及的引物序列如下:
[0066]
表1氨基酸序列如seq id no.1所示的酶突变体构建时所需的引物序列:
[0067][0068]
备注:下划线碱基对应于相应突变位点,加粗字体为酶切位点。
[0069]
表2氨基酸序列如seq id no.2所示的酶突变体构建时所需的引物序列:
[0070][0071]
表3氨基酸序列如seq id no.3所示的酶突变体构建时所需的引物序列:
[0072][0073]
表4氨基酸序列如seq id no.4所示的酶突变体构建时所需的引物序列:
[0074][0075]
表5氨基酸序列如seq id no.5所示的酶突变体构建时所需的引物序列:
[0076][0077]
表6氨基酸序列如seq id no.6所示的酶突变体构建时所需的引物序列:
[0078][0079][0080]
表7氨基酸序列如seq id no.7所示的酶突变体构建时所需的引物序列:
[0081][0082]
表8氨基酸序列如seq id no.8所示的酶突变体构建时所需的引物序列:
[0083][0084]
表9氨基酸序列如seq id no.9所示的酶突变体构建时所需的引物序列:
[0085][0086][0087]
下述实施例所涉及的检测方法如下:
[0088]
谷氨酸脱氢酶酶活的检测:
[0089]
测定活力的反应体积为200μl,总反应体系为:将0.08mg/ml纯酶液添加至含有tris-hcl(100mmol/l,ph 9.5)、nh4cl(1mol/l)、4-氧代戊酸(5mmol/l)和nadh(0.2mmol/l)
的反应液中进行反应,对照组中不含酶液,其他成分相同。
[0090]
分别将各反应组分于30℃条件下保温2min,通过加入酶液引发反应。活力测定在30℃下进行5min,每隔10s记录340nm处的吸光度变化。
[0091]
酶活性单位(u)定义为:在上述条件下,每分钟催化氧化1μmol nadh的所需酶量。比活性定义为:每毫克酶蛋白所含的酶活单位数(u/mg),用考马斯亮蓝法测定蛋白浓度,所有测定都遵循标准测定程序,并且一式三份进行。
[0092]
活力计算公式为:酶活(u)=ew
×
v
×
1000/6220/l。其中:ew为1min内340nm处的吸光度变化值;v为酶活测定反应体系的体积,单位为ml,本例中为0.2;6200为摩尔消光系数,单位为l/mol/cm;l为光程距离,单位为cm,本例中为0.6。
[0093]
比酶活的计算:比活(u/mg)=酶活(u)/蛋白量(mg)。
[0094]
4-氧代戊酸含量的检测:
[0095]
通过uhplc法测定4-氧代戊酸的含量,测定条件:使用(phenomenex)色谱柱(100
×
2.1mm;1.7μm)进行uhplc分析;条件a:mecn/h2o+0.1%甲酸的混合物作为洗脱液,具有线性梯度(2分钟内比率为30/70,然后在2.5分钟内比率为30/70至80/20,然后在0.5分钟内比率为80/20);流量0.5ml min-1
,温度25℃,进样量1μl,λ=360nm处的紫外线检测。条件b:mecn/h2o+0.1%甲酸作为洗脱液的混合物具有线性梯度(2分钟内比率为10/90,然后5分钟内比率为10/90至50/50,然后在2分钟内比率为50/50至100/0),流量0.5ml min-1
,温度25℃,进样量1μl,λ=340nm处的紫外线检测。
[0096]
实施例1:谷氨酸脱氢酶突变文库的构建
[0097]
图1是源于牛肝的谷氨酸脱氢酶的晶体结构(pdb:6dhd),该图展示了底物谷氨酸与酶的作用方式;其中棍棒结构显示的氨基酸残基115k和350n与底物谷氨酸的主链羧基的两个氧相互作用,对底物主链进行锚定;通过序列比对发现(如图2所示),这两个氨基酸残基在谷氨酸脱氢酶中是保守位点,因此将两个位点作为改造对象。
[0098]
由上海生工化学合成携带核苷酸序列如seq id no.10所示的谷氨酸脱氢酶基因的重组质粒pet-28a-gludh及重组菌株e.coli bl21(de3)/pet-28a-gludh,将重组菌株e.coli bl21(de3)/pet-28a-gludh命名为e.coli bl21(de3)/pet-28a-wt1,并接种至lb固体培养基中培养。
[0099]
根据两个突变位点上下游的目的基因序列设计实验所需的引物对(如表1所示),送至生工生物工程(上海)股份有限公司合成,参照takara公司star primer gxl试剂盒说明书所示方法进行定点突变。采用重叠延伸pcr的方法构建突变文库。
[0100]
pcr反应体系为:超纯水23μl,prime star max dna polymerase 25μl,正向和反向引物(10pm)均为1μl,含有谷氨酸脱氢酶目的基因的质粒模板(10ng)1μl。
[0101]
重叠延伸方法如图3所示,第一轮pcr:分别使用表1所示的引物对序列扩增基因片段a,b,c,将扩增产物采用琼脂糖凝胶电泳后分别从琼脂糖凝胶中提取得到:片段a,片段b和片段c。
[0102]
第二轮pcr:分别将第一轮pcr得到的片段b与片段a和c融合并扩增,将扩增产物采用琼脂糖凝胶电泳后从琼脂糖凝胶中提取后分别得到纯化融合片段ab和bc。
[0103]
第三轮pcr:将第二轮得到的片段ab和bc融合在一起,并通过琼脂糖凝胶电泳和凝胶提取,纯化得到最终的融合基因。
[0104]
将最终的融合基因采用bamh i和xho i酶切插入pet-28a中,得到重组质粒,并将重组质粒转化到大肠杆菌dh5α感受态细胞中,得到重组大肠杆菌,将重组大肠杆菌接种至lb固体培养基中培养得到菌落,从得到的重组大肠杆菌dh5α细胞中提取质粒,得到含有突变基因的重组质粒pet-28a-融合蛋白,然后将pet-28a-融合蛋白转化至大肠杆菌bl21(de3)细胞,得到重组菌bl21(de3)/pet-28a-融合蛋白,将重组菌bl21(de3)/pet-28a-融合蛋白接种至lb固体培养基中培养。
[0105]
实施例2:谷氨酸脱氢酶突变文库的初筛
[0106]
具体步骤如下:
[0107]
(1)挑取实施例1中得到的重组菌bl21(de3)/pet-28a-融合蛋白单菌落,将其转移至96孔深孔板(每个孔中含300μl lb液体培养基和50μg/ml卡那霉素)中,并于37℃和200rpm孵育10-12h。
[0108]
(2)分别将步骤(1)中经孵育后得到的每个孔中取50μl培养物转移至第二个96深孔板(每个孔中含400μl lb液体培养基和50μg/ml卡那霉素)中的相应孔中,并将第二个96深孔板在37℃和250rpm下孵育持续3-4h。之后,将50μl含有2mm iptg的lb液体培养基加入到第二个96深孔板的每个孔中以诱导蛋白质表达,然后将第二个96深孔板在20℃和250rpm下继续孵育16-18h。
[0109]
(3)将步骤(2)得到的产物通过离心,将细胞收集在96深孔板中,并在-80℃下保存过夜,得到细胞菌体,将载有细胞菌体的96深孔板在37℃融化,向板上的每个孔添加200μl含0.75mg/ml溶菌酶和2u/ml dnase i的tris-hcl缓冲液(5mm,ph 8.0),并在37℃下放置1小时。随后,在每个孔中补充200μl tris-hcl缓冲液(5mm,ph 8.0),并将每个孔中离心后的得到含有粗酶液的上清液。
[0110]
(4)使用酶标仪通过测量步骤(3)中每个孔中得到的上清液在340nm处吸光度的初始变化率(对应于nadh的量(ε=6220m-1
cm-1
)),在30℃下测定酶标板中每个孔中酶的还原胺化活性。反应体系:200μl,含有20μl细胞裂解上清,40mm 4-氧代戊酸,0.2mm nadph和2m nh4cl/nh4oh缓冲液(ph 9.5)。
[0111]
通过上述步骤,总共筛选了3066个突变株,根据patrick等人开发的分数文库完整性方程,对应的文库覆盖率>95%,将突变体k116s/n348l的酶活数据作为对照,将活性超过40mu/ml的突变株筛选出来;最终获得了9株突变体,分别进行纯化并进行酶活测试,通过测序获得了三株对底物有活力的突变株(如图5所示),通过测序发现其中编号1,4,5,7,9为k116s/n348l;编号2,3,8为k116e/n348m;编号6为k116q/n348m。即,得到bl21(de3)/pet-28a-k116s/n348l,bl21(de3)/pet-28a-k116e/n348m,bl21(de3)/pet-28a-k116q/n348m;其中,编码突变体k116s/n348l的基因是在核苷酸序列如seq id no.10所示的谷氨酸脱氢酶基因的编码第116位氨基酸的密码子突变为tct,并将编码第348位氨基酸的密码子突变为ctg;编码突变体k116e/n348m的基因是在核苷酸序列如seq id no.10所示的谷氨酸脱氢酶基因的编码第116位氨基酸的密码子突变为gag,并将编码第348位氨基酸的密码子突变为atg;编码突变体k116q/n348m的基因是在核苷酸序列如seq id no.10所示的谷氨酸脱氢酶基因的编码第116位氨基酸的密码子突变为cag,并将编码第348位氨基酸的密码子突变为atg。
[0112]
实施例3:谷氨酸脱氢酶粗酶液的制备
[0113]
具体步骤如下:
[0114]
(1)菌种活化:分别将实施例1中得到的e.coli bl21(de3)/pet-28a-wt1及实施例2中获得的含有谷氨酸脱氢酶突变体基因的基因工程菌:bl21(de3)/pet-28a-k116s/n348l,bl21(de3)/pet-28a-k116e/n348m,bl21(de3)/pet-28a-k116q/n348m接种到含有5ml lb液体培养基的试管中,于37℃,200rpm条件下培养6-8h,得到种子液。
[0115]
(2)粗酶液的制备:分别将活化后的种子液按2%(v/v)的接种量接种到含有100ml lb液体培养基的三角瓶中,于37℃,200rpm条件下培养2-3h,至od
600
为0.6-0.8,添加iptg至终浓度为0.1mmol/l后,于17℃,200rpm条件下继续培养12-17h,得到发酵液;分别将获得的发酵液于4℃,8000rpm条件下离心5min,弃上清,取菌体,将菌体用9%的生理盐水洗涤两遍,并重悬于缓冲液a(100mmol/l tris,150mmol/l nacl,20mmol/l咪唑ph7.5)中,得到菌悬液,将菌悬液采用超声破碎,得到细胞破碎液,将细胞破碎液于10000rpm,4℃条件下离心30min,取上清液,即得到:含有野生型谷氨酸脱氢酶的粗酶液、含有谷氨酸脱氢酶突变体k116s/n348l的粗酶液、含有谷氨酸脱氢酶突变体k116e/n348m的粗酶液、含有谷氨酸脱氢酶突变体k116q/n348m的粗酶液。
[0116]
实施例4:谷氨酸脱氢酶的纯化
[0117]
将实施例3中得到的含有野生型谷氨酸脱氢酶的粗酶液、含有谷氨酸脱氢酶突变体k116s/n348l的粗酶液、含有谷氨酸脱氢酶突变体k116e/n348m的粗酶液、含有谷氨酸脱氢酶突变体k116q/n348m的粗酶液分别用0.22um水系滤膜过滤后,缓慢加样至ni-nat亲和层析柱,加样完毕先用缓冲液a洗涤,再用缓冲液b(100mmol/l tris,150mmol/l nacl,500mmol/l咪唑,ph7.5)梯度洗脱,收集300mmol/l咪唑对应的洗脱峰。
[0118]
通过sds-page进行鉴定,分别得到:纯化后的野生型谷氨酸脱氢酶,命名为wt1(对应图4中的ec-gdh);突变体k116s/n348l,突变体k116e/n348m,突变体k116q/n348m(结果如图4所示),目的蛋白条带大小为48kda;随后用脱盐柱除去纯酶中的咪唑,用超滤管(截留分子量大于30kda的分子)于4000rpm下进行离心浓缩。加入终浓度为10%的甘油,于-80℃下保存备用。
[0119]
实施例5:谷氨酸脱氢酶的获得
[0120]
按照实施例1-4的方法,其中所涉及的引物序列如表2-9所示,分别获得:
[0121]
野生型谷氨酸脱氢酶(核苷酸序列如seq id no.11),命名为wt2;突变体k114s/n348l,突变体k114e/n348m,突变体k114q/n348m;其中,编码突变体k114s/n348l的基因是在核苷酸序列如seq id no.11所示的谷氨酸脱氢酶基因的编码第114位氨基酸的密码子突变为tct,并将编码第348位氨基酸的密码子突变为ctg;编码突变体k114e/n348m的基因是在核苷酸序列如seq id no.11所示的谷氨酸脱氢酶基因的编码第114位氨基酸的密码子突变为gag,并将编码第348位氨基酸的密码子突变为atg;编码突变体k114q/n348m的基因是在核苷酸序列如seq id no.11所示的谷氨酸脱氢酶基因的编码第114位氨基酸的密码子突变为cag,并将编码第348位氨基酸的密码子突变为atg;
[0122]
野生型谷氨酸脱氢酶(核苷酸序列如seq id no.12),命名为wt3;突变体k114s/n349l;突变体纯酶k114e/n349m;突变体k114q/n349m;其中,编码突变体k114s/n349l的基因是在核苷酸序列如seq id no.12所示的谷氨酸脱氢酶基因的编码第114位氨基酸的密码子突变为tct,并将编码第348位氨基酸的密码子突变为ctg;编码突变体k114e/n349m的基
因是在核苷酸序列如seq id no.12所示的谷氨酸脱氢酶基因的编码第114位氨基酸的密码子突变为gag,并将编码第348位氨基酸的密码子突变为atg;编码突变体k114q/n349m的基因是在核苷酸序列如seq id no.12所示的谷氨酸脱氢酶基因的编码第114位氨基酸的密码子突变为cag,并将编码第348位氨基酸的密码子突变为atg;
[0123]
野生型谷氨酸脱氢酶(核苷酸序列如seq id no.13),命名为wt4;突变体k112s/n344l;突变体k112e/n344m;突变体k112q/n344m;其中,编码突变体k112s/n344l的基因是在核苷酸序列如seq id no.13所示的谷氨酸脱氢酶基因的编码第112位氨基酸的密码子突变为tct,并将编码第344位氨基酸的密码子突变为ctg;编码突变体k112e/n344m的基因是在核苷酸序列如seq id no.13所示的谷氨酸脱氢酶基因的编码第112位氨基酸的密码子突变为gag,并将编码第344位氨基酸的密码子突变为atg;编码突变体k112q/n344m的基因是在核苷酸序列如seq id no.13所示的谷氨酸脱氢酶基因的编码第112位氨基酸的密码子突变为cag,并将编码第344位氨基酸的密码子突变为atg;
[0124]
野生型谷氨酸脱氢酶(核苷酸序列如seq id no.14),命名为wt5突变体k104s/n326l;突变体k104e/n326m突变体k104q/n326m;其中,编码突变体k104s/n326l的基因是在核苷酸序列如seq id no.14所示的谷氨酸脱氢酶基因的编码第104位氨基酸的密码子突变为tct,并将编码第326位氨基酸的密码子突变为ctg;编码突变体k104e/n326m的基因是在核苷酸序列如seq id no.14所示的谷氨酸脱氢酶基因的编码第104位氨基酸的密码子突变为gag,并将编码第326位氨基酸的密码子突变为atg;编码突变体k104q/n326m的基因是在核苷酸序列如seq id no.14所示的谷氨酸脱氢酶基因的编码第104位氨基酸的密码子突变为cag,并将编码第326位氨基酸的密码子突变为atg;
[0125]
野生型谷氨酸脱氢酶(核苷酸序列如seq id no.15),命名为wt6;突变体k102s/n338l;突变体k102e/n338m;突变体k102q/n338m;其中,编码突变体k102s/n338l的基因是在核苷酸序列如seq id no.15所示的谷氨酸脱氢酶基因的编码第102位氨基酸的密码子突变为tct,并将编码第338位氨基酸的密码子突变为ctg;编码突变体k102e/n338m的基因是在核苷酸序列如seq id no.15所示的谷氨酸脱氢酶基因的编码第102位氨基酸的密码子突变为gag,并将编码第338位氨基酸的密码子突变为atg;编码突变体k102q/n338m的基因是在核苷酸序列如seq id no.15所示的谷氨酸脱氢酶基因的编码第102位氨基酸的密码子突变为cag,并将编码第338位氨基酸的密码子突变为atg;
[0126]
野生型谷氨酸脱氢酶(核苷酸序列如seq id no.16),命名为wt7;突变体k101s/n340l;突变体k101e/n340m;突变体k101q/n340m;其中,编码突变体k101s/n340l的基因是在核苷酸序列如seq id no.16所示的谷氨酸脱氢酶基因的编码第101位氨基酸的密码子突变为tct,并将编码第340位氨基酸的密码子突变为ctg;编码突变体k101e/n340m的基因是在核苷酸序列如seq id no.16所示的谷氨酸脱氢酶基因的编码第101位氨基酸的密码子突变为gag,并将编码第340位氨基酸的密码子突变为atg;编码突变体k101q/n340m的基因是在核苷酸序列如seq id no.16所示的谷氨酸脱氢酶基因的编码第101位氨基酸的密码子突变为cag,并将编码第340位氨基酸的密码子突变为atg;
[0127]
野生酶谷氨酸脱氢酶(核苷酸序列如seq id no.17),命名为wt8;突变体k102s/n346l;突变体k102e/n346m;突变体k102q/n346m;其中,编码突变体k102s/n346l的基因是在核苷酸序列如seq id no.17所示的谷氨酸脱氢酶基因的编码第102位氨基酸的密码子突
变为tct,并将编码第346位氨基酸的密码子突变为ctg;编码突变体k102e/n346m的基因是在核苷酸序列如seq id no.17所示的谷氨酸脱氢酶基因的编码第102位氨基酸的密码子突变为gag,并将编码第346位氨基酸的密码子突变为atg;编码突变体k102q/n346m的基因是在核苷酸序列如seq id no.17所示的谷氨酸脱氢酶基因的编码第102位氨基酸的密码子突变为cag,并将编码第346位氨基酸的密码子突变为atg;
[0128]
野生型谷氨酸脱氢酶(核苷酸序列如seq id no.18),命名为wt9;突变体k113s/n349l;突变体k113e/n349m;突变体k113q/n349m。其中,编码突变体k113s/n349l的基因是在核苷酸序列如seq id no.18所示的谷氨酸脱氢酶基因的编码第113位氨基酸的密码子突变为tct,并将编码第349位氨基酸的密码子突变为ctg;编码突变体k113s/n349l的基因是在核苷酸序列如seq id no.18所示的谷氨酸脱氢酶基因的编码第113位氨基酸的密码子突变为gag,并将编码第349位氨基酸的密码子突变为atg;编码突变体k113s/n349l的基因是在核苷酸序列如seq id no.18所示的谷氨酸脱氢酶基因的编码第113位氨基酸的密码子突变为cag,并将编码第349位氨基酸的密码子突变为atg。
[0129]
实施例6:谷氨酸脱氢酶突变体对4-氧代戊酸的活力测定
[0130]
采用酶标仪分别测定实施例1-5中得到的纯化后的野生酶及谷氨酸脱氢酶突变体对4-氧代戊酸活力,结果如表10所示。
[0131]
结果表明:由表10可知,野生型谷氨酸脱氢酶对4-氧代戊酸未检测到可测量的催化活性,而本发明得到的突变体均具有催化活性。关键的两点突变中,kq/nm的组合能体现出最高的酶活。
[0132]
表10不同的谷氨酸脱氢酶的比酶活
[0133]
类型比酶活(u/g)类型比酶活(u/g)wt10wt20k116s/n348l1.87k114s/n348l0.38k116e/n348m3.16k114e/n348m0.88k116q/n348m4.55k114q/n348m1.35wt30wt40k114s/n349l1.56k112s/n344l0.24k114e/n349m2.13k112e/n344m0.65k114q/n349m2.56k112q/n344m0.97wt50wt60k104s/n326l0.33k102s/n338l0.89k104e/n326m0.89k102e/n338m1.22k104q/n326m1.33k102q/n338m1.58wt70wt80k101s/n340l0.67k102s/n346l0.25k101e/n340m1.21k102e/n346m0.77k101q/n340m1.77k102q/n346m1.21wt90
ꢀꢀ
k113s/n349l0.63
ꢀꢀ
k113e/n349m1.21
ꢀꢀ
k113q/n349m1.89
ꢀꢀ
[0134]
实施例7:合成(r)-4-氨基戊酸
[0135]
本发明以谷氨酸脱氢酶突变体k116q/n348m为例,通过与葡萄糖脱氢酶(gdh)偶联用于合成(r)-4-氨基戊酸。
[0136]
反应体系体积为1ml,将谷氨酸脱氢酶突变体k116q/n348m纯酶(1mg/ml)添加至含有gludh纯酶(1mg/ml)、4-氧代戊酸(50mmol/l),葡萄糖(75mmol/l),nadp
+
(1mmol/l),nh4cl-nh3·
h2o缓冲液(1m,ph 8.5)的反应液中,得到反应体系;将反应体系在30℃,200rpm条件下反应6h。定时取样,样品用naoh水溶液(200μl,10m)淬灭,并用甲基叔丁基醚(500ul,两次)萃取。
[0137]
检测结果如下表11所示:
[0138]
表11:谷氨酸脱氢酶野生酶和突变体k116q/n348m合成(r)-4-氨基戊酸的产量
[0139][0140]
结果显示,野生酶不能合成(r)-4-氨基戊酸,而经过突变后的突变体k116q/n348m能够合成(r)-4-氨基戊酸,并且产量为49mmol/l,底物转化率为:98%。
[0141]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



