一种生产L-瓜氨酸的基因工程菌株及其应用的制作方法
 2021-02-02 02:02:45|
2021-02-02 02:02:45| 361|
361| 起点商标网
起点商标网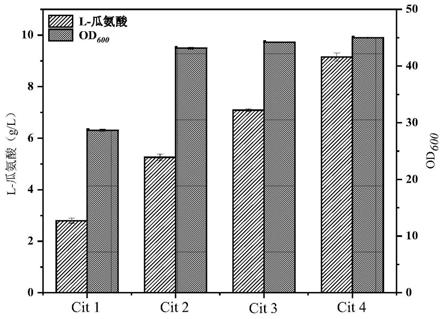
一种生产l-瓜氨酸的基因工程菌株及其应用
技术领域
[0001]
本发明属于基因工程技术领域,特别涉及一种生产l-瓜氨酸的基因工程菌株及其构建方法与应用。
背景技术:
[0002]
l-瓜氨作为一种非蛋白质α-氨基酸,具有重要的生化和生理学功能。目前,l-瓜氨酸已在医药、工业、食品、化妆品、畜牧业等领域有广泛的应用,具有重要的经济和社会价值。l-瓜氨酸的生产方法主要包括化学合成法、酶催化法、微生物发酵法。化学合成法主要是将l-精氨酸在碱性条件下水解直接得到l-瓜氨酸。此法产率较低,环境污染大,而且生产过程中容易产生d型旋光对映体,造成后期产品分离纯化成本很高,因此化学合成法很难投入到实际应用中;酶催化法主要是以l-精氨酸为底物,利用精氨酸脱亚胺酶一步酶促反应直接将底物转变为l-瓜氨酸。但是精氨酸脱亚胺酶普遍具有稳定性不高的特点,难以实现酶的重复利用,而且在生产过程中需要耗费大量的发酵原料,工业成本较大,限制了酶催化法生产l-瓜氨酸的工业化应用;微生物发酵法是通过诱变筛选出高产型突变株或者通过代谢改造模式菌株实现以廉价碳源直接发酵生产l-瓜氨酸的目的,采用发酵法生产l-瓜氨酸生产工艺相对简单、对环境影响相对较小、产品纯度高,适合大规模工业生产。
[0003]
由于l-瓜氨酸合成代谢途径中存在诸多反馈调控,整个合成途径很长,并且合成l-瓜氨酸所需前体物涉及到的代谢网络复杂,因此最初利用微生物发酵法生产l-瓜氨酸的工业生产菌株主要采用传统诱变结合结构类似物抗性筛选的方法获取。研究策略集中在筛选结构类似物突变体,以解除l-瓜氨酸合成过程中的反馈调控,提高胞内l-瓜氨酸的积累量。其中,okumura shinji等经过x射线逐级诱变筛选到一株精氨酸需求型突变菌株(us3282794),经过96h发酵培养,l-瓜氨酸氨酸的积累量为19g/l。但是经过诱变筛选得到的生产菌株,存在遗传稳定性差,容易产生回复突变等缺点很难投入到大批量工业生产中。
[0004]
随着基因工程技术的飞速发展,运用代谢工程技术构建l-瓜氨酸生产菌株的方法逐渐替代了传统诱变育种方法。谷氨酸棒状杆菌作为传统的氨基酸发酵生产菌株,其胞内摄取的葡萄糖经过糖酵解途径生成谷氨酸的代谢流量较强,而谷氨酸作为l-瓜氨酸合成的主要的前体物之一,因此谷氨酸棒状杆菌作为构建l-瓜氨酸生产菌株的主要选择。谢红翠等以谷氨酸棒状杆菌为出发菌株,敲除l-瓜氨酸降解相关基因argg,然后将合成l-瓜氨酸的基因簇argcjbdf连接到组成型载体pxmj19-laci上,并将其导入谷氨酸棒状杆菌中(doi:10.3969/j.issn.1671-7627)。该菌株经过72h摇瓶发酵后,l-瓜氨酸产量为4.33g/l。hao等以谷氨酸棒状杆菌为出发菌株,通过敲除l-瓜氨酸降解的基因argg及编码阻遏蛋白的argr基因,并在此基础上导入重组质粒pxmj19-argj,以增强鸟氨酸乙酰基转移酶的表达(doi:10.1007/s10295-014-1561-x)。最终经过72h摇瓶发酵后,l-瓜氨酸的积累量为8.51g/l,对该菌株进行摇瓶发酵培养条件优化(doi:10.3969/j.issn.1672-3678),经摇瓶培养72h后该菌株l-瓜氨酸的积累量为14.96g/l。上述生产菌株普遍存在生产周期长,生产强度低,生产易波动,菌体生长受限等问题,而且发酵过程中需要额外添加精氨酸,造成生产成本过
大,同时在菌株构建过程中采用将l-瓜氨酸合成关键基因连接到表达载体上以提高关键酶的转录量,在生产过程中表达载体容易丢失或者需要加入一定的选择性压力,限制了菌株的工业化应用。
[0005]
其次,大肠杆菌由于生长周期短、代谢途径清晰、分子操作便捷等优势,目前也被用作氨基酸发酵生产菌株,thorben schramm等筛选得到温度敏感型精氨酸琥珀酸合成酶(由argg基因编码)(10.1016/j.ymben.2020.03.004),该酶在33℃下具有正常酶活性而在39℃失活,通过温度变化控制菌体生长阶段与瓜氨酸生产阶段的切换。将该温度敏感型突变酶整合至大肠杆菌中,并解除瓜氨酸合成途径反馈调控机制,该菌株在1l发酵罐中培养45h后,瓜氨酸积累量达到3g/l.该菌株实现菌株生长与瓜氨酸生产的平衡,但在生产过程中温度变化会对菌体生理特征造成严重影响,并且该菌株瓜氨酸生产性能较弱,难以实现工业化生产。
[0006]
现有l-瓜氨酸生产方法受限于高效稳定生产菌株的获取,仅有的l-瓜氨酸生产菌普遍存在产率低,生产周期长,生产成本高等缺点,并且精氨酸生长缺陷基因型严重影响工程菌株正常生长。平衡工程菌株生长与l-瓜氨酸合成关系成为构建高效稳定生产菌株的关键。
技术实现要素:
[0007]
针对现有技术的不足,本发明提供一株利用微生物发酵法生产l-瓜氨酸的大肠杆菌基因工程菌及其构建方法,解决了生产强度低、生产周期长、菌体生长受限以及生产易波动的问题,并提供相应的发酵过程控制方案,以期应用于l-瓜氨酸高效工业化生产。
[0008]
本发明技术方案概述如下:
[0009]
本发明提供一株高效稳定生产l-瓜氨酸的基因工程菌株cit 4,该菌株是以大肠杆菌为宿主,首先使宿主缺失精氨基琥珀酸合酶活性,以阻断l-瓜氨酸降解为精氨酸琥珀酸;还在宿主基因组上整合了编码大肠杆菌精氨基琥珀酸合酶的基因argg,并由色氨酸启动子p
trp
进行表达调控;还使宿主缺失乙酰鸟氨酸脱乙酰基酶活性;还在宿主基因组上整合了谷氨酸棒杆菌编码谷氨酸乙酰基转移酶的基因argj,一方面在大肠杆菌中构建l-瓜氨酸合成循环途径,实现l-瓜氨酸合成过程中对乙酰基的循环利用,达到对碳源充分利用的目的,进而提高发酵生产过程中糖酸转化率,另一方面大肠杆菌中催化谷氨酸生成乙酰谷氨酸的酶受精氨酸的反馈抑制,而argj蛋白具有催化谷氨酸生成n-乙酰谷氨酸的作用且不存在反馈调控,以此加强由谷氨酸合成乙酰谷氨酸过程中的代谢流量;还在宿主基因组上整合了枯草芽孢杆菌突变株a260编码氨甲酰磷酸合成酶两个亚基的基因pyraa、pyrab,以解除精氨酸对氨甲酰磷酸合成酶的反馈抑制,提高前体物质氨甲酰磷酸的供应。
[0010]
进一步地,所述大肠杆菌为e.coli mg1655。
[0011]
进一步地,所述色氨酸启动子p
trp
的核苷酸序列如seq id no:1所示。
[0012]
进一步地,所述基因argg整合至宿主yeep基因位点,并由色氨酸启动子p
trp
启动。
[0013]
进一步地,所述基因argj整合至宿主arge基因位点,并由一种强启动子启动。
[0014]
进一步地,所述基因pyraa、pyrab整合至宿主yjit基因位点,并由一种强启动子启动。
[0015]
在本发明一种实施方式中,所述强启动子为启动子p
trc
。
[0016]
在本发明一种实施方式中,使宿主缺失精氨基琥珀酸合酶活性是通过敲除所述宿主的编码精氨基琥珀酸合酶的基因argg实现。
[0017]
在本发明一种实施方式中,使宿主缺失乙酰鸟氨酸脱乙酰基酶活性是通过敲除所述宿主的编码谷氨酸乙酰基转移酶的基因argj实现。
[0018]
作为本发明一种较佳实施方式,所述基因工程菌cit 4是采用crispr/cas9介导的基因编辑技术对宿主e.coli mg1655进行定向改造所得,包括如下步骤:
[0019]
(1)敲除宿主中编码精氨基琥珀酸合酶的基因argg;
[0020]
(2)构建启动子p
trp
与大肠杆菌编码精氨基琥珀酸合酶的基因argg的连接片段,并将其整合至宿主的yeep基因位点;
[0021]
(3)敲除宿主中编码乙酰鸟氨酸脱乙酰基酶的基因arge,并构建启动子p
trc
与谷氨酸棒杆菌编码谷氨酸乙酰基转移酶的基因argj的连接片段整合至该位点;
[0022]
(4)构建启动子p
trc
与枯草芽孢杆菌a260的pyraa-pyrab基因的连接片段,并将其整合至宿主的yjit基因位点。
[0023]
本发明还提供了一种制备l-瓜氨酸的方法,所述方法是在适宜条件下培养所述基因工程菌cit 4,并从其培养物中收集l-瓜氨酸。
[0024]
所述方法中优选的发酵培养基组成为:葡萄糖20-40g/l,酵母提取物1-5g/l,蛋白胨1-5g/l,k2hpo
4 1-3g/l,柠檬酸钠1-3g/l,mgso4·
7h2o 1-3g/l,feso4·
7h2o 10-20mg/l,mnso4·
7h2o 10-20mg/l,v
b1
、v
b3
、v
b5
、v
b12
、v
h
各1-3mg/l,色氨酸0.1-0.5g/l,其余为水,ph 7.0-7.2。
[0025]
有益效果:
[0026]
本发明提供一株利用发酵法高效稳定生产l-瓜氨酸的基因工程菌株cit 4,经28h摇瓶发酵培养后,cit 4菌株发酵液中l-瓜氨酸产量可以达到9.15g/l,发酵液od
600
可达45.00,在保持菌体正常生长的情况下,实现了l-瓜氨酸的高效积累,且发酵过程无需额外添加精氨酸,降低了生产成本。菌株不经过诱变处理、无质粒载体、发酵周期短、生产强度高,发酵过程稳定,具有很好的工业应用前景。
[0027]
本发明选用生长周期短、代谢途径清晰、分子操作便捷的e.coli mg1655为出发菌株,首先阻断l-瓜氨酸降解途径,其次引入色氨酸操纵子调控机制,利用受色氨酸调控的启动子p
trp
对编码精氨基琥珀酸合酶的基因argg进行表达调控,通过控制培养基色氨酸含量来控制argg基因表达时间与表达量,从而实现菌体前期生长,后期停止生长,高效合成瓜氨酸的目的,既解决了菌株生长受限、生产易波动等问题,也使菌株在发酵过程中无需额外添加精氨酸,大大降低了生产成本,最后解除整个合成途径和氨基酸代谢网络中与精氨酸相关的代谢反馈抑制作用,构建l-瓜氨酸合成循环途径。最终构建出一株以葡萄糖等廉价碳源为底物从头合成l-瓜氨酸的菌株cit 4。
[0028]
色氨酸操纵子的表达调控机制:色氨酸操纵子的表达主要受阻遏蛋白和弱化子的调控。阻遏蛋白:色氨酸操纵子的阻遏蛋白需要在色氨酸的辅助下才能够阻遏基因的表达,当培养基中有色氨酸时,色氨酸作为辅阻遏物与阻遏蛋白结合,使阻遏蛋白由无活性的构象变为有活性的构象,形成的活性阻遏蛋白与操纵基因结合,rna聚合酶不能移动,结构基因不能转录。弱化子:在色氨酸操纵子结构基因的上游有一段对应14个氨基酸的mrna的前导区,其中有四段特殊序列,1-2、2-3、3-4之间均可配对,1区内的两个连续的色氨酸密码子
对细胞内色氨酸浓度十分敏感,由于大肠杆菌边转录边翻译,当细胞内色氨酸浓度较高时,核糖体快速通过1区到达2区,导致3-4区配对,形成转录终止式构架,转录终止,当细胞内色氨酸浓度较低时,核糖体停在1区,2-3区配对,不能形成终止构架,转录继续;弱化子可以快速地对细胞内色氨酸浓度做出反应。
附图说明
[0029]
图1(a):predcas9质粒图谱。
[0030]
图1(b):pgrb质粒图谱。
[0031]
图2:argg基因敲除片段的构建及验证电泳图。其中:m:1kb dna marker;1:上游同源臂;2:下游同源臂;3:重叠片段;4:原菌对照;5:阳性菌鉴定片段。
[0032]
图3:p
trp-argg基因整合片段构建及验证电泳图。其中:m:1kb dna marker;1:上游同源臂;2:p
trp
片段;3:argg片段;4:下游同源臂;5:重叠片段;6:原菌对照;7:阳性菌鉴定片段。
[0033]
图4:argj基因整合片段构建及验证电泳图。其中:m:1kb dna marker;1:上游同源臂;2:argj片段;3:下游同源臂;4:重叠片段;5:原菌对照;6:阳性菌鉴定片段。
[0034]
图5:pyraa-pyrab第一段整合片段构建及验证电泳图。其中:m:1kb dna marker;1:上游同源臂;2:1-pyraa-pyrab片段;3:下游同源臂;4:重叠片段;5:原菌对照;6:阳性菌鉴定片段。
[0035]
图6:pyraa-pyrab第二段整合片段构建及验证电泳图。其中:m:1kb dna marker;1:pyraa的上游片段-pyraa-pyrab-下游同源臂;2:下游同源臂;3:重叠片段;4:原菌对照;5:阳性菌鉴定片段。
[0036]
图7:菌株cit 1摇瓶发酵数据图。
[0037]
图8:菌株cit 2、cit 3、cit 4摇瓶发酵数据图。
具体实施方式
[0038]
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。
[0039]
实施方案中涉及到的百分号“%”,若未特别说明,指体积百分比;溶液的百分比“%(m/v)”指100ml溶液中含有溶质的克数。
[0040]
实施例1:
[0041]
基因工程菌cit 4的构建:
[0042]
1基因编辑的方法
[0043]
本发明中采用的基因编辑方法参照文献(li y,lin z,huang c,et al.metabolic engineering of escherichia coli using crispr
–
cas9 meditated genome editing.metabolic engineering,2015,31:13-21.)进行,该方法所用的两个质粒图谱见附图1。其中predcas9携带grna表达质粒pgrb的消除系统,λ噬菌体的red重组系统及cas9蛋
白表达系统,奇霉素抗性(工作浓度:100mg/l),32℃培养;pgrb以puc18为骨架,包括启动子j23100,grna-cas9结合区域序列和终止子序列,氨苄青霉素抗性(工作浓度:100mg/l),37℃培养。
[0044]
该方法的具体步骤如下:
[0045]
1.1 pgrb质粒构建
[0046]
构建质粒pgrb的目的是为了转录相应的grna,从而与cas9蛋白形成的复合体,并通过碱基配对和pam识别目的基因靶位点,实现目的dna双链断裂。采用包含靶序列的dna片段与线性化的载体片段重组的方法构建pgrb质粒。
[0047]
1.1.1靶序列设计
[0048]
使用crispr rgen tools设计靶序列(pam:5
’-
ngg-3
’
)
[0049]
1.1.2包含靶序列的dna片段的制备
[0050]
设计引物:5
’-
线性化载体末端序列(15bp)-酶切位点-靶序列(不包括pam序列)-线性化载体末端序列(15bp)-3
’
及其反向互补的引物,通过单链dna的退火制备包含靶序列的dna片段。反应条件:预变性95℃,5min;退火30-50℃,1min。退火体系如下:
[0051]
退火体系
[0052][0053]
1.1.3线性载体的制备
[0054]
载体的线性化采用反向pcr扩增的方法。
[0055]
1.1.4重组反应
[0056]
重组体系如下表。所用重组酶均为ii one step cloning kit系列的酶,重组条件:37℃,30min。
[0057]
重组体系
[0058][0059]
1.1.5质粒的转化
[0060]
取10μl反应液,加入到100μl dh5α化转感受态细胞中,轻轻混匀后冰浴20min,42℃热激45-90s,立即冰浴2-3min,加入900μl soc,于37℃复苏1h。8000rpm离心2min,弃部分上清,留200μl左右将菌体重悬后涂布到含有100mg/l氨苄青霉素的平板,将平板倒置,于37
℃过夜培养。待平板长出单菌落后通过菌落pcr鉴定,挑选阳性重组子。
[0061]
1.1.6克隆鉴定
[0062]
将pcr阳性菌落接种至含有100mg/l氨苄青霉素的lb培养基中过夜培养后保菌,提取质粒,酶切鉴定。
[0063]
1.2重组dna片段的制备
[0064]
用于敲除的重组片段由需敲除基因的上下游同源臂组成(上游同源臂-下游同源臂);用于整合的重组片段以整合位点的上下游同源臂及待整合的基因片段组成(上游同源臂-目的基因-下游同源臂)。利用引物设计软件primer 5,以待敲除基因或待整合位点的上下游序列为模板,设计上下游同源臂引物(扩增长度约400-500bp);以待整合基因为模板,设计整合基因的扩增引物。通过pcr的方法分别扩增上下游同源臂和目的基因片段后,再经过重叠pcr制备重组片段。pcr的体系和方法如下表:
[0065]
pcr扩增体系
[0066][0067][0068]
重叠pcr的体系如下表:
[0069]
重叠pcr扩增体系
[0070][0071]
注:模板由上下游同源臂的扩增片段和目的基因等摩尔组成,且总量不超过10ng。
[0072]
pcr反应条件(宝生物primestar hs酶):预变性(95℃)5min;然后进行30轮循环:
变性(98℃)10s,退火((tm-3/5)℃)15s,72℃延伸(此酶活力1min延伸约1kb);72℃继续延伸10min;维持(4℃)。
[0073]
1.3质粒和重组dna片段的转化
[0074]
1.3.1 predcas9的转化
[0075]
利用电转的方法将predcas9质粒电转至mg1655的电转感受态中,将菌体复苏培养后涂布于含奇霉素的lb平板上,32℃过夜培养。抗性平板上生长单菌落用鉴定引物进行菌落pcr,筛选阳性重组子。
[0076]
1.3.2含predcas9的目的菌株电转化感受态制备
[0077]
32℃培养至od
600
=0.1~0.15添加0.1m的iptg(使其终浓度为0.1mm),继续培养至od
600
=0.2~0.3时进行感受态制备。添加iptg的目的是使predcas9质粒上的重组酶诱导表达。感受态制备所需培养基及制备过程参照常规标准操作。
[0078]
1.3.3 pgrb和重组dna片段的转化
[0079]
将pgrb和供体dna片段同时电转化至含有predcas9的电转感受态细胞中。将电转化后复苏培养的菌体涂布于含氨苄青霉素和奇霉素的lb平板上,32℃过夜培养。用上游同源臂上游引物和下游同源臂的下游引物,或设计专门的鉴定引物,进行菌落pcr验证,筛选阳性重组子并保菌。
[0080]
1.4质粒的消除
[0081]
1.4.1 pgrb的消除
[0082]
将阳性重组子置于含有0.2%阿拉伯糖的lb培养基中过夜培养,适量稀释后涂布于含有奇霉素抗性的lb平板上,32℃过夜培养。对点含有氨苄青霉素和奇霉素抗性的lb平板,挑选氨苄青霉素平板不生长,奇霉素抗性平板生长的单菌落保菌。
[0083]
1.4.2 predcas9质粒的消除
[0084]
将阳性重组子转接到无抗性的lb液体培养基中,42℃过夜培养,适量稀释后涂布于无抗性的lb平板上,37℃过夜培养。对点含有奇霉素抗性和无抗性的lb平板,挑选奇霉素抗性平板不生长,无抗性平板生长的单菌落保菌。
[0085]
2.菌株构建过程中所涉及的引物见下表:
[0086]
[0087][0088]
3菌株构建的具体过程
[0089]
3.1敲除argg基因。
[0090]
以e.coli mg1655基因组为模板,根据其argg基因(ncbi-geneid:12934127)的上下游序列设计上游同源臂引物(up-argg-s、up-argg-a)和下游同源臂引物(dn-argg-s、dn-argg-a),pcr扩增其上、下游同源臂片段。上述片段通过重叠pcr的方法融合,获得敲除argg基因的整合片段(上游同源臂-下游同源臂),构建pgrb-argg使用的含靶序列的dna片段通过引物grna-argg-s和grna-argg-a的退火制得。制备e.coli mg1655的感受态细胞,按照
1.3和1.4所示的方法操作,最终获得菌株cit 1。argg基因敲除过程中,敲除片段的构建和阳性菌株的pcr验证的电泳图见附图2。其中上游同源臂长度为378bp,下游同源臂长度为650bp,重叠片段的长度为1028bp,pcr验证重组子时,阳性重组子所扩增的片段长度应为1028bp,原菌扩增出来的片段长度应为2180bp。
[0091]
3.2将p
trp-argg基因整合至大肠杆菌yeep基因位点。
[0092]
以e.coli mg1655基因组为模板,根据其yeep基因的上下游序列设计上游同源臂引物(up-yeep-s、up-yeep-a)和下游同源臂引物(dn-yeep-s、dn-yeep-a),pcr扩增其上、下游同源臂片段;根据p
trp
基因(序列如seq id no:1所示)设计引物(p
trp-s、p
trp-a),扩增p
trp
基因片段。根据argg基因(ncbi-geneid:12934127)设计引物(argg-s、argg-a),扩增argg基因片段。上述片段通过重叠pcr的方法融合获得p
trp-argg基因的整合片段(上游同源臂-p
trp-argg-下游同源臂),构建pgrb-yeep使用的含靶序列的dna片段通过引物grna-yeep-s和grna-yeep-a的退火制得。制备cit 1的感受态细胞,按照1.3和1.4所示的方法操作,最终获得菌株cit 2。p
trp-argg整合片段的构建和阳性菌株的pcr验证的电泳图见附图3。其中,上游同源臂的长度应为512bp,p
trp
基因片段长度应为273bp,argg基因片段长度应为1344bp,下游同源臂的长度应为513bp,整合片段的总长应为2642bp,pcr验证时,阳性菌pcr扩增片段长度应为2642bp,原菌pcr扩增片段长度应为1396bp。
[0093]
3.3敲除大肠杆菌中arge基因,并在该位点整合来源于谷氨酸棒状杆菌的argj基因。
[0094]
以e.coli mg1655基因组为模板,根据其arge基因(ncbi-geneid:12930574)的上下游序列设计上游同源臂引物(up-arge-s、up-arge-a)和下游同源臂引物(dn-arge-s、dn-arge-a),pcr扩增其上、下游同源臂片段;以谷氨酸棒状杆菌(atcc 13032)基因组为模板,根据其argj基因序列(ncbi-geneid:1019371)设计引物(argj-s、argj-a),pcr扩增argj片段;启动子p
trc
则设计在上游同源臂的下游引物和argj基因的上游引物中。上述片段通过重叠pcr的方法融合,获得敲除arge基因同时整合argj基因的整合片段(上游同源臂-p
trc-argj-下游同源臂),构建pgrb-arge使用的含靶序列的dna片段通过引物grna-arge-s和grna-arge-a的退火制得。制备cit 2的感受态细胞,按照1.3和1.4所示的方法操作,最终获得菌株cit 3。p
trc-argj片段整合过程中,整合片段的构建和阳性菌株的pcr验证的电泳图见附图4。其中上游同源臂长度为510bp,argj基因片段长度为1206bp,下游同源臂长度为668bp,p
trc
启动子长度74bp,p
trc
终止子长度87bp,重叠片段的长度为2545bp,pcr验证重组子时,阳性重组子所扩增的片段长度应为2545bp,鉴定引物长度为1313bp,原菌则无法扩增出dna条带。
[0095]
3.4将来源于枯草芽孢杆菌突变株a260的pyraa-pyrab基因整合在大肠杆菌的yjit基因位点。
[0096]
实验室此前专利申请cn105671007a公布的枯草芽孢杆菌(b.subtilis)a260是以枯草芽孢杆菌168菌株为出发菌株,采用artp诱变和高通量筛选相结合的方法选育而来(该菌株已于2015年12月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路l号院3号,中国科学院微生物研究所,邮编:100101,菌种保藏编号:cgmcc no.11775)。该菌株解除了尿苷酸及精氨酸对氨甲酰磷酸合成酶的反馈调节作用,通过对其嘧啶核苷操纵子基因进行测序发现其氨甲酰磷酸合成酶大亚基(pyrab编码)第949
位的谷氨酸缺失(氨基酸序列如seq id no:2所示)。将b.subtilis a260中不受精氨酸反馈抑制的氨甲酰磷酸合成酶的两个亚基(pyraa、pyrab)引入大肠杆菌中,以提高精氨酸合成过程中前体物氨甲酰磷酸的供应量
[0097]
枯草芽孢杆菌a260中pyraa-pyrab基因共4308bp分两段整合至大肠杆菌中,其中第一段长度为2667bp,第二段长度为1641bp。
[0098]
3.2.1第一段(pyraa-pyrab)基因片段的整合
[0099]
以e.coli mg1655基因组为模板,根据其yjit基因的上下游序列设计上游同源臂引物(up-yjit-s、up-yjit-a)和下游同源臂引物(dn-yjit-s、dn-yjit-a),pcr扩增其上、下游同源臂片段;以b.subtilis a260(cgmcc no.11775)基因组为模板,根据基因pyraa(ncbi-geneid:937368)、pyrab(核苷酸序列如seq id no:3所示)设计引物(1-pyraa-pyrab-s、1-pyraa-pyrab-a),扩增第一段(pyraa-pyrab)基因片段。p
trc
启动子则设计在上游同源臂的下游引物和第一段(pyraa-pyrab)基因片段的上游引物中。上述片段通过重叠pcr的方法融合获得第一段(pyraa-pyrab)基因的整合片段:上游同源臂-p
trc-第一段(pyraa-pyrab)基因片段-下游同源臂,构建pgrb-yjit使用的含靶序列的dna片段通过引物grna-yjit-s和grna-yjit-a的退火制得。制备cit 3的感受态细胞,按照1.3和1.4所示的方法操作,最终获得菌株cit 3-1。第一段(pyraa-pyrab)基因整合片段的构建和阳性菌株的pcr验证的电泳图见附图5。其中,上游同源臂的长度316bp,第一段(pyraa-pyrab)基因片段长度2667bp,下游同源臂的长度667bp,p
trc
启动子长度74bp,整合片段的总长应为3724bp,鉴定引物所扩增片段长度应为1100bp,原菌应无条带。
[0100]
3.2.2第二段(pyraa-pyrab)基因片段的整合
[0101]
以b.subtilis a260(cgmcc no.11775)基因组为模板,根据第二段(pyraa-pyrab)基因片段序列及其上游序列设计上游同源臂p1引物(2-pyraa-pyrab-s、2-pyraa-pyrab-a),p
trc
终止子则设计在上游同源臂p1的下游引物和下游同源臂p2的上游引物中,pcr扩增其上游同源臂片段p1:包括第一段(pyraa-pyrab)基因片段下游266bp,第二段(pyraa-pyrab)基因片段1641bp,p
trc
终止子87bp,共1994bp。以e.coli mg1655基因组为模板,根据其yjit基因的下游序列设计下游同源臂p2引物(dn-yjit-s1、dn-yjit-a),pcr扩增其下游同源臂片段p2。上述片段通过重叠pcr的方法融合,获得第二段(pyraa-pyrab)基因片段的整合片段:上游同源臂片段p1-下游同源臂片段p2。构建pgrb-pyraa-pyrab使用的含靶序列的dna片段通过引物grna-pyraa-pyrab-s和grna-pyraa-pyrab-a的退火制得。制备cit 3-1的感受态细胞,按照1.3和1.4所示的方法操作,最终获得菌株cit 4。第二段(pyraa-pyrab)基因片段的整合过程中,整合片段的构建和阳性菌株的pcr验证的电泳图见附图6。其中第二段(pyraa-pyrab)基因片段的上游同源臂片段p1的总长度为1994bp,下游同源臂片段p2长度为667bp,重叠片段的总长度应为2661bp,鉴定引物所扩增片段长度应为1135bp,原菌应无条带。
[0102]
实施例2:
[0103]
基因工程菌cit 1与e.coli mg1655摇瓶发酵结果对比如图7所示,以验证敲除宿主自身argg对l-瓜氨酸积累的效果。
[0104]
斜面培养:取-80℃保藏菌种划线接种于活化斜面,37℃培养12h,并传代一次;
[0105]
摇瓶种子培养:用接种环刮取一环斜面种子接种于装有30ml种子培养基的500ml
三角瓶中,九层纱布封口,37℃,200rpm培养8h;
[0106]
摇瓶发酵培养:按种子培养液体积10%的接种量接种到装有发酵培养基的500ml三角瓶中(终体积为30ml),九层纱布封口,37℃,200r/min振荡培养,发酵过程中通过补加氨水维持ph在7.0-7.2;补加60%(m/v)葡萄糖溶液维持发酵进行;发酵周期28h;
[0107]
斜面培养基组成为:葡萄糖1g/l,蛋白胨10g/l,牛肉膏10g/l,酵母粉5g/l,nacl 5g/l,琼脂25g/l,其余为水,ph 7.0-7.2;
[0108]
种子培养基组成为:葡萄糖25g/l,酵母提取物5g/l,蛋白胨3g/l,k2hpo
4 1.2g/l,mgso4·
7h2o 0.5g/l,feso4·
7h2o 10mg/l,mnso4·
7h2o 10mg/l,v
b1
、v
b3
、v
b5
、v
b12
各1.3mg/l,v
h 1mg/l,其余为水,ph 7.0-7.2。
[0109]
发酵培养基组成为:葡萄糖25g/l,酵母提取物4g/l,蛋白胨5g/l,k2hpo
4 2g/l,柠檬酸钠2g/l,mgso4·
7h2o 2g/l,feso4·
7h2o 20mg/l,mnso4·
7h2o 10mg/l,v
b1
、v
b3
、v
b5
、v
b12
、v
h
各2mg/l,其余为水,ph 7.0-7.2。
[0110]
经过28h摇瓶发酵,e.coli mg1655菌株od
600
为48.86,发酵液中无l-瓜氨酸积累,重组菌株cit 1od
600
为28.65,发酵液中l-瓜氨酸积累量达到2.80g/l。表明阻断l-瓜氨酸降解途径对l-瓜氨酸积累具有一定的正向效果,但同时,与对照菌株相比,重组菌株cit 1od
600
下降41.36%,菌株生长受到了严格限制。
[0111]
实施例3:
[0112]
基因工程菌cit 2、cit 3、cit 4摇瓶发酵结果对比,如图8所示。
[0113]
斜面培养:取-80℃保藏菌种划线接种于活化斜面,37℃培养12h,并传代一次;
[0114]
摇瓶种子培养:用接种环刮取一环斜面种子接种于装有30ml种子培养基的500ml三角瓶中,九层纱布封口,37℃,200rpm培养8h;
[0115]
摇瓶发酵培养:按种子培养液体积10%的接种量接种到装有发酵培养基的500ml三角瓶中(终体积为30ml),九层纱布封口,37℃,200r/min振荡培养,发酵过程中通过补加氨水维持ph在7.0-7.2;补加60%(m/v)葡萄糖溶液维持发酵进行;发酵周期28h;
[0116]
斜面培养基组成为:葡萄糖1g/l,蛋白胨10g/l,牛肉膏10g/l,酵母粉5g/l,nacl 5g/l,琼脂25g/l,其余为水,ph 7.0-7.2;
[0117]
种子培养基组成为:葡萄糖25g/l,酵母提取物5g/l,蛋白胨3g/l,k2hpo
4 1.2g/l,mgso4·
7h2o 0.5g/l,feso4·
7h2o 10mg/l,mnso4·
7h2o 10mg/l,v
b1
、v
b3
、v
b5
、v
b12
各1.3mg/l,v
h 1mg/l,其余为水,ph 7.0-7.2。
[0118]
发酵培养基组成为:葡萄糖25g/l,酵母提取物4g/l,蛋白胨5g/l,k2hpo
4 2g/l,柠檬酸钠2g/l,mgso4·
7h2o 2g/l,feso4·
7h2o 20mg/l,mnso4·
7h2o 10mg/l,v
b1
、v
b3
、v
b5
、v
b12
、v
h
各2mg/l,色氨酸0.4g/l,其余为水,ph 7.0-7.2。
[0119]
经过28h摇瓶发酵,重组菌株cit 2在od
600
达到28左右,即对数生长末期添加色氨酸,最终od
600
为43.15,发酵液中l-瓜氨酸积累量为5.26g/l;与重组菌株cit 1相比,重组菌株cit 2od
600
提高了50.61%,同时l-瓜氨酸的积累量提高了87.86%;发酵数据表明,引入p
trp-argg可有效改善菌株生长,同时可积累大量l-瓜氨酸。
[0120]
经过28h摇瓶发酵,重组菌株cit 3od
600
为44.20,发酵液中l-瓜氨酸积累量达到7.09g/l,与重组菌株cit 2相比,l-瓜氨酸的积累量提高了34.79%,表明引入外源双功能酶argj基因可以实现l-瓜氨酸合成过程中乙酰基循环利用对提高重组菌株l-瓜氨酸产量
具有明显效果。同时有效疏通了大肠杆菌中受反馈调控的l-瓜氨酸合成途径代谢流量,避免了l-瓜氨酸合成途径中由乙酰基生成的乙酸对重组菌株发酵性能的不利影响。
[0121]
经过28h摇瓶发酵,重组菌株cit 4od
600
为45.00,发酵液中l-瓜氨酸积累量达到9.15g/l。与重组菌株cit 3相比,整合外源pyraa-pyrab提高氨甲酰磷酸供应后重组菌株cit 4中l-瓜氨酸的积累量提高了29.06%,表明提高大肠杆菌中氨甲酰磷酸供应量可有效缓解其合成过程中所受的严格反馈调控,对l-瓜氨酸的积累量具有明显正向效果。
[0122]
虽然本发明已经以较佳实施例公开如上,但其并非用以限定本发明,任何本领域技术人员,在不脱离本发明的精神和原理的情况下,可以对这些实施例进行各种形式和细节的变化、修改、替换和变型,本发明的范围由权利要求及其等同物所限定。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



