盐生草HgS5基因及其应用的制作方法
 2021-02-02 01:02:47|
2021-02-02 01:02:47| 183|
183| 起点商标网
起点商标网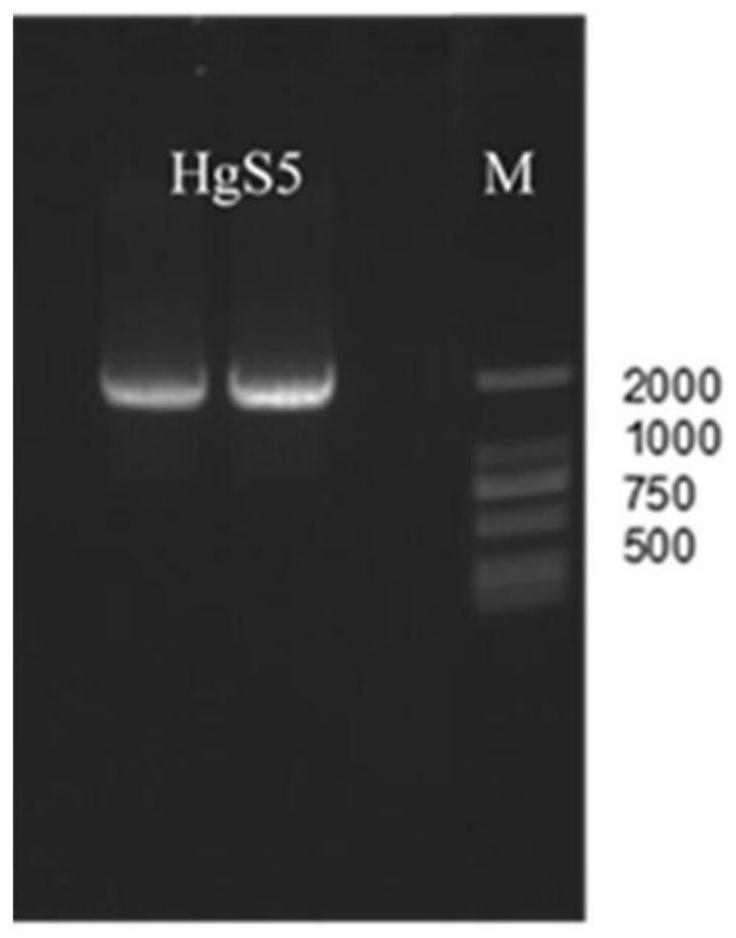
盐生草hgs5基因及其应用
技术领域
[0001]
本发明属于植物生物工程技术领域,具体涉及盐生植物盐生草抗旱基因hgs5及其应用。
背景技术:
[0002]
干旱,从古至今都是人类面临的主要自然灾害,即使在农业科技发达的今天,干旱缺水引起的水分胁迫仍然是限制植物(作物)高产稳产的主要因素,随着人类的经济发展和人口增长,水资源短缺现象日趋严重,直接或间接导致了干旱地区的扩大与干旱化程度的加剧,干旱化趋势已成为全球关注的焦点。尤其是我国西北地区,干旱对农业生产的影响更加严重。
[0003]
发展干旱区节水农业,实现我国西北干旱区农业的可持续发展势在必行。除了大力发展水利设施,改善作物生长环境外,培养抗旱性强的作物新品种意义重大。抗旱作物新品种的培育主要通过传统杂交育种和生物技术育种两种途径实现,而生物技术育种具有针对性强、育种速度快、育种效率高等优势,受到育种家的重视和推广,但就传统作物而言,大多数作物抗旱性较差,遗传基础狭窄,优异抗旱基因的发掘已成为作物抗旱育种成败的关键限值性因素。我国西北旱区分布着大量耐旱乡土野生植物,如肉苁蓉、木地肤、沙冬青、沙拐枣、盐生草等,这些植物蕴含着丰富的抗旱基因,发掘这些本土抗旱基因资源,对加快我国抗旱作物新品种培育进程具有重要价值。
[0004]
盐生草(halogeton glomeratus)属藜科一年生草本,是我国西北旱区广泛分布的抗旱耐盐先锋植物,抗旱耐盐性强,其耐盐机制主要包括盐分液泡区隔化和根系盐分限制性吸收两方面,在抗旱耐盐基因发掘发面优势明显,但关于盐生草中抗旱耐盐基因发掘方面的研究严重滞后,急需加强。
[0005]
现有技术存在的问题:盐生草的全基因组尚未公布,现有技术中也未见盐生草hgs5基因及其抗旱性的应用。
技术实现要素:
[0006]
鉴于现有技术的不足,本发明提供了盐生草hgs5基因及其在抗旱性方面的应用。
[0007]
为了达到上述目的,本发明采用了如下的技术方案:
[0008]
1.盐生草hgs5基因,该基因全长序列如序列表所示,其cdna编码序列为seq id no.1 中第298至第1407位所述的核苷酸序列,包含1110bp。编码的氨基酸序列由370个氨基酸组成,如seq id no.2。
[0009]
2.盐生草hgs5基因的克隆获取方法,包括如下步骤:(1)序列信息获得;(2)hgs5 基因克隆;(3)hgs5-pmd19-t转化大肠杆菌感受态细胞;(4)筛选蓝白斑并测序;(5)测序合适的菌液保存于甘油中。
[0010]
3.盐生草hgs5基因功能的验证方法,包括如下步骤:(1)基因hgs5过表达载体的构建;(2)农杆菌介导拟南芥转化与培养方法;(3)转hgs5基因拟南芥抗旱性鉴定。
[0011]
4.盐生草hgs5基因在提高植物抗旱性中的应用。
[0012]
有益效果:本发明提供了hgs5基因序列,从抗旱、耐盐植物盐生草中克隆到一个新的抗旱基因,进一步转化拟南芥进行抗旱性鉴定,结果证实转化hgs5基因的拟南芥株系抗旱性大幅度提升。hgs5其分子量不到2000bp,基因小,便于遗传转化操作,本发明中抗旱基因hgs5的获得为抗旱作物、植物新品种的培育提供了珍贵的基因资源。
附图说明
[0013]
图1:基因hgs5 cdna扩增图;其中:m:d2000 marker;1-2为hgs5基因pcr产物。
[0014]
图2:载体构建菌落pcr电泳图;其中,m:dl 2000dna marker;箭头所指1-5都是连接过表达载体后可成功扩增到目的基因的菌落pcr产物。
[0015]
图3:过表达载体双酶切验证图;其中,酶切位点为kpn i和bamh i。
[0016]
图4:抗性植株pcr检测电泳图;其中,标号“1”至“12”均为抗性苗编号,
“-”
为纯水空白对照,“+”为质粒对照,“wt”为野生型植株对照,“m”为dl 2000dna marker。
[0017]
图5:t1代抗旱性验证;其中,对转基因拟南芥和野生型拟南芥进行抗旱处理,分别在处理0d、3d、6d、9d、12d拍照,上一排是野生型拟南芥wt,下一排是转hgs5基因拟南芥。
[0018]
图6:t2代抗旱性验证;其中,对转基因拟南芥和野生型拟南芥进行抗旱处理,分别在处理0d、3d、6d、9d、12d拍照,上一排是野生型拟南芥wt,下一排是转hgs5基因拟南芥。
[0019]
图7:t2代抗性植株pcr检测电泳图;其中,m:dl 15000+2000dna marker;wt为野生型拟南芥为对照。
具体实施方式
[0020]
为使发明的目的、技术方案和优点更加清楚,下面结合附图对本发明的具体实施方式进行详细说明。这些优选实施方式的示例在附图中进行了例示。附图中所示和根据附图描述的本发明的实施方式仅仅是示例性的,并且本发明并不限于这些实施方式。
[0021]
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明的技术方案,在附图中仅仅示出了与根据本发明的方案密切相关的结构和/或处理步骤,而省略了关系不大的其他细节。
[0022]
实施例1
[0023]
本实施例提供盐生草hgs5基因,该基因全长序列如序列表所示,其cdna编码序列为 seq id no.1中第298至第1407位所述的核苷酸序列,包含1110bp。编码的氨基酸序列由370个氨基酸组成,如seq id no.2。
[0024]
实施例2
[0025]
本实施例提供盐生草hgs5基因的克隆获取方法,包括如下步骤:
[0026]
1.序列信息获得:依据2015年盐生草盐胁迫响应转录组学测序结果(transcriptomicprofiling ofthe salt-stress response in the halophyte halogeton glomeratus[j].bmcgenomics,2015, 16(1):169)为依据,鉴定到盐胁迫诱导表达基因hgs5。
[0027]
2.hgs5基因克隆:申请人以盐生草叶片为材料,分离出hgs5基因。
[0028]
所述的盐生草抗旱基因hgs5的制备方法,其主要特点在于步骤为:
[0029]
(1)以200-500mm nacl胁迫处理3-7d盐生草幼苗的叶片为材料,trizol法提取总rna,采用cdna合成试剂盒(大连宝生物工程有限公司),反转录合成cdna第一链,扩增该基因片段。在所述的盐生草抗旱基因hgs5的上下游引物上分别添加kpn i和bamh i这两个酶切位点。
[0030]
上游引物f1为5
’-
ggggtaccgacgttgtttccagcccacttc-3
’
[0031]
下游引物r1为5
’-
cgggatccagaatgttaaacactttacaatac-3
’
[0032]
pcr反应体系为:
[0033][0034]
扩增程序为:
[0035][0036]
pcr扩增产物电泳如附图1所示。
[0037]
(2)利用胶回收试剂盒(大连宝生物工程有限公司;gel extraction mini kit)回收pcr 产物,接着将回收产物与pmd19-t(大连宝生物工程有限公司)载体连接,具体操作步骤是将1μl的pmd19-t vector(simple)载体、4μl回收产物和5μl的solutionⅰ在小pcr管中缓慢混匀,轻离心3sec,16℃水浴静置,过夜连接,次日取至4℃保存,得到连接液。
[0038]
3.hgs5-pmd19-t转化大肠杆菌感受态细胞
[0039]
1)制备lba培养基平板(含有100μg/ml氨苄青霉素amp),将20μl iptg和80μl x-gal混匀后,均匀地涂布在每个平板上,避光晾干备用;
[0040]
2)从-80℃取出dh5α感受态细胞,立即放入冰盒,冰上进行融解;
[0041]
3)取5μl过夜连接液加入到50μl感受态细胞中,轻弹管底混匀,置于冰盒冰浴30min;
[0042]
4)于42℃水浴锅热激90s,迅速放入冰盒,冰浴3min,期间操作需平稳;
[0043]
5)向离心管中加入400μl lb液体培养基,摇床37℃200rpm培养1-1.5h;
[0044]
6)吸取离心管中菌液,均匀地涂布在第一步制备好的平板上(一个平板涂200μl菌
液),稍晾干,密封倒置于37℃黑暗环境下培养过夜。
[0045]
4.筛选蓝白斑并测序(测序结果如序列表所示)
[0046]
1)将10ml lb培养基(含有100μg/ml氨苄)加入50ml离心管(已灭菌);
[0047]
2)将转化平板上的白色单菌落用牙签(已灭菌)随机挑取若干,分别置于离心管中,密封管口,于37℃200rpm黑暗条件下培养过夜;
[0048]
3)吸取出1μl菌液为模板进行pcr检测;
[0049]
4)将pcr检测正确的菌液进行测序。
[0050]
5.测序合适的菌液保存于甘油中。
[0051]
实施例3
[0052]
本实施例提供盐生草hgs5基因的应用,包括如下步骤:
[0053]
一、基因hgs5过表达载体的构建
[0054]
1.吸取5μl实例2最终得到的甘油菌,于10ml lb液体培养基(含有100μg/ml氨苄青霉素amp)中,37℃200rpm黑暗条件下培养过夜培养12h,提取质粒;
[0055]
2.同时,提取过表达载体pcambia2301的质粒,进行双酶切;
[0056]
用kpn i和bamh i两种内切酶对所提质粒进行双酶切。
[0057]
酶切体系为:
[0058][0059][0060]
总体积20μl在37℃酶切3h,并对酶切产物进行纯化。
[0061]
3.接着用t4 dna连接酶,对纯化回收的载体及目的片段进行连接。
[0062]
连接体系为:
[0063]
10
×
t4 dna ligase
ꢀꢀꢀꢀꢀꢀꢀ
1ul
[0064]
目的片段hgs5基因
ꢀꢀꢀꢀꢀꢀꢀꢀ
7ul
[0065]
载体pcambia2301 dna
ꢀꢀꢀꢀꢀ
1ul
[0066]
总体积9μl。在65℃水浴保温3min,即可冰浴1-2min,然后加t4 dna ligase 1ul于16℃连接12-16h。
[0067]
4.将连接液pcambia2301-hgs5转化大肠杆菌dh5α感受态细胞。
[0068]
1)制备lba培养基平板(含有100μg/ml氨苄青霉素amp),将20μl iptg和80μl x-gal混匀后,均匀地涂布在每个平板上,避光晾干备用;
[0069]
2)从-80℃取出dh5α感受态细胞,立即放入冰盒,冰上进行融解;
[0070]
3)取5μl过夜连接液加入到50μl感受态细胞中,轻弹管底混匀,置于冰盒冰浴30min,
[0071]
4)于42℃水浴锅热激90s,迅速放入冰盒,冰浴3min,期间操作需平稳;
[0072]
5)向离心管中加入400μl lb液体培养基,摇床37℃200rpm培养1-1.5h;
[0073]
6)吸取离心管中菌液,均匀地涂布在第一步制备好的平板上(一个平板涂200μl菌
液),稍晾干,密封倒置于37℃黑暗环境下培养过夜。
[0074]
5、筛选蓝白斑,菌液pcr检测(如附图2),甘油菌保存。
[0075]
1)将10ml lb培养基(含有100μg/ml氨苄)加入50ml离心管(已灭菌);
[0076]
2)将转化平板上的白色单菌落用牙签(已灭菌)随机挑取若干,分别置于离心管中,密封管口,于37℃200rpm黑暗条件下培养过夜;
[0077]
3)吸取出1μl菌液为模板进行pcr检测;
[0078]
4)检测合适的菌液保存于甘油中。
[0079]
6、吸取5μl甘油菌,于10ml lb液体培养基(含有100μg/ml氨苄青霉素amp)中, 37℃200rpm黑暗条件下培养过夜培养12h,提取重组质粒。
[0080]
7、对重组质粒在37℃酶切3h。
[0081]
其双酶切体系为:
[0082][0083][0084]
总体积20μl。并对双酶切产物进行电泳检测(如附图3所示)。
[0085]
将该基因构建过表达载体,转化到模式植物拟南芥。经验证该基因具有显著提高植株的耐旱性的能力。利用本发明所述基因hgs5,构建各种植物表达载体,可广泛应用于转基因植物(作物)抗旱新品种的培育。
[0086]
二、农杆菌介导拟南芥转化与培养方法
[0087]
1、制备lba4404农杆菌并活化,将重组质粒pcambia2301-hgs5转入感受态农杆菌中,制备农杆菌浸染液。
[0088]
2、采用蘸花法侵染拟南芥花序,然后将侵染的植株覆盖塑料薄膜避光培养24h后移至温室中22℃、湿度约70%,16小时光照条件下养护,待拟南芥成熟后分单株收获t0代种子。
[0089]
3、将收获的转基因拟南芥t0代种子低温处理、灭菌后撒播在含抗生素kan(40ug/ml)的 1/2ms固体培养基中筛选抗性苗,并移栽培养,待幼苗长大后,随机剪取植株叶片提取dna,常规pcr扩增目的基因,扩增产物电泳(如附图4所示),并与含有目的基因的载体质粒对比确认。
[0090]
pcr检测引物:
[0091]
上游引物:35s-f:gacgcacaatcccactatcc
[0092]
下游引物:hgs5-r cgggatccagaatgttaaacactttacaatac
[0093]
pcr扩增体系:
[0094][0095]
总体积25μl
[0096]
pcr扩增程序:
[0097][0098][0099]
三、转hgs5基因拟南芥抗旱性鉴定
[0100]
1、将所获得的11株t0代阳性苗常规培养至收种,将t1代转hgs5基因拟南芥种子和野生型拟南芥(wt)种子播种于培养基质(草炭:蛭石:珍珠岩为1:3:0.5体积比混合)中,在人工温室中培养,待幼苗长至1个月后,停止浇灌营养液,进行自然干旱处理,并观察幼苗生长情况(如附图5所示),结果发现,转hgs5基因拟南芥生长速度明显快于野生型拟南芥,在干旱处理6d时,野生型拟南芥植株开始出现萎蔫,转基因拟南芥正常生长,9d时野生型拟南芥严重萎蔫,转基因拟南芥只有部分萎蔫,到11d时野生型拟南芥已完全枯死,转基因拟南芥萎蔫程度加重,未完全枯死。
[0101]
2、将收获的转基因拟南芥t2代种子和野生型拟南芥(wt)种子播种于培养基质(草炭:蛭石:珍珠岩为1:3:0.5体积比混合)中,在人工温室中培养,待幼苗长大后,随机剪取植株叶片提取dna,常规pcr扩增目的基因,并和野生型拟南芥进行比对,扩增产物电泳(如附图7所示),pcr检测引物:
[0102]
上游引物:35s-f:gacgcacaatcccactatcc
[0103]
下游引物:hgs5-r cgggatccagaatgttaaacactttacaatac
[0104]
pcr扩增体系:
[0105][0106]
总体积25μl
[0107]
pcr扩增程序:
[0108][0109]
待幼苗长至1个月后,停止浇灌营养液,进行自然干旱处理,并观察幼苗生长情况(如附图6所示),结果发现,转hgs5基因拟南芥生长速度明显快于野生型拟南芥,在干旱处理6d时,野生型拟南芥植株开始出现萎蔫,转基因拟南芥正常生长,9d时野生型拟南芥严重萎蔫,转基因拟南芥只有部分萎蔫,到11d时野生型拟南芥已完全枯死,转基因拟南芥萎蔫程度加重,未完全枯死。
[0110]
以上所述仅是本申请的具体实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



