通用的指示模板浓度的内标组合物及应用的制作方法
 2021-02-02 01:02:40|
2021-02-02 01:02:40| 239|
239| 起点商标网
起点商标网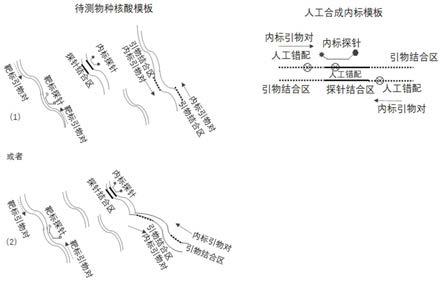
[0001]
本发明属于荧光探针法检测技术领域,具体涉及一种通用的指示模板浓度的内标组合物及应用。利用一对内标引物、一条内标探针和一个人工合成的内标核酸模板组成一套内标系统,除行使内标本职功能外,还可以对模板浓度进行指示,辅助结果分析和下一步实验计划调整,此外这套内标方案可通用于以荧光pcr为基础的不同检测系统。
背景技术:
[0002]
实时荧光定量pcr技术于1996年由美国applied biosystems公司推出,它是一种在pcr扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。探针完整时,报告荧光基团发射的荧光信号被淬灭荧光基团吸收;pcr扩增时,taq酶的5
′
-3
′
外切酶活性将探针酶切水解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积与pcr产物形成完全同步。该技术不仅实现了对dna模板的定量,而且具有灵敏度高、特异性和可靠性强、能实现多重反应,自动化程度高、无污染性、具实时性和准确性等特点,目前已广泛应用于分子生物学研究。
[0003]
内标是指在同一反应管中与靶序列共同扩增的一段非靶序列分子。内标有两种形式,一种是使用天然样品中含有的内参基因作为内标,另一种是人工添加的内标。相对于后者而言,前者的最大特点是内标模板序列是纯天然的,而后者人工添加的内标多为不同序列组合而成,组合单元可以是纯天然的序列也可以是人工自定义序列。
[0004]
现将常用的内标作如下比较,1) 内参基因作为内标:内标引物和内标探针直接扩增待测物种的管家基因,和靶标检测特异引物、探针同时扩增待测物种核酸不同区域,两套引物探针系统相互独立,两者竞争关系只限于对pcr资源(聚合酶,dntps,镁离子等)的抢夺,但在反应体系中这些pcr资源对于重数一定的pcr而言往往是足够的,故而竞争就不是那么激烈,因此所述内标系统仅发挥内标的基本功能,对待测物种核酸模板浓度高低则没有指示效果;另外阴性对照孔内因没有待测物种核酸,所以内标和靶标均无信号,此时的阴性对照相当于是“失控状态”,无法判断是真阴性还是由于配制错误,反应组分缺失或反应孔温控失败等原因所致。
[0005]
2) 人工添加的合成内标:通过在体系中加入一种人工自定义序列,其序列和待测物种核酸序列无关。现在国内外的诊断试剂盒大部分都会将外源人工合成内标直接添加在反应液中与待测物种核酸一起扩增,内标引物和内标探针不会对待测物种基因组核酸发生扩增反应,只针对人工合成的内标进行扩增,同理,待检靶标检测特异引物、探针也仅扩增待测物种基因组核酸,相比直接选用内参基因作为内标的情形,该方法进一步将扩增模板也独立开来,优势在于将阴性对照孔纳入了监控范围,但同样对待测物种核酸模板浓度高低没有指示效果。
[0006]
3) 人工添加和待测靶标共用扩增引物的内标:通过在体系中加入一种和待测靶标共用扩增引物但内标探针和靶标探针相互独立的内标系统,如《鼠疫实验室技术手册》中
提及的pla基因检测系统,引物共用,内标和待测靶标探针各自独立,两个通道各自收集内标和靶标检测信号,此种设计主要是用来规避并识别假阳性和假阴性结果,内标和靶标共用扩增引物,内标扩增和靶标扩增之间存在引物资源竞争,这种竞争会影响到靶标检测灵敏度即检测下限,所以此种方法中共用引物通常在一个过饱和的浓度值,以减少对共用引物的竞争抢夺效应。
[0007]
鉴于上述内标各自的缺陷,因此,亟需建立一种内标,既能发挥一般内标的监测功能,同时还对模板浓度进行指示且内标扩增不会对靶标检测灵敏度产生影响,同时又将阴性对照孔纳入监控范围内,而且能在不同的特异靶标检测系统间实现通用。
技术实现要素:
[0008]
pcr检测时,为消除外部干扰因素(如抑制物、扩增体系配制错误、扩增程序设定错误等)对待测核酸检测的影响,通常选择加入内标,进行外部干扰因素影响的监测。目前常规内标方法种类如背景技术中所述,三种内标方案均有各自的缺陷。
[0009]
相对于现有技术,本发明提供一种内标组合物,实现现有内标方法的正常监测功能,确保监测全面性;并巧妙设计人工合成的内标模板,其是由不同天然序列拼接而成,天然序列常选自待测物种的管家基因,如将人工合成内标模板分成前中后三段区域,其中前后区域含有内标引物结合区,常选自同一个管家基因,中间区域含有内标探针结合区,常选自另一个管家基因。这一核心设计使得内标引物不仅能和人工合成内标结合并扩增,还能与待测物种核酸模板产生扩增反应,但需注意的是此扩增反应不是靶标检测反应(以下简称为副反应),由于内标探针结合区和内标引物结合区选自待测物种不同管家基因,所以内标探针将结合于内标引物在待测物种核酸上形成的扩增区之外的区域,因此副反应是一个无荧光信号释放的反应,体系中的内标信号仅来自于内标引物、内标探针对人工添加内标模板的扩增反应(以下简称内标扩增反应),正是由于这一巧妙设计,内标扩增反应和副反应之间存在对内标引物、内标探针的竞争抢夺关系,内标扩增反应强度和副反应的扩增强度将呈现此消彼长的态势,通常体系中人工添加内标模板浓度是固定的,内标扩增反应强度则取决于对有限短缺的内标引物、内标探针的消耗占比,副反应的扩增强度则和待测物种核酸模板浓度呈正相关,所以两者扩增强度差异最终分别对应内标信号值和待测物种核酸模板浓度,从而实现通过内标信号值来指示待测物种核酸模板浓度的效果。
[0010]
相对于《鼠疫实验室技术手册》中提及的pla基因检测系统,针对内标和靶标共用引物设计方案的固有缺陷,本发明的设计则通过内标扩增反应和副反应间共用内标引物、内标探针,使得内标引物、探针系统和靶标检测特异引物、探针系统完全独立,从而内标扩增不会对靶标检测产生影响,成功规避这一风险。
[0011]
本发明的技术方案为,通用的指示模板浓度的内标组合物,以待测物种核酸为模板进行检测,含有:人工合成的内标模板,分别同人工合成的内标模板及待测物种核酸模板配对的内标引物对,分别同人工合成的内标模板及待测物种核酸模板配对的内标荧光探针,内标荧光探针同待测物种核酸模板的结合区不在内标引物对在待测物种核酸模板的扩增区之间,且内标引物对与内标荧光探针同靶标基因检测用的靶标引物对与靶标荧光探针相互独立,互不干扰。
[0012]
所述人工合成的内标模板通常选自待测物种的管家基因,由不同管家基因拼接而
成,如将人工合成的内标模板分成前中后三段区域,其中前后区域含有内标引物结合区,常选自同一个管家基因,中间区域含有内标探针结合区,常选自另一个管家基因,即在某一管家基因中拼接插入另一管家基因,管家基因有actb基因、gapdh基因或rnase p基因,但不限于此。
[0013]
所述内标引物对在人工合成的内标模板形成的扩增产物长度大于或等于内标引物对在待测物种核酸模板上形成的扩增产物长度,短片段有扩增相对优势,以利于提高内标荧光信号对待测物种核酸模板浓度指示敏感度。
[0014]
本发明所述内标引物探针系统中,在人工合成内标模板上引物结合区、和/或探针结合区引入错配碱基,增加内标引物对扩增人工合成内标模板和待测物种核酸模板的不平衡性,内标引物探针系统同待测物种核酸模板的结合效能优于人工合成的内标模板,以使内标荧光信号对待测物种核酸模板浓度变化敏感度进一步提升。人工合成的内标模板引入错配碱基数量为1~6个碱基,错配碱基的数量越多,内标引物探针系统对待测物种核酸模板的浓度变化越敏感;错配碱基可同时引入至人工合成的内标模板的引物结合区和探针结合区,也可单独仅引入至引物结合区,亦可单独仅引入至探针结合区,错配碱基优选同时引入至引物结合区和探针结合区;引入至引物结合区的错配碱基可以是两条引物分别互补配对的引物结合区,也可以是其中任一引物互补配对的引物结合区,引物结合区的错配碱基优选同时引入至两条引物的结合区。错配碱基的引入位置可以在引物结合区和/或探针结合区的任意位置,引物结合区错配碱基的引入位置优选靠近引物的3
′
端倒数第2-5位,探针结合区引入的错配碱基靠近内标探针的中心三分之二区域,以使内标用引物探针系统对待测物种核酸模板的浓度变化更敏感。错配碱基的数量不可过多,分布尽量均匀,不可多个错配碱基集中分布于同一引物或探针的互补配对结合区,以保证人工合成的内标模板能顺利扩增并产生荧光信号。
[0015]
采用本发明所述内标组合物进行检测时,内标引物的浓度和内标探针浓度分别在一个相对较低的浓度范围内,因为过高浓度的引物和探针浓度会弱化内标扩增反应和副反应间的竞争关系。具体地,采用本发明所述内标组合物进行检测时,内标引物对中每条引物浓度不大于0.15μm,优选为不大于0.1μm,更优选为0.01~0.1μm,进一步优选为0.05~0.1μm,作为优选方案为0.08 μm;内标荧光探针浓度不大于0.15μm,优选为不大于0.1μm,更优选为0.01~0.1 μm,进一步优选为0.05~0.1 μm,作为优选方案为0.08 μm。在较低的引物探针浓度下,人工合成内标模板和待测物种核酸模板对有限的内标引物对、内标荧光探针竞争抢夺越发激烈,提高内标荧光信号对待测物种核酸模板浓度变化的敏感度。
[0016]
本发明所述人工合成的内标模板可以是环状质粒:人工合成目的序列,装至载体并转入工程菌,经培养富集提取质粒;也可以是线性双链dna:人工直接合成或融合pcr拼接获得。
[0017]
本发明所述内标引物对中每条引物为普通无标记引物,长度为18-40个碱基,tm值为52-62℃,根据程序的退火温度选择合适的tm值进行设计,避免自身形成二级结构或引物之间相互配对形成二聚体等;引物对扩增产物长度为50-250碱基对,优选在100碱基对以内。
[0018]
本发明内标荧光探针基于荧光共振能量传递原理,一端为荧光报告基团,另一端为荧光淬灭基团,当探针完整时,5
′
端报告基团经仪器光源激发的荧光正好被近距离的3
′
端荧光基团淬灭,仪器检测不到5
′
端报告基团所激发的荧光信号,即5
′
端荧光基团的发射波长正好是3
′
端荧光基团的吸收波长,因而能量被吸收传递到3
′
端荧光基团而发出其它荧光。
[0019]
本发明内标荧光探针遵循本领域技术人员所熟知的探针设计一般原则,可以是普通taqman探针,也可以是结构探针,如分子信标或杂交fret探针,但并不限于于此。探针修饰可以是化学物质,如mgb;也可以是非天然核苷酸,如锁核酸;但探针修饰并不限于本发明列举,只要同本发明列举功效或作用相同的其他修饰均包含在本发明的保护范围内;本发明根据探针gc含量和探针修饰不同设定不同的探针长度,探针长度在13-30个碱基,探针tm值在65-72℃,比引物的tm高5-10℃。
[0020]
如本发明实施例所示,通用的具有模板浓度指示功能的内标组合物含有:人工合成内标核酸模板:actb-rnase p-质粒 (seq id no.4),内标引物对:actb-94-19-57.9-f 引物(seq id no.1)与actb 343-20-58-r 引物(seq id no.2),及内标荧光探针:us rnase p 探针(seq id no.3)。
[0021]
本发明内标组合物可用于构建pcr荧光法的内标检测系统或试剂盒,可直接、客观指示待测物种核酸模板浓度,利于辅助分析结果和调整下一步实验计划。
[0022]
使用本发明内标组合物可进行基因定性检测和/或定量检测,基因定性检测包含但不限于基因突变检测及基因拷贝数变异检测,基因突变检测包括但不限于dna和/或rna基因突变的种类检测,基因拷贝数变异检测包括但不限于dna和/或rna的拷贝数变异检测。
[0023]
本发明提供的通用的指示模板浓度的内标组合物,不仅可有效监测管内抑制物、扩增体系配制错误和扩增程序设定错误等,包括阴性对照孔也在监控范围内,实现内标监测的全面性,而且可以直接指示体系中待测物种核酸浓度,及时辅助结果分析和下一步实验计划调整,且该内标组合物在不更换待测物种情形下只需建立一次,即可用于以荧光pcr为基础的针对不同靶标的特异检测系统,无需重复开发,节省成本,提高产品开发效能,避免资源浪费。
附图说明
[0024]
图1为本发明的原理示意图。
[0025]
图2为本发明实施例1通用的具有模板浓度指示功能的内标系统功能测试结果图。
[0026]
图3为本发明实施例2将通用的具有模板浓度指示功能的内标系统应用于slco1b1基因rs4149056(t/c)snp位点检测结果图。
具体实施方式
[0027]
为了便于理解本发明,通过以下实施例对本发明进行说明,但不构成对本发明的限制。
[0028]
实施例1:如图1所示,人工合成模板中,内标引物、内标探针克服错配进行扩增,产生荧光信号;待测物种核酸中,(1)模式,内标引物完全匹配待测物种核酸进行扩增,内标探针完全匹配于另外染色体上,无法产生荧光信号;(2)模式,内标引物完全匹配待测物种核酸进行扩增,内标探针完全匹配于同一染色体上但在扩增区域之外,同样无法产生荧光信号;人工合成模板与待测物种核酸模板竞争内标引物对和内标探针,待测物种核酸越多,加
上碱基完全匹配,竞争中占优势,最终导致和人工合成模板结合的引物探针就越少,内标荧光信号越低,间接反应待测核酸浓度。按照图1所示原理,进行一种通用的具有模板浓度指示功能的内标系统功能测试。
[0029]
引物扩增结合人actb基因,探针结合人rnase p基因,人工序列首尾为actb基因序列,中间为rnase p基因序列,引物探针及人工合成模板序列如下,探针采用rox荧光标记。
[0030]
actb-94-19-57.9-f引物(actb-94-19-57.9-f primer,seq id no.1):caccccagccatgtacgtt;actb 343-20-58-r 引物(actb 343-20-58-r primer,seq id no.2):ggccatctcttgctcgaagt;us rnase p 探针(us rnase p probe,seq id no.3):5
′
rox-ttctgacctgaaggctctgcgcg-3
′
bhq2;actb,rnase p-质粒人工合成模板(seq id no.4):cccgaggagcaccccgtgctgctgaccgaggcccccctgaaccccaaggccaaccgcgagaagatgacccagatcatgtttgagaccttcaacaccccagccatgtacgatgctagatttggacctgcgagcgggttctgacctgaaggctctgcgaggacttgttcgaacacataaagatttgctgggatattggaaaaactggcggagaggatgggattcgaacccacgagacccttttgaggtctactcccttagcaggggagcgccttcgaccactcatcgtgcgtgacattaaggagaagctgtgctacgtcgccctggacatcgagcaagagatggccacggctgcttccagctcctccctggagaagagctacgagctgcctgacggccaggt;注:人工合成模板序列中小写字母为人工错配碱基。
[0031]
人工合成模板是质粒形式,交由生工生物工程(上海)股份有限公司合成,稀释至目标浓度后备用,另外人源模板是提取自hela细胞的基因组dna,经紫外分光光度计测定浓度后备用,按下述实验组进行实验设计。
[0032]
实验组1:人工合成模板(2.5
×
10
4 copies/μl)加入体积0.4μl,hela基因组(15 ng/μl)加入体积0μl,hela基因组加入总量0 ng;实验组2:人工合成模板(2.5
×
10
4 copies/μl)加入体积0.4μl,hela基因组(15 ng/μl)加入体积1μl,hela基因组加入总量15 ng;实验组3:人工合成模板(2.5
×
10
4 copies/μl)加入体积0.4μl,hela基因组(15 ng/μl)加入体积2μl,hela基因组加入总量30 ng;实验组4:人工合成模板(2.5
×
10
4 copies/μl)加入体积0.4μl,hela基因组(15 ng/μl)加入体积3μl,hela基因组加入总量45 ng;实验组5:人工合成模板(2.5
×
10
4 copies/μl)加入体积0.4μl,hela基因组(63 ng/μl)加入体积1μl,hela基因组加入总量63 ng;实验组6:人工合成模板(2.5
×
10
4 copies/μl)加入体积0.4μl,hela基因组(63 ng/μl)加入体积2μl,hela基因组加入总量126 ng;实验组7:人工合成模板(2.5
×
10
4 copies/μl)加入体积0.4μl,hela基因组(63 ng/μl)加入体积3μl,hela基因组加入总量189 ng;实验组8:人工合成模板(2.5
×
10
4 copies/μl)加入体积0.4μl,hela基因组(63 ng/μl)加入体积4μl,hela基因组加入总量252 ng。
[0033]
反应液配制:hela基因组,0~4μl;2
×ꢀ
taqman通用混合剂ii及ung(2
×ꢀ
taqman universal master mix ii,with ung),5μl;actb-94-19-57.9-f 引物(10μm),0.08μl;
actb 343-20-58-r 引物(10μm),0.08μl;us rnase p 探针(10μm),0.08μl;人工合成模板(2.5
×
10
4 copies/μl),0.4μl;最后加水至10μl。
[0034]
操作步骤:按上述反应液体系配制进行相关液体配制,震荡混匀15秒,快速离心15秒,将pcr反应管放置于实时pcr仪器中。
[0035]
实时pcr反应在ab 7500 fast上进行。
[0036]
第一阶段:50℃ 2min, 1 个循环;第二阶段:95℃ 10min, 1 个循环;第三阶段:95℃ 15s, 60℃ 1min,50 个循环。
[0037]
结果如图2所示,随着待测物种核酸浓度递增,内标荧光信号值越来越低,和人工合成模板浓度具有很好的对应关系,且信号值和待测物种核酸模板浓度呈反比关系。
[0038]
实施例2:按照图1所示原理,将一种通用的具有模板浓度指示功能的内标系统应用于slco1b1基因rs4149056(t/c)snp位点检测;pcr模板为细胞系基因组dna。
[0039]
slco1b1基因rs4149056(t/c)snp位点检测引物、探针如下:rs4149056上游引物(seq id no.5):aatctgggtcatacatgtggatatat;rs4149056下游引物(seq id no.6):tgtttaaaggaatctgggtcatacat;rs4149056-t探针(seq id no.7):5
′ꢀ
fam
-ꢀ
catgaacacatatatc
ꢀ-3′-
mgb;rs4149056-c探针(seq id no.8):5
′ꢀ
vic
-ꢀ
catgaacgcatatatc
ꢀ-3′-
mgb;注:内标系统的引物、探针和人工合成模板序列如实施例1所述。
[0040]
实验设计:共检测三个野生纯合样本,浓度分别为150,75,37.5ng/μl;按如下体系进行反应液配制:h2o,纯化水,15.9μl;5
×ꢀ
pcr缓冲液(mg
2+ plus),5μl;dntps(各自10mm datp,dctp,dgtp;20mm dutp),10mm,0.5μl;rs4149056上游引物,100μm,0.1μl;rs4149056下游引物,100μm,0.1μl;rs4149056-t探针,100μm,0.05μl;rs4149056-c探针,100μm,0.05μl;udg,1u/μl,0.1μl;actb-94-19-57.9-f 引物,10μm,0.2μl;actb 343-20-58-r 引物,10μm,0.2μl;us rnase p 探针,10μm,0.2μl;人工合成模板,2.5
×
10
4 copies/μl,0.4μl;聚合酶,5u/μl,0.2μl;总体积23μl。
[0041]
操作步骤:按上述反应液体系配制进行相关液体配制,震荡混匀15秒,快速离心15秒,以每管23μl分装至pcr反应管中,分别加入需要检测的样本2μl,然后小心盖上pcr管盖,快速离心数秒,将pcr反应管放置于实时pcr仪器中。
[0042]
实时pcr反应在ab 7500荧光定量pcr仪上进行。
[0043]
第一阶段:37℃ 2min, 1 个循环;第二阶段:95℃ 5min, 1 个循环;第三阶段:95℃ 15s, 60℃ 45s,40 个循环。
[0044]
结果如图3所示,纯合野生样本,仅出现fam信号的扩增曲线,另外随着样本浓度成倍递增,扩增ct值逐一变小,内标信号荧光值逐一下降,对核酸模板浓度起到了很好的指示作用。
[0045]
由实施例1和实施例2的结果可知,本发明所述内标系统不仅可有效监测管内抑制物、扩增体系配制错误和扩增程序设定错误等,包括阴性对照孔也在监控范围内,而且可以指示体系中待测物种核酸模板浓度,辅助结果分析和下一步实验计划调整。此外这套内标方案可通用于以荧光pcr为基础的不同检测系统,具有很好的适配性。
[0046]
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



