一种诱导脂肪干细胞定向分化为人皮肤成纤维细胞的方法及用途与流程
 2021-02-02 01:02:49|
2021-02-02 01:02:49| 359|
359| 起点商标网
起点商标网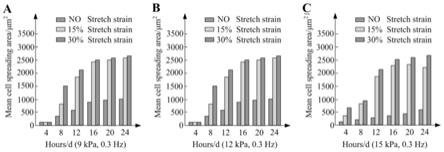
[0001]
本发明属于干细胞技术领域,涉及一种用于诱导脂肪干细胞在模拟体内生长环境下培养及定向分化的方法,尤其涉及一种定向分化为人皮肤成纤维细胞的方法。
背景技术:
[0002]
应用种子细胞修复皮肤损伤是目前研究的热点之一。与骨髓、胚胎和脐带等种子细胞相比,脂肪干细胞(adipose-derived stem cells,adscs)在临床上获取简便微创、产量高,免疫原性低且不存在伦理限制,在特定条件下可定向分化形成皮肤细胞,为临床上皮肤损伤修复提供了新思路。脂肪组织在人体内储量丰富,通过抽脂从中获得的大量脂肪干细胞(adscs),有自我更新增殖及多向分化潜能,可向脂肪细胞、软骨细胞、肌细胞、成骨细胞、神经细胞、神经胶质细胞及胰岛细胞分化,而且可分泌多种促血管生成因子和抗凋亡因子而抗炎、抗氧化,可抵抗氧自由基的损伤,有望成为修复受损的组织和器官的干细胞来源。
[0003]
目前关于adscs的定向分化实验研究已积累了相当程度的数据,临床的相关应用大部分研究关注了adscs的定向成脂、成骨分化,但是目前这些定向分化的方法大多都是采取的生化方法。传统研究中,单纯的生化方法诱导效率低且不稳定,同时尚未考虑皮肤细胞微环境中异常复杂力学因素。在血管组织工程早期研究中,人造血管的生物力学性能研究严重匮乏,导致人造血管难于适应生理微环境中的力学因素变化,在体内承受反复脉动等生理负荷下中容易破裂或散边。同理,用生化方法诱导adscs分化形成的皮肤细胞,能否承受生理强度的力学载荷及其力学适应性未知,在临床实践中用于皮肤损伤修复时,也可能不适应细胞微环境中不断变化的多种力学因素的作用。
[0004]
随着科学的不断发展,力学微环境决定干细胞命运的证据逐渐增多,对干细胞体外分化影响的研究已从生化方法拓展至力学因素对干细胞分化的作用,除了可溶性分子之外,力学刺激和细胞外基质(extracellular matrix,ecm)的物理性质也可调节干细胞分化的转录因子的表达,生物力学与生物化学微环境协同调控了干细胞分化。
技术实现要素:
[0005]
本发明提供了一种诱导脂肪干细胞定向分化为人皮肤成纤维细胞的方法及用途,通过本发明的方法能够高效的定向分化得到人皮肤成纤维细胞,并且所得到的人皮肤成纤维细胞具备良好的稳定性、力学性能、耐久性,最重要的是,本发明所分化得到的人皮肤成纤维细胞作为移植物,在生物体中具备良好的皮肤创面修复能力和恢复能力。
[0006]
实现本发明上述目的所采用的技术方案为:
[0007]
一种诱导脂肪干细胞定向分化为人皮肤成纤维细胞的方法,包括以下步骤:(1)、以分离的三代人脂肪干细胞为原材料,对其构建基于3d-mtc的超分辨生物力学平台中并进行培养;
t-test和anova检验对所有数据进行统计学分析,实验中的折线图及柱状图都使用excel绘制。
[0025]
本实施例中所述培养基采用新型3d pa gel,天然的pa gel生物材料细胞基质提供的环境能够模拟细胞在体内生长相似的力学微环境,采用生物相容性好的新型3d pa gel模拟体内细胞生长的基质,通过控制丙烯酰胺与双丙烯酰胺的比例构建adscs反映体内细胞生存的硬度。利用gfp标记的adscs观察分析基底硬度对其特异性分化形成目的细胞的调控作用。为了探寻适用于贴壁细胞存活的细胞外凝胶基质,尝试将细胞微载体引入惰性凝胶网络内部,并对材料优化改善其细胞活性。
[0026]
本实施例中,所述基于3d-mtc的超分辨生物力学平台包括磁化器、黏附在细胞表面的磁球以及外加磁场,磁化器用于对黏附在细胞表面的磁球进行磁化,磁球在外加磁场的作用下产生力矩,并施加在以绿色荧光蛋白标记的三代人脂肪干细胞的表面;其具体构建方法如下:
[0027]
(a)对视野下的椭圆形细胞确定范围,围绕细胞作一个能将细胞全部包含的面积最小的椭圆,以该椭圆长轴为细胞的长轴,建立相应的二维平面。
[0028]
(b)设定平行于细胞长轴方向为二维坐标系的长轴,垂直于细胞长轴方向为短轴,加力方向与长轴之间的角度为θ。
[0029]
(c)在上述的二维坐标的基础上构建三维坐标模型,可对细胞在不同角度进行加力,多模态三维生理力学信号建模及加载模型如图1所示。
[0030]
(d)在脂肪干细胞的表面粘附磁球,磁化器产生一个500ms的脉冲,沿着与细胞平面垂直的z轴方向对黏附在细胞表面的磁球进行磁化,磁球将产生垂直于细胞平面方向的磁化强度(m)大约为2500gauss/ms,磁化2~3次,需要每隔15min对磁球进行重新磁化,以维持其磁场强度和方向不变。
[0031]
(e)对磁球施加一个与细胞长轴成一定角度(0~90
°
)的正弦外磁场,磁感应强度(h),m与h的向量积等于对磁球施加一个正弦力矩(t)拉伸力大小。
[0032]
实施例1
[0033]
对比分析生化方法与力学方法的调控分化能力
[0034]
(a)将三代hadscs作为种子细胞,建立动态化、模块化和标准化的培养体系,分离培养获取充足的细胞用于实验研究,选择合适的培养基有利于维持hadscs的多分化潜能,培养液中的抗生素需对hadscs的细胞表型和分化能力无影响。在hadscs和hs27的培养体系中还需要考虑到细胞接种密度、培养时间及传代次数,低密度种植可避免细胞克隆间的相互作用,更有利于细胞的培养。
[0035]
具体操作如下:以三代hadscs为研究对象,对照实验比较生化方法与力学方法调控hadscs分化形成皮肤成纤维细胞的分化效能及稳定性。具体分组如下:
[0036]
(i)生化组(人皮肤成纤维细胞培养液(f-cm)诱导+hadscs组)
[0037]
(ii)力学组(力学信号加载+hadsc组):
[0038]
(b)对生化组进行酶消化法分离、培养hadscs,皮肤匀浆条件培养基中加入表皮细胞生长因子(20μg/l)诱导培养7d,采用流式细胞仪检测波形蛋白、ck19(角质细胞特异性标记蛋白,为阴性对照)、cd31(cd31为内皮细胞特异性标记蛋白,在成纤维细胞无表达,为阴性对照)的表达;采用以下力学信号:频率:1~3hz;幅度:30%;强度:12kpa;加力时间:
8hours/d;加力角度:90
°
;加力方式:正弦波,将其加载到力学分组的hadscs调控8d。
[0039]
(c)对比检测不同方法调控分化的效能:对分组细胞用显微镜观察hadscs的体积和形状的形态学变化,mtt法检测分化细胞的活力和增殖情况,rt-pcr检测标志物的表达及阳性细胞计数,流式细胞仪检测波形蛋白、ck19、cd31表达,免疫荧光法及westem blot检测分化的皮肤成纤维细胞相关标记蛋白(纤维素、波形蛋白、热休克蛋白hsp47)表达,proanalysis软件分析标志物表达量。
[0040]
(d)在分化效能检测基础上,间隔一定的观测周期(4d/8d/12d/16d/20d/24d),针对两种方法调控hadscs定向分化形成皮肤成纤维细胞的稳定性:采用定性和半定量检测各分组细胞相关的标记基因上调,量化其分化过程和结果的稳定性。
[0041]
检测结果如图2所示,从图2中可以看出利用该平台对adscs施加不同幅度的周期拉伸载荷,当增加载荷幅度时,adscs的增殖明显快于静态培养组,力学加载培养组的分化伸展面积未见明显的平台期,如图2所示;且皮肤成纤维细胞相关的标记基因表达上调。
[0042]
实施例2
[0043]
分化皮肤成纤维细胞的力学性能检测
[0044]
(a)利用已建立的基于3d-mtc的力学性能检测平台,加载不同生理模态的力学信号分组进行对照实验,分别检测生化方法、力学方法调控形成的皮肤成纤维细胞的h2b和特定染色质的拉伸、剪切、压缩形变实验结果,根据该结果进行力学性能对比分析,力学信号加载参数如表1所示。具体分组如下:
[0045]
(
ⅰ
)hs27对照组:静态常规传代hs27;
[0046]
(
ⅱ
)力学组1:正弦波加载于实施例1中通过生化调控hadscs分化成的皮肤成纤维细胞;
[0047]
(
ⅲ
)力学组2:正弦波加载于实施例1中通过力学调控hadscs分化成的皮肤成纤维细胞。
[0048]
表1力学信号加载参数
[0049][0050]
(b)基于3d-mtc的力学性能检测平台对不同方法调控形成的皮肤成纤维细胞的有效弹性模量进行测量,对不同方法调控形成的皮肤成纤维细胞加载一定的力学信号(9~50kpa);根据弹性模量计算方法如公式1所示:
[0051][0052]
其中σ表示线应力,ε表示线应变,c为磁感应常数,h为磁场强度,d为磁球的位移量,r为磁球的半径。
[0053]
计算弹性模量与静态常规传代hs27的弹性模量g0进行比较。
[0054]
分化皮肤成纤维细胞的耐久性测试
[0055]
利用已建立的检测平台加载力学信号,拟将“生理”负荷和“超”负荷分别作用于不同方法调控hadscs形成的皮肤成纤维细胞、静态常规传代hs27。
[0056]
具体分组及加载参数如下:
[0057]
(i)hs27对照组:静态常规传代hs27;
[0058]
(ii)生化组1:“生理”负荷加载于实施例1中生化调控形成皮肤成纤维细胞;
[0059]
(iii)生化组2:“超”负荷加载于实施例1中生化调控形成皮肤成纤维细胞;
[0060]
(iv)力学组1:“生理”负荷加载于实施例1中力学调控形成皮肤成纤维细胞;
[0061]
(v)力学组2:“超”负荷加载于实施例1中力学调控形成皮肤成纤维细胞。
[0062]
表2力学负荷加载参数
[0063][0064]
根据前一部分的实验结果,采用近生理恒定力学负荷加载到对照组分化皮肤成纤维细胞的表面,经过规定的保荷时间(4~8hours/d)后卸载,对生化组和力学组的皮肤成纤维细胞进行多次对比测试,采用自定义编写的软件及spss软件进行统计和分析,根据结果评估生化组和力学组的皮肤成纤维细胞的耐久性。
[0065]
检测结果如图3所示,从图3中可以看出采用本发明的分化方法所得到的皮肤成纤维细胞,具备良好的力学性能和耐久性,明显优于生化组和对照组。
[0066]
实施例3
[0067]
力学因素调控adscs分化的皮肤成纤维细胞移植促进皮肤损伤修复作用的动物实验研究
[0068]
本实施例通过动物实验验证分化的皮肤成纤维细胞的皮肤损伤修复应用效果。
[0069]
(1)将在体外近生理力学微环境中最佳的参数值(频率:1~3hz;幅度:30%;强度:12kpa;加力时间:8hours/d;加力角度:90
°
;加力方式:正弦波)来控制力学信号的输出,培养的三代hadscs、hs27用特定荧光蛋白标记,手术移植于裸鼠脊柱两侧三个1.0cm
×
1.0cm的背部全层皮肤创面模型,裸鼠分为10只/组,对照实验分组如下:
[0070]
(i)空白对照组:细胞培养基注射于裸鼠的皮肤创面;
[0071]
(ii)生化组:经f-cm处理的3
×
106个hadscs移植于裸鼠的皮肤创面;
[0072]
(iii)力学组:经力学加载处理的3
×
106个hadscs移植于裸鼠的皮肤创面。
[0073]
(2)以gfp标记各组细胞,并分别在模型鼠皮肤创面的周围进行皮下注射,追踪观察植入hadscs的存活和生长情况;于注射后1d、5d、9d、13d、17d、21d观察创面愈合情况;于5d、9d、13d拍照利用image j软件测量创面面积。
[0074]
计算创面愈合率如公式2所示:
[0075]
创面愈合率=(原始创面面积-剩余创面面积)/原始创面面积
×
100%(公式2)
[0076]
连续观察记录接种细胞21d内模型鼠创面恢复情况,并统计恢复率,通过记录各组
的愈合曲线对各组的愈合情况进行评价。
[0077]
检测结果如表3所示:
[0078]
表3创面面积测量表
[0079][0080]
从表3中可以看出,在相同的时间条件下,力学组的创面面积相对对照组和生化组而言最小,其修复率最高。
[0081]
其中力学组的修复效果前后对比如图4所示,图4中a为修复前,b为修复后的效果。从图4中可以看出,经修复后皮肤创伤面积有了明显的降低,皮肤损伤状况有了明显好转。
[0082]
模型鼠皮肤损伤情况的评价标准:0级-无变化;i级-皮肤出现点状红斑、脱毛、干性脱皮或出汗减少;ii级-皮肤出现明显红斑、斑状湿性脱皮或中度水肿;iii级-出现融合性湿性脱皮或凹陷性水肿;iv级-皮肤出现溃疡、出血或坏死。
[0083]
连续观察记录接种细胞21d内裸鼠生存情况,统计存活率;通过活体荧光示踪法成像观察hadscs定植及成活情况,注射后13d,取hadscs组创缘及创面部分组织,冰冻包埋剂固定制作冰冻切片,pbs冲洗包埋剂,dapi染细胞核5min,pbs清洗,荧光显微镜下观察,予蓝光激发hadscs表达呈绿色荧光。
[0084]
(3)实验21d后,颈椎离断法处死裸鼠,取出分化的细胞。各组分别在术后标识,分别收取rna、蛋白和组织样本:
[0085]
(i)流式细胞术检测修复组织中增殖细胞数量;
[0086]
(ii)石蜡包埋切片,行he染色,观察胶原纤维的排列、炎症细胞的浸润等病理变化情况,检测皮肤损伤修复后各组皮肤组织的表皮厚度、修复量、修复面积、回缩率等参数,量化调控hadscs定向分化形成皮肤成纤维细胞修复效果;
[0087]
(iii)免疫组织化学检测cd31蛋白表达分布,观察血管新生情况;
[0088]
(iv)免疫组化分析检测α-sma平滑肌肌动蛋白、波型蛋白、i型胶原蛋白和iii型胶原蛋白表达分布,评价胶原沉积及纤维化程度;
[0089]
(v)masson三联染色法分析组织胶原分布及纤维化程度;
[0090]
(vi)q-pcr及western blot法分析检测血管内皮生长因子,表皮生长因子,碱性成纤维细胞生长因子及血小板衍生因子的基因表达。
[0091]
(4)采用spss 23.0软件进行统计学分析,数据表示为x
±
s,各组间比较采用t检验,采用one-way-anova显著性检验,以p<0.05为差异有统计学意义。
[0092]
基因表达的检测结果如图5所示,从图5中可以看出,co1-i,co1-ii和aggrecan基因明显表达。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



