一种纯化原核表达蛋白的方法与流程
 2021-02-02 01:02:25|
2021-02-02 01:02:25| 389|
389| 起点商标网
起点商标网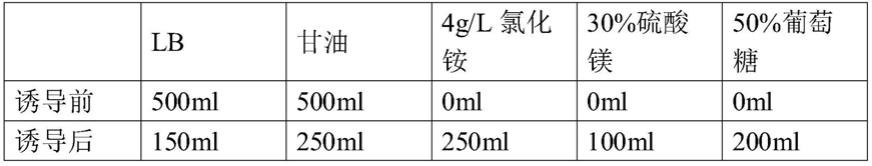
[0001]
本发明属于重组蛋白纯化领域。
背景技术:
[0002]
原核表达,即通过原核表达工程菌进行蛋白表达,是目前常见的蛋白生产方式,主要应用于酶、亚单位疫苗等产品的生产。用于原核表达的细胞有大肠杆菌、芽孢杆菌、链霉菌和蓝细菌等,其中大肠杆菌是目前产业上应用最广的原核表达细胞。
[0003]
大肠杆菌是革兰氏阴性菌,在表达重组蛋白时会产生大量内毒素,内毒素化学本质是脂多糖(lps),脂多糖具有极强的热源性,微量的lps进入动物体内就会引起高热、腹泻、休克等应激性反应,因此如原核表达的蛋白需进入人体或动物体发挥作用,则内毒素的去除是纯化蛋白的关键之一。
[0004]
目前对溶液中细菌内素的去除方法主要包括:(1)解毒作用:解毒机理主要包括酶降解细菌内毒素为无毒性片段、细菌内毒素与蛋白质形成可逆复合物、酸碱水解产生解毒作用,该方法会不同程度的影响蛋白质的活性,同时被解毒的内毒素有毒性逆转的可能性;(2)蔗糖密度梯度离心技术:因内毒素本身有不同存在形式、分子大小、密度、沉降系数及分子量不尽相同给此方法的应用造成了一定的困难;(3)亲和层析技术:该方法具有条件温和,较简单,并且有纯化及浓缩抗原的作用,但也存在试剂贵、操作复杂、配基与胶结合稳定性差等缺点;(4)离子交换层析技术:存在设备昂贵、材料损耗大等的问题。
[0005]
猪圆环病毒2型(pcv2)是一种二十面体的无包膜的单链环状dna病毒,直径大小约为17-22nm。pcv2能侵染猪只的许多组织和器官,其中淋巴器官是受损最常见的器官,导致猪的免疫系统受损,从而引起继发感染,包括猪生殖和呼吸道综合征、伪狂犬病及其它的细菌性感染疾病。pcv2的开放阅读框2(orf2)编码该病毒的唯一结构蛋白-cap蛋白,也是pcv2的主要免疫抗原性蛋白,5个cap蛋白组成5聚体,12个5聚体cap蛋白能自发组装成二十面体的病毒样颗粒(vlp)。病毒样颗粒由于不含有病毒的遗传物质,但却具有类似病毒粒子的结构,因此是制备病毒疫苗的非常有效抗原。
[0006]
大肠杆菌表达系统由于生产成本低、生产条件要求简单和周期短等优点,是用于生产cap蛋白的理想表达系统,但其内毒素的去除仍存在前述内毒素去除方法中所涉及的成本高、操作复杂等各种问题,且去除效果不理想。例如中国专利申请cn111233983a公开了一种cap蛋白一步法大规模纯化及内毒素去除工艺,采用阳离子交换层析纯化cap蛋白并去除内毒素,其内毒素含量在2.5万eu/ml以下。
技术实现要素:
[0007]
本发明要解决的问题是:提供一种简便且内毒素去除效果良好的原核表达蛋白的纯化方法。
[0008]
本发明的技术方案如下:
[0009]
本发明首先提供了一种纯化原核表达蛋白的方法,包括如下步骤:
[0010]
1)取原核表达工程菌,用缓冲液重悬后,匀浆破碎菌体;
[0011]
2)加入终浓度0.1%~0.3%(m/v)的聚乙烯亚胺,混匀,放置10~30分钟,离心取上清;
[0012]
3)所得上清加入终浓度3%~5%(m/v)的聚乙二醇,2~8摄氏度放置6小时以上,沉淀蛋白;
[0013]
4)离心,去掉上清,加缓冲液溶解沉淀即可。
[0014]
如前述的方法,步骤2)中聚乙烯亚胺的终浓度为0.2%(m/v)。
[0015]
如前述的方法,步骤2)中聚乙烯亚胺的分子量为70000。
[0016]
如前述的方法,步骤3)所述的聚乙二醇的终浓度为4%(m/v)。
[0017]
如前述的方法,步骤3)所述的聚乙二醇为聚乙二醇6000。
[0018]
如前述的方法,步骤1)的缓冲液的配制方法为:
[0019]
在ph7.0
±
0.2的20
±
5mm tris-hcl缓冲液中,加入终浓度500
±
50mm的nacl、1%
±
0.2%(v/v)的triton x-100和5%
±
1%(v/v)甘油;
[0020]
优选地,步骤1)的缓冲液的配制方法为:
[0021]
在ph7.0的20mm tris-hcl缓冲液中,加入终浓度500mm的nacl、1%(v/v)的triton x-100和5%(v/v)甘油。
[0022]
如前述的方法,步骤4)的缓冲液的配制方法为:
[0023]
在ph 7.0
±
0.2的20
±
5mm tris-hcl缓冲液中加入终浓度500
±
50mm的nacl、10
±
2mm的半胱氨酸和5%
±
1%(v/v)甘油;
[0024]
优选地,步骤4)的缓冲液的配制方法为:
[0025]
在ph 7.0的20mm tris-hcl缓冲液中加入终浓度500mm的nacl、10mm的半胱氨酸和5%(v/v)甘油。
[0026]
进一步地,所述原核表达工程菌是革兰氏阴性菌。
[0027]
进一步地,所述革兰氏阴性菌是大肠杆菌。
[0028]
进一步地,所述蛋白为猪圆环病毒2型重组cap蛋白。
[0029]
本发明的有益效果为:
[0030]
本发明的纯化方法,无需使用现有的内毒素去除方法所需的昂贵试剂和复杂的操作步骤,即可有效去除原核表达蛋白产品的内毒素,其内毒素去除率高达99.9993%,纯化后内毒素浓度仅22.35eu/ml,内毒素去除效果明显优于专利申请cn111233983a。
[0031]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0032]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0033]
实施例1重组cap蛋白纯化方法
[0034]
一、菌种
[0035]
菌种为大肠杆菌(chaperone competent cells pgro7/bl21(de3)),菌种包含了
携带目的基因(表达cap蛋白的基因)的表达载体pet28a,所述目的基因的序列如seq id no.1所示,位于载体的xhoi(酶切位点)位置。
[0036]
seq id no.1:
[0037]
atgacctacccgcgtcgtcgtttccgtcgtcgtcgtcaccgtccgcgttctcacctgggt 60
[0038]
cagatcctgcgtcgtcgtccgtggctggttcacccgcgtcaccgttaccgttggcgtcgt 120
[0039]
aaaaacggtatcttcaacacccgtctgtctcgtaccatcggttacaccgttaaaaaaacc 180
[0040]
accgttcgtaccccgtcttggaacgttgacatgatgcgtttcaacatcaacgacttcctg 240
[0041]
ccgccgggtggtggttctaacccgctgaccgttccgttcgaatactaccgtatccgtaaa 300
[0042]
gttaaagttgaattctggccgtgctctccgatcacccagggtgaccgtggtgttggttct 360
[0043]
accgctgttatcctggacgacaacttcgttaccaaagctaacgctctgacctacgacccg 420
[0044]
tacgttaactactcttctcgtcacaccatcacccagccgttctcttaccactctcgttac 480
[0045]
ttcaccccgaaaccggttctggaccgtaccatcgactacttccagccgaacaacaaacgt 540
[0046]
aaccagctgtggctgcgtctgcagaccaccggtaacgttgaccacgttggtctgggtacc 600
[0047]
gctttcgaaaactctatctacgaccaggactacaacatccgtatcaccatgtacgttcag 660
[0048]
ttccgtgaattcaacctgaaagacccgccgctgaacccgaaataa 705
[0049]
二、发酵
[0050]
1、种子液制备
[0051]
配制种子液lb培养基,121℃30min灭菌,冷却待用。
[0052]
一级种子:挑选单菌落,接入30ml lb培养基,同时加入抗生素(终浓度:kana(硫酸卡那霉素)50ug/ml,chl(氯霉素)20ug/ml),置于37℃、220rpm恒温摇床,摇菌培养10h。
[0053]
二级种子:按照1:100接种量,将一级种子液分别接入1l或2l的三角瓶中,置于32℃、220rpm恒温摇床,摇菌培养至od范围在1.5-2.5之间。
[0054]
2、发酵
[0055]
按照6:100体积比,将二级种子接入大肠杆菌培养基,于75l发酵罐中(装液量50l)发酵,同时加入抗生素(终浓度:kana 50ug/ml,chl 20ug/ml,阿拉伯糖0.7g/l),氨水控制ph6.90
±
0.1,基础转速和基础通气量(200rpm、35l/min),37℃培养,当do(溶解氧)第一次低于40%时候,通过调整do与转速、通气量控制do在40%
±
5%。同时开始流加补料液。
[0056]
补料配方如下:
[0057][0058]
当od达到5
±
0.5时,流加速度为1ml/min;当od达到7.5
±
2.5时,流加速度为3ml/min;当od达到14
±
4时,流加速度为6ml/min。当od达到20
±
1时,停止补料。当ph出现反弹迹象(当停止补料、停止补碱后,ph出现上升现象),开始降低温度至32℃,加入终浓度为1mm的异丙基硫代半乳糖苷(iptg)进行诱导,持续5h。诱导过程中,控制do在30%上下,流加速度为3ml/min。培养结束后,10000g,7min离心收取菌体。
[0059]
注:以上od均为波长600nm下测定值。
[0060]
三、本发明的纯化方法
[0061]
1)将诱导表达的含有pcv2 cap蛋白的大肠杆菌菌体用溶液a重悬,菌体鲜重100g,溶液a体积2l,用匀浆均质机高压充分破碎菌体,加入终浓度0.2%(m/v)的聚乙烯亚胺(pei,优选分子量70000),轻轻混匀,室温放置15分钟,离心去掉沉淀。
[0062]
溶液a的配制方法:在ph7.0的20mm tris-hcl缓冲液中,加入终浓度500mm的nacl、1%(v/v)的triton x-100和5%(v/v)甘油。
[0063]
2)所获得的上清溶液加入终浓度为4%(m/v)peg6000,4度放置6小时以上等蛋白沉淀析出。
[0064]
3)10000g,4度离心5分钟,去掉上清,加100ml溶液b溶解沉淀即获得纯化好的pcv2 vlp样品。
[0065]
溶液b的配制方法:在ph 7.0的20mm tris-hcl缓冲液中加入终浓度500mm的nacl、10mm的半胱氨酸和5%(v/v)甘油。
[0066]
4)用鲎试剂检测蛋白样品中的内毒素含量。
[0067]
5)用elisa方法和sds-page检测蛋白回收率、纯度。
[0068]
溶液a中:triton x-100起到帮助破碎大肠杆菌的作用;nacl和甘油起到稳定蛋白质的作用;tris-hcl起到维持ph的作用。
[0069]
溶液b中:nacl和甘油起到稳定蛋白质的作用,半胱氨酸作为还原剂,可防止蛋白氧化。
[0070]
四、设置如下对照实验
[0071]
#1:不做处理,直接将菌体在溶液a内匀浆,然后室温放置15分钟,离心去掉沉淀,取上清,用鲎试剂测内毒素含量;
[0072]
#2:在“三、本发明的纯化方法”的基础上,将pei浓度调整为0.02%(m/v),离心取上清,用鲎试剂测内毒素含量;
[0073]
#3:在“三、本发明的纯化方法”的基础上,省略步骤2)和3),用鲎试剂测上清液的内毒素含量;
[0074]
#4:“三、本发明的纯化方法”的基础上,省略步骤1)中pei处理的步骤;其余步骤不变。
[0075]
五、结果
[0076]
如表1所示,#4样本即对应本发明方法的纯化方式。可见pei处理能够使内毒素含量大幅降低,将pei和peg沉淀配合使用,能够去除绝大多数内毒素,并能提高产品纯度,保证一定的回收率。
[0077]
表1不同处理方式的内毒素含量
[0078][0079]
在均无pei处理的情况下,#4样品相比#1样品多出peg沉淀步骤,#4样品内毒素含量占#1样品内毒素含量的约1.9%;在均有0.2%pei处理的情况下,#5样品相比#3样品也是多出peg沉淀步骤,但#5样品内毒素含量仅占#3样品内毒素含量的约0.3%(表2)。可见,pei和peg沉淀配合使用,在内毒素去除方面产生了协同增效作用。
[0080]
表2在无pei处理或有pei处理情况下,peg沉淀前后的样品内毒素区别
[0081][0082]
综上,本发明的纯化方法,不涉及现有的内毒素去除方法所需的昂贵试剂和复杂的操作步骤,即可有效去除原核表达蛋白产品的内毒素,提高目标蛋白的纯度。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



