大肠杆菌噬菌体vB_EcoM_swi3及其应用的制作方法
 2021-02-02 01:02:40|
2021-02-02 01:02:40| 343|
343| 起点商标网
起点商标网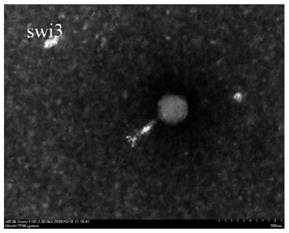
大肠杆菌噬菌体vb_ecom_swi3及其应用
技术领域
[0001]
本发明属于生物工程领域,尤其涉及一株大肠杆菌噬菌体vb_ecom_swi3及其应用。
背景技术:
[0002]
大肠杆菌属于条件致病菌,致病力的强弱与大肠杆菌的血清型有关,不同动物之间也存在差异性。其中,猪大肠杆菌病和鸡大肠杆菌病是在养殖环境中广泛存在的,一旦染病会引起腹泻、明显影响动物机体的增重,使动物群体的死亡率急剧上升,发病动物还可以通过粪便等途径传染给其它健康的养殖动物造成大面积感染,而且养殖环境中的猪源和鸡源大肠杆菌会造成动物群体的持续感染,给养殖户造成很大的经济损失。
[0003]
目前,使用抗生素是养殖场防治大肠杆菌病的主要手段,但是由于抗生素的大量滥用,导致其存在破坏动物肠道微生物菌群结构、抗生素残留、大肠杆菌严重耐药及多重耐药等缺陷,加大了疾病防控的难度,使得养殖成本不断增加,给养殖业的发展造成巨大的阻力。
[0004]
噬菌体是一种细菌依赖性病毒,能够特异性的裂解宿主细菌,且与抗生素杀菌的作用机制不同,噬菌体裂解细菌不受细菌耐药性的影响,且无残留,具有研发时间短、成本低、特异性强、给药量少、不破坏正常菌群构成等优点,在耐药菌的防治工作中已取得一系列可喜成果。理论上,任何致病菌都有其对应的噬菌体,但目前我们找到的噬菌体种类和数量只是冰山一角,还有大量的噬菌体资源尚未开发。发掘能同时裂解多种不同动物来源细菌的噬菌体在临床上具有更广阔的应用前景,因此开发具有上述特征的噬菌体制剂对于养殖业的健康快速发展而言意义重大。
技术实现要素:
[0005]
本发明针对上述问题,提出一种能够同时且高效杀灭养殖环境中猪源和鸡源致病性大肠杆菌的噬菌体。
[0006]
为了达到上述目的,本发明采用的技术方案为:
[0007]
本发明提供了一种大肠杆菌噬菌体vb_ecom_swi3,噬菌体保藏编号为cctcc no:m 2019467,于2019年6月19日保藏于中国典型培养物保藏中心,分类命名为escherichia coli phage vb_ecom_swi3,保藏地址为中国
·
武汉
·
武汉大学。
[0008]
上述大肠杆菌噬菌体在固体培养基上可以形成透亮的空斑,周围无晕环,边缘清晰规则,直径为1~1.5mm;经透射电子显微镜观察发现,该大肠杆菌噬菌体具有明显的正多面体头部结构和可伸缩的尾部结构,头部直径约80nm,尾部长约120nm,经鉴定该大肠杆菌噬菌体属于肌尾噬菌体科。
[0009]
对上述大肠杆菌噬菌体进行了一系列的性能测定,结果如下:
[0010]
a.通过效价测定和最佳感染复数测定实验得出,该大肠杆菌噬菌体的效价为6.4
×
108pfu/ml,最佳感染复数为1;
[0011]
b.通过ph、热及紫外线稳定性实验得出,该大肠杆菌噬菌体在ph6-8的中性条件下性能较为稳定、对紫外线较为敏感、当温度在60℃以下时,活性较为稳定;
[0012]
c.通过一步生长曲线测定得出,该大肠杆菌噬菌体的潜伏期约为25min,爆发期约为75min,爆发量约为25;
[0013]
d.通过小鼠安全性实验得出,该大肠杆菌噬菌体对小鼠正常生长不产生负面影响,且解剖检查未见异常情况,说明该大肠杆菌噬菌体表现出较高的安全性;
[0014]
e.通过大肠杆菌感染小鼠的治疗实验得出,经过腹腔注射107pfu/ml大肠杆菌噬菌体后的小鼠血液中大肠杆菌e.coli-k88浓度迅速下降,8.5h即可完全清除,血液中的噬菌体也随之消失,粪便中的噬菌体在99h内完全清除,说明该大肠杆菌噬菌体可在短时间内有效清除动物体内的致病性大肠杆菌,且无噬菌体残留;
[0015]
f.通过大肠杆菌环境消毒实验得出,采用浓度为105pfu/ml的大肠杆菌噬菌体增殖液即可有效的杀灭环境中污染的宿主菌。
[0016]
本发明还提供了大肠杆菌噬菌体在制备同时杀灭猪源和鸡源大肠杆菌生物制品中的应用。
[0017]
本发明提供的大肠杆菌噬菌体是从自然界中分离得到的一株新的噬菌体,作为细菌的天敌,能够特异性地裂解猪源和鸡源致病性大肠杆菌,而不会破坏正常菌群构成,并且不受细菌耐药性的影响,也不存在药物残留等的问题,具有很高的安全性,在防治大肠杆菌病方面具有良好的应用前景。
[0018]
作为优选,所述生物制品为饲料添加剂和消毒剂/清洁剂,其中所述饲料添加剂和消毒剂/清洁剂为以纯化的大肠杆菌噬菌体制备的单一制剂或以纯化的所述大肠杆菌噬菌体为主要成分制备的复配制剂。
[0019]
作为优选,猪源大肠杆菌和鸡源大肠杆菌包括致病性大肠杆菌,所述猪源大肠杆菌包括肠产毒型大肠杆菌。
[0020]
作为优选,所述肠产毒型大肠杆菌包括k88型大肠杆菌,所述鸡源致病性大肠杆菌包括o78型大肠杆菌。
[0021]
本发明还提供了一种消毒剂或清洁剂,为以纯化的大肠杆菌噬菌体制备的单一制剂或以纯化的大肠杆菌噬菌体为主要成分制备的复配制剂,用于防治养殖环境中猪源和鸡源大肠杆菌的污染。
[0022]
作为优选,所述消毒剂或清洁剂的剂型为液体、冻干粉或片剂;所述养殖环境包括畜禽体内、畜禽体表、畜禽养殖场所地面、畜禽养殖场所空气、畜禽饲料、饮水以及养殖器具。
[0023]
本发明又提供了一种饲料添加剂,为以纯化的大肠杆菌噬菌体制备的单一制剂或以纯化的大肠杆菌噬菌体为主要成分制备的复配制剂,添加在畜禽饲料中,用于防治养殖过程中猪源和鸡源大肠杆菌的污染。
[0024]
作为优选,所述饲料至少包括猪饲料或鸡饲料。
[0025]
作为优选,所述猪源大肠杆菌包括和鸡源大肠杆菌包括致病性大肠杆菌,所述猪源致病性大肠杆菌包括肠产毒型大肠杆菌,所述肠产毒型大肠杆菌包括k88型大肠杆菌,所述鸡源致病性大肠杆菌包括o78型大肠杆菌。
[0026]
本发明提供的大肠杆菌噬菌体可作为防治大肠杆菌病的药物制剂的有效成分,以
及抑制环境中大肠杆菌增殖的多种产品成分中,包括饲料添加剂、饮用水添加剂和肉制品清洁剂等多种产品。
[0027]
本发明提供的大肠杆菌噬菌体是通过以下方法分离得到的:
[0028]
i.实验材料:
[0029]
粪液污水样品,采集自山东省临沂市猪屠宰场污水、噬菌体宿主菌为猪源致病性大肠杆菌e.coli-k88,由本实验室从发病猪粪便中分离、鉴定并保存。
[0030]
ii.实验方法:
[0031]
将采集的污水样品5ml加入50ml lb液体培养基,然后加入大肠杆菌e.coli-k88菌液500μl,混合均匀后放入37℃恒温培养箱过夜培养。培养物先用四层纱布进行粗过滤,滤液4000rpm离心10min,取上清12000rpm离心15min,然后上清用0.22μm滤器抽滤,获得噬菌体原液。将大肠杆菌e.coli-k88增殖液200μl用棉签均匀涂布于lb固体培养基表面,晾干5min后,滴加10μl噬菌体原液,同时滴加10μl生理盐水作为对照,37℃条件下倒置培养10-12h,观察到点样处无细菌生长有空斑出现的样品则含有可裂解e.coli-k88的噬菌体。
[0032]
与现有技术相比,本发明的优点和积极效果在于:
[0033]
1、本发明提供了一株新发现的大肠杆菌噬菌体,具有较好的理化因素耐受性、潜隐期短、裂解性能高、安全性好等特点,是一种新型的防治畜禽养殖中细菌疾病的产品和手段;
[0034]
2、本发明提供的大肠杆菌噬菌体能够高效且同时杀灭养殖环境中及畜禽体内的猪源和鸡源致病性大肠杆菌,尤其是猪源肠产毒型大肠杆菌和鸡源致病性大肠杆菌;
[0035]
3、本发明提供的大肠杆菌噬菌体亲水性良好,可经水线给药,而且易于制备滴注液、喷洒液或淋洗液;该大肠杆菌噬菌体还可制备成单种制剂或与其他噬菌体复配制成复合制剂使用,此外该大肠杆菌噬菌体还可以广泛应用于饲料添加剂、消毒剂和清洁剂等。
附图说明
[0036]
图1为本发明实施例所提供的大肠杆菌噬菌体vb_ecom_swi3的透射电镜图片;
[0037]
图2为本发明实施例所提供的大肠杆菌噬菌体vb_ecom_swi3的ph稳定性结果图;
[0038]
图3为本发明实施例所提供的大肠杆菌噬菌体vb_ecom_swi3的热稳定性测定结果图;
[0039]
图4为本发明实施例所提供的大肠杆菌噬菌体vb_ecom_swi3的紫外线稳定性测定结果图;
[0040]
图5为本发明实施例所提供的大肠杆菌噬菌体vb_ecom_swi3的一步生长曲线测定结果图;
[0041]
图6为本发明实施例所提供的大肠杆菌噬菌体vb_ecom_swi3在动物体内杀菌结果图;
[0042]
图7为本发明实施例所提供的大肠杆菌噬菌体vb_ecom_swi3在粪便中的动态变化图。
具体实施方式
[0043]
为了更清楚详细地介绍本发明实施例所提供的大肠杆菌噬菌体及其应用,下面将
对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0044]
实施例1:大肠杆菌噬菌体vb_ecom_swi3的分离制备
[0045]
(1)实验材料:
[0046]
粪液污水样品,采集自山东省临沂市猪屠宰场污水、噬菌体宿主菌为大肠杆菌e.coli-k88,由本实验室从发病猪粪便中分离、鉴定并保存。
[0047]
(2)实验方法:
[0048]
将采集的污水样品5ml加入50ml lb液体培养基,然后加入大肠杆菌e.coli-k88菌液500μl,混合均匀后放入37℃恒温培养箱过夜培养。培养物先用四层纱布进行粗过滤,滤液4000rpm离心10min,取上清12000rpm离心15min,然后上清用0.22μm滤器抽滤,获得噬菌体原液。将大肠杆菌e.coli-k88增殖液200μl用棉签均匀涂布于lb固体培养基表面,晾干5min后,滴加10μl噬菌体原液,同时滴加10μl生理盐水作为对照,37℃条件下倒置培养10-12h,观察到点样处无细菌生长有空斑出现的样品则含有可裂解e.coli-k88的噬菌体。
[0049]
实施例2:大肠杆菌噬菌体vb_ecom_swi3的纯化与大量增殖
[0050]
q1、大肠杆菌噬菌体vb_ecom_swi3的纯化
[0051]
对上述实施例1中鉴定含有噬菌体的样品进行纯化,具体操作如下:取噬菌体原液100μl,进行10倍比稀释,取各稀释度噬菌体原液100μl与等量过夜培养的e.coli-k88混匀,加入3ml加热至50℃的0.7%的lb半固体培养基中混匀,倾倒入lb琼脂平板上层,静置5min,待其凝固后,37℃条件下倒置培养4-5h,获得形成噬菌斑的双层平板。抠取单个噬菌斑,加入lb液体培养基3ml,40℃水浴30min,12000rpm离心5min,取上清液用0.22μm滤器抽滤,获得噬菌体滤液。取100μl噬菌体滤液,稀释至10-6
,加入等体积宿主菌e.coli-k88,双层平板法培养。重复该过程5次,得到纯化的噬菌体。噬菌体在固体培养基上可以形成透亮的空斑,周围无晕环,边缘清晰规则,直径为1~1.5mm。
[0052]
q2、大肠杆菌噬菌体vb_ecom_swi3的纯化的增殖
[0053]
将1ml噬菌体原液和1ml新鲜培养的宿主菌e.coli-k88菌液加入100ml lb液体培养基中,37℃震荡培养9h,加入体积比5%的氯仿,继续震荡培养30min,13000rpm离心15min,取上清,得到噬菌体的大量增殖液;
[0054]
噬菌体增殖液中加入dnase i和rnasea至终浓度为1μg/ml,轻摇混匀之后37℃条件下孵育30min,加入nacl至终浓度1mol/ml充分混匀,4℃静置1h,13000rpm离心20min,取上清,加入peg6000至终浓度为10%(w/v),4℃过夜,13000rpm离心25min,弃上清,取沉淀,所得的沉淀用适当体积的生理盐水重悬,并充分洗涤离心管内壁。加入等体积的氯仿,轻柔震荡30s,4℃条件下8000rpm离心15min分离有机相和水相,取水相,得到纯化的噬菌体增殖液,用双层平板法检测纯化的噬菌体;
[0055]
纯化的噬菌体命名为vb_ecom_swi3,保藏于中国典型培养物保藏中心,保藏单位地址:中国
·
武汉
·
武汉大学,保藏编号:cctcc no:m 2019467,分类命名:escherichia coli phage vb_ecom_swi3,保藏日期为2019年6月19日。
[0056]
实施例3:大肠杆菌噬菌体vb_ecom_swi3的透射电镜形态观察
[0057]
取20μl纯化的噬菌体增殖液滴于铜网上,静置15min左右,用滤纸吸去多余的液
体。在铜网上滴加15μl的2%的磷钨酸(pta)染色5min,用滤纸吸去多余的染液,干燥后用透射电子显微镜观察。
[0058]
大肠杆菌噬菌体vb_ecom_swi3的透射电镜结果如图1所示,大肠杆菌噬菌体vb_ecom_swi3具有明显的正多面体头部结构和可伸缩的尾部结构,头部直径约为80nm,尾部长约120nm。根据国际病毒分类委员会(ictv)2018年发表的《病毒分类-国际病毒分类委员会第十次报告》为标准,该噬菌体属于肌尾噬菌体科。
[0059]
实施例4:大肠杆菌噬菌体vb_ecom_swi3的裂解谱检测
[0060]
试验选择10株致病性大肠杆菌临床分离株(其中8株从发病猪体内分离,2株从发病鸡体内分离)对大肠杆菌噬菌体vb_ecom_swi3的裂解谱进行测定。具体操作如下:分别将10株大肠杆菌增殖液200μl均匀涂布于lb固体培养基平板,待菌液完全吸收后,滴加5μl噬菌体滤液于平板上,同时滴加5μl生理盐水作为对照,自然晾干后,于37℃恒温培养箱中倒置培养4-6h,观察并记录结果。
[0061]
结果显示,试验选择的10株大肠杆菌菌株在lb固体培养基平板上生长良好,形成菌苔。其中8株大肠杆菌的平板上滴加大肠杆菌噬菌体vb_ecom_swi3的区域无细菌生长,说明分离到的大肠杆菌噬菌体vb_ecom_swi3能够裂解10株大肠杆菌中的8株,裂解率为80%,其中6株为猪源大肠杆菌,2株为鸡源大肠杆菌。
[0062]
表1大肠杆菌噬菌体vb_ecom_swi3的裂解谱试验结果
[0063]
裂解菌株来源噬菌体使用浓度(pfu/ml)裂解率/%猪源大肠杆菌6.4
×
1086/10
×
100%=60%鸡源大肠杆菌6.4
×
1082/2
×
100%=100%
[0064]
实施例5:大肠杆菌噬菌体vb_ecom_swi3的效价测定
[0065]
将大肠杆菌噬菌体vb_ecom_swi3增殖液依次进行10倍比稀释,取100μl各稀释度的增殖液分别与等体积的宿主菌e.coli-k88菌液混匀,用双层平板法进行噬菌斑计数,每个稀释度做3个平行。根据噬菌斑数量计算噬菌体效价,测得大肠杆菌噬菌体vb_ecom_swi3的效价6.4
×
108pfu/ml。
[0066]
实施例6:大肠杆菌噬菌体vb_ecom_swi3的最佳感染复数测定
[0067]
取大肠杆菌噬菌体vb_ecom_swi3增殖液和培养至对数期的宿主菌e.coli-k88菌液,进行计数。分别按照感染复数为0.001、0.01、0.1、1、10、100和1000的比例混匀,加入5ml lb肉汤,37℃摇床振荡培养4h,12000rpm离心20min,0.22μm滤器抽滤除菌,获得噬菌体增殖液,双层平板法测定噬菌体效价,每组做三个平行,根据测定噬菌体效价测定结果计算最佳感染复数。
[0068]
结果显示(表2),当感染复数为1时,大肠杆菌噬菌体vb_ecom_swi3的效价最高达到8.2
×
108pfu/ml。因此大肠杆菌噬菌体vb_ecom_swi3的最佳感染复数为1。
[0069]
表2大肠杆菌噬菌体vb_ecom_swi3的最佳感染复数测定结果
[0070][0071][0072]
实施例7:大肠杆菌噬菌体vb_ecom_swi3的ph稳定性测定
[0073]
取不同ph值(2、3、4、5、6、7、8、9、10、11、12、13)的lb液体培养基4.5ml,分别加入浓度为108pfu/ml的大肠杆菌噬菌体vb_ecom_swi3增殖液500μl,37℃水浴孵育,分别于1h、2h、3h取样1ml。对所取样品依次进行10倍比稀释,取100μl各稀释度的增殖液分别与等体积的e.coli-k88菌液混匀,双层平板法测定噬菌体效价,每组三个平行,根据统计结果绘制噬菌体的ph稳定性曲线。
[0074]
结果显示(图2),大肠杆菌噬菌体vb_ecom_swi3在ph6-8范围内较为稳定,当ph<6或ph>8时,大肠杆菌噬菌体vb_ecom_swi3的活性随着酸碱度的增加而迅速下降。当ph降低到2时,噬菌体作用1-3h,效价仅为103pfu/ml;当ph升高到13时,作用1h后,大肠杆菌噬菌体vb_ecom_swi3效价为105pfu/ml;作用2h后,噬菌体效价降低到103pfu/ml。因此,大肠杆菌噬菌体vb_ecom_swi3在ph6-8的中性条件下稳定。
[0075]
实施例8:大肠杆菌噬菌体vb_ecom_swi3的热稳定性测定
[0076]
分别将100μl浓度为108pfu/ml的大肠杆菌噬菌体vb_ecom_swi3增殖液于40℃、50℃、60℃、70℃、80℃水浴中孵育,分别在20min、40min、60min取样,将样品依次做10倍比稀释,取100μl各稀释度的噬菌体增殖液分别与等体积的e.coli-k88菌液混匀,双层平板法测定大肠杆菌噬菌体vb_ecom_swi3的效价,每个温度设三个平行,根据统计结果绘制噬菌体的热稳定性曲线。
[0077]
结果显示(图3),大肠杆菌噬菌体vb_ecom_swi3在40℃和50℃条件下,其效价基本保持不变;在60℃条件下,20min内大肠杆菌噬菌体vb_ecom_swi3的活性基本不受影响,但超过20min后,随着作用时间的延长,噬菌体活性迅速下降,作用60min时,噬菌体效价下降三个数量级以上;当温度为70℃或80℃时,随着作用时间的延长,噬菌体活性迅速下降。因此,当温度在60℃以下的时候,大肠杆菌噬菌体vb_ecom_swi3活性较稳定。
[0078]
实施例9:大肠杆菌噬菌体vb_ecom_swi3的紫外线稳定性测定
[0079]
取4ml浓度为108pfu/ml的大肠杆菌噬菌体vb_ecom_swi3增殖液,置于干净的平皿中,将其放置在距紫外灯40cm处照射60min。每隔10min取100μl噬菌体增殖液,进行10倍比稀释,取各稀释度的噬菌体增殖液100μl分别与等体积的e.coli-k88菌液混匀,利用双层平
板法测定噬菌体效价,每个时间点设三个平行,根据测定结果绘制噬菌体紫外线稳定性曲线。
[0080]
结果显示(图4),大肠杆菌噬菌体vb_ecom_swi3在紫外线下连续照射5min后,噬菌体的活性就开始降低。当在紫外线照射20min时噬菌体的效价下降约一个数量级。当在紫外连续照射40min时,噬菌体的效价下降约两个数量级。当噬菌体连续照射60min时,噬菌体的效价降低到105pfu/ml。说明大肠杆菌噬菌体vb_ecom_swi3对紫外线较敏感。
[0081]
实施例10:大肠杆菌噬菌体vb_ecom_swi3的一步生长曲线
[0082]
大肠杆菌噬菌体vb_ecom_swi3增殖液和过夜培养的宿主菌e.coli-k88菌液各200μl按最佳感染复数比例充分混匀,37℃孵育5min,13000rpm离心30s,lb液体培养基重复洗涤两次,弃上清。用7ml的lb液体培养基重悬沉淀,37℃条件下震荡培养。在不同的时间点(从零时刻开始,前1h每隔5min,第2h每隔20min,第3-4h每隔30min)分别取200μl的增殖液,16000rpm离心1min,取上清,双层平板法测噬菌体效价,每个时间点做三个平行,根据测定结果绘制一步生长曲线,计算噬菌体的潜伏期、爆发期和爆发量。
[0083]
结果显示(图5),大肠杆菌噬菌体vb_ecom_swi3的潜伏期约为25min,爆发期约为75min,爆发量约为25。
[0084]
实施例11:大肠杆菌噬菌体vb_ecom_swi3的安全性试验
[0085]
(1)实验动物:4周龄昆明小鼠20只,购自青岛大任富城畜牧有限公司。
[0086]
(2)实验方法:将4周龄昆明小鼠随机分为2组,每组10只。试验组小鼠腹腔注射108pfu大肠杆菌噬菌体vb_ecom_swi3的增殖液,对照组腹腔注射等体积无菌lb液体培养基。注射后,在相同环境条件饲养,观察小鼠精神状态。
[0087]
(3)实验结果:注射12h后,每组处死5只小鼠,观察内脏器官、肠道的变化;剩余5只小鼠定时采集血样和粪样,用双层平板法测定样品中噬菌体效价,检测大肠杆菌噬菌体vb_ecom_swi3在小鼠体内的代谢动态变化。
[0088]
最终结果显示,该剂量噬菌体对小鼠生长没有影响,解剖检查未见异常,且在腹腔注射噬菌体23h后,血液和粪便中检测不到噬菌体。
[0089]
实施例12:大肠杆菌噬菌体vb_ecom_swi3治疗大肠杆菌感染小鼠实验
[0090]
(1)实验动物:4周龄昆明小鼠50只。
[0091]
(2)实验方法:50只4周龄昆明小鼠用于感染试验,分为5组(3个治疗组,1个对照组,1个感染组),每组10只。挑取e.coli-k88单克隆,接种于3ml lb液体培养基中,37℃条件下过夜培养,12000rpm离心5min,去上清,用pbs洗涤3次。pbs重悬菌体,调整菌液浓度为2
×
108cfu/ml。感染组和3个治疗组分别灌胃108cfu的宿主菌e.coli-k88,建立大肠杆菌感染小鼠模型,对照组灌胃等体积的pbs。2h后,三个治疗组分别腹腔注射105pfu、106pfu和107pfu大肠杆菌噬菌体vb_ecom_swi3,对照组和感染组腹腔注射等体积的pbs。在相同环境条件饲养,观察各组小鼠的精神状态和生存情况,并对死亡的小鼠进行剖检,观察各内脏器官病变。同时,分别在接菌0.5h、1.5h、2h、5h、6.5h、8.5h、10h、23h、27h、51h后,采集各组存活小鼠的血液和粪便,检测细菌和噬菌体在小鼠体内的代谢动态。
[0092]
(3)实验结果:结果显示(图6),e.coli-k88在灌胃小鼠30min后就已已经入血,并随着时间的延长呈指数型增长,当灌胃1.5h后,血液中细菌浓度达到了108cfu,接菌小鼠精神萎靡,活动明显减少,出现扎堆的现象。2h后腹腔注射大肠杆菌噬菌体vb_ecom_swi3,三
个治疗组小鼠血液中e.coli-k88浓度迅速下降,接种噬菌体浓度越高,血液中细菌数量下降越快,高剂量治疗组小鼠血液中细菌8.5h即可清除,中剂量组和低剂量组小鼠血液中细菌51h完全清除。
[0093]
在粪便中的噬菌体随着接种噬菌体剂量的增高,存在的时间延长,高剂量组的噬菌体在99h内即可完全清除(图7)。感染组小鼠在接菌第2d全部死亡,三个治疗组中,低剂量组小鼠死亡1只,其余小鼠全部存活。说明腹腔注射106pfu大肠杆菌噬菌体vb_ecom_swi3可以有效治疗e.coli-k88引起的感染。
[0094]
实施例13:大肠杆菌噬菌体vb_ecom_swi3环境消毒实验
[0095]
将新鲜增殖的宿主菌e.coli-k88菌液浓度调整到106cfu/ml,用喷雾方式均匀喷洒在猪舍地面及料槽表面,然后将喷洒区域分成三个区,将纯化的大肠杆菌噬菌体vb_ecom_swi3增殖液分别以105pfu、106pfu和107pfu的浓度用喷雾方式分别对三个区的猪舍地面和料槽进行消毒,2h后检测环境中宿主菌e.coli-k88的含量。
[0096]
检测结果显示,猪舍中以106cfu喷洒e.coli-k88菌液的三个区域,料槽和地面宿主菌的数量均降到了45cfu以下,说明105pfu的噬菌体增殖液即可有效杀灭环境中污染的宿主菌。
[0097]
对比例1:猪致病性大肠杆菌噬菌体js09的分离及其裂解谱检测
[0098]
(1)实验材料:
[0099]
宿主菌etec ek99-f41,猪场污水,40株不同的猪致病性大肠杆菌,1株牛源致病性大肠杆菌以及5株大肠杆菌工程菌;
[0100]
(2)猪致病性大肠杆菌噬菌体js09的分离实验:
[0101]
从猪场采集污水100ml,12000rpm离心15min,取上清,用0.22μm的滤器过滤除菌,获得滤液。在滤液中加入宿主菌etec ek99-f41(109cfu/ml),37℃条件下震荡培养过夜。菌液12000rpm离心10min,取上清,用0.22μm的滤器过滤除菌,获得滤液。将宿主菌etec ek99-f41菌液均匀涂布于lb平板,晾干后,取10μl滤液滴加在平板表面,37℃倒置培养过夜,观察噬菌斑出现情况,分离获得噬菌体js09;
[0102]
(3)猪致病性大肠杆菌噬菌体js09的裂解谱检测:
[0103]
实验选择46株不同来源的大肠杆菌临床分离株,对分离到的噬菌体js09的裂解谱进行测定。具体操作如下:分别取100μl不同的大肠杆菌培养液均匀涂布在lb琼脂平板表面,静置晾干,在表面滴加10μl噬菌体js09(109pfu/ml),37℃倒置培养过夜,观察噬菌斑出现情况,得到噬菌体对不同来源的大肠杆菌的裂解谱,并记录结果。结果显示,该裂解性噬菌体js09中可以裂解40株猪源致病性大肠杆菌中的11株,还可以裂解5株大肠杆菌工程菌,对牛源大肠杆菌无裂解作用,其裂解率为21.7%。
[0104]
对比例2:鸡致病性大肠杆菌噬菌体ecp5的裂解谱检测
[0105]
(1)实验材料:
[0106]
鸡源致病性大肠杆菌及其裂解性噬菌体ecp5,45株不同的鸡致病性大肠杆菌;
[0107]
(3)实验方法:
[0108]
实验选择45株不同的鸡致病性大肠杆菌临床分离株对将裂解性噬菌体ecp5的裂解谱进行测定,具体操作如下:将100μl裂解性噬菌体ecp5分别与100μl 45株不同鸡致病性大肠杆菌混合,静置15min。采用双层琼脂平板法观察噬菌斑的形成情况,得到噬菌体对不
同鸡致病性大肠杆菌的裂解谱,并记录结果;
[0109]
结果显示,该裂解性噬菌体ecp5中能对裂解45株鸡致病性大肠杆菌中的18株,其裂解率为40.0%。
[0110]
表3实施例1-13大肠杆菌噬菌体vb_ecom_swi3与对比例1-2噬菌体裂解谱比较
[0111] 裂解率(%)裂解大肠杆菌来源实施例1-1380%鸡源大肠杆菌、猪源大肠杆菌对比例121.7%仅裂解猪源大肠杆菌对比例240%仅裂解鸡源大肠杆菌
[0112]
由表3的结果可知,对比例1仅裂解猪源大肠杆菌和实验室中常用的大肠杆菌工程菌,对牛源的大肠杆菌无裂解能力;对比例2仅能单独裂解鸡源大肠杆菌,不能同时裂解其它来源的大肠杆菌,且对比例1-2的裂解率均低于本发明实施例1-13中的大肠杆菌噬菌体vb_ecom_swi3,由此可见,本发明提供的噬菌体在裂解不同动物来源的大肠杆菌方面具有优势。
[0113]
此外本发明提供的噬菌体vb_ecom_swi3还具有理化因素耐受性好、潜隐期短、裂解性能高、安全性好等优点,可将其制成不同剂型用作饲料添加剂、消毒剂或清洁剂等产品,由此可见本发明提供的大肠杆菌噬菌体vb_ecom_swi3在防治养殖环境中、畜禽等动物的养殖过程中猪源和鸡源大肠杆菌的污染方面具有十分广阔的应用前景。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



