一种用于肝细胞癌诊断的生物标志物及其应用的制作方法
 2021-02-02 00:02:22|
2021-02-02 00:02:22| 438|
438| 起点商标网
起点商标网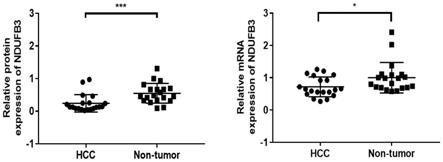
[0001]
本发明属于生物医药领域,具体涉及一种用于肝细胞癌诊断的生物标志物及其应用。
背景技术:
[0002]
原发性肝癌是高度恶性的肿瘤,根据国际癌症研究机构公布的globocan 2018资料显示,肝癌的发病率和死亡率在所有癌症中分别位列第6位和第4位。肝癌的死亡率在我国高居肿瘤死亡率的第3位。肝癌患者中90%以上为肝细胞癌患者,肝细胞癌具有易转移与复发的特点,其五年生存率不足10%。肝细胞癌的发生发展与多种癌基因过度表达,以及抑癌基因的失活密切相关。因此,揭示肝细胞癌发生发展的分子机制,对肝细胞癌早期诊断与针对肝细胞癌治疗的药物开发至关重要。
[0003]
肿瘤细胞的生长需要大量能量供应,线粒体氧化磷酸化系统(oxphos)是真核细胞中能量产生的主要场所。研究发现,线粒体中呼吸链复合物ⅰ由多种亚基组成,其功能异常会影响线粒体功能及活性氧(ros)产生,调控癌细胞的代谢可塑性并影响肿瘤内部的氧化应激环境,与癌症发展有密切联系。通过检测复合物ⅰ亚基在临床肝细胞癌患者中的表达水平,研究其在肝细胞癌发展过程中的作用机制,能够为肝细胞癌的临床诊断与治疗提供候选标志物和作用靶点。但是,目前关于复合物ⅰ亚基在肝细胞癌发展中的作用仍然存在大量未知领域。
[0004]
生物标志物联合影像技术是临床肝细胞癌诊断的主要方法。研究发现与肝细胞癌相关的生物标志物类型包括蛋白质,microrna,长链非编码rna等。但是大部分标志物在肝细胞癌诊断中存在灵敏性低或特异性较差的问题。目前,已被广泛用于临床肝细胞癌诊断的生物标志物为蛋白质,如甲胎蛋白(afp),作为肝细胞癌临床诊断的黄金标准,但是在早期患者的诊断中,其诊断准确性较低。因此,寻找新的生物标志物,提高肝细胞癌临床诊断的灵敏性与准确性,有助于肝细胞癌早期防治。
技术实现要素:
[0005]
为了克服现有技术的不足,本发明的目的之一在于提供一种用于肝细胞癌诊断的生物标志物,该生物标志物为肝细胞癌的早期诊断提供依据。
[0006]
本发明的目的之二在于提供一种上述肝细胞癌诊断生物标志物的应用。
[0007]
本发明的目的之一采用如下技术方案实现:
[0008]
一种用于肝细胞癌诊断的生物标志物,所述生物标志物为ndufb3蛋白或其mrna。
[0009]
本发明的目的之二采用如下技术方案实现:
[0010]
上述肝细胞癌诊断生物标志物的应用,所述生物标志物在制备诊断肝细胞癌检测试剂中的应用。
[0011]
进一步地,所述检测试剂用于检测生物样品中ndufb3蛋白或其mrna的表达水平。
[0012]
进一步地,所述生物样品来自待检测对象的新鲜组织。
[0013]
进一步地,所述生物标志物在制备靶向治疗肝细胞癌药物中的应用。
[0014]
相比现有技术,本发明的有益效果在于:
[0015]
本发明公开了一种用于肝细胞癌诊断的生物标志物,该生物标志物为ndufb3蛋白或其mrna。通过检测临床肝细胞癌组织样本中ndufb3蛋白或其mrna的表达水平,与癌旁正常肝组织相比,肝细胞癌组织样本中ndufb3蛋白或其mrna明显低表达,因此可将ndufb3蛋白或其mrna作为肝细胞癌早期临床诊断的依据。本发明还公开了肝细胞癌诊断生物标志物ndufb3蛋白或其mrna的应用,包括制备诊断肝细胞癌检测试剂及制备靶向治疗肝细胞癌药物中的应用,构建ndufb3过表达肝细胞癌稳转细胞株,提高了ndufb3蛋白或其mrna在肝细胞癌中的表达水平,ndufb3过表达能够抑制肝细胞癌细胞的增殖能力、伤口愈合能力、迁移能力、侵袭能力,表明ndufb3蛋白或其mrna对肝细胞癌细胞的生长发挥显著的抑制作用。本发明为肝细胞癌的早期诊断提供了新的生物标志物ndufb3蛋白或其mrna,并且ndufb3蛋白或其mrna可以作为治疗肝细胞癌的新型靶点,为筛选诊治肝细胞癌药物及治疗肝细胞癌提供了新方向。
附图说明
[0016]
图1为肝细胞癌患者肝癌组织与癌旁正常肝组织样本中ndufb3蛋白与其mrna表达水平检测;
[0017]
图2为正常肝细胞与肝细胞癌细胞系中ndufb3蛋白表达水平检测;
[0018]
图3为本发明构建的ndufb3过表达肝细胞癌细胞株中ndufb3蛋白与mrna表达水平;
[0019]
图4为本发明ndufb3过表达肝细胞癌细胞与对照组肝细胞癌细胞增殖能力检测;
[0020]
图5为本发明ndufb3过表达肝细胞癌细胞与对照组肝细胞癌细胞迁移能力检测;
[0021]
图6为本发明ndufb3过表达肝细胞癌细胞与对照组肝细胞癌细胞侵袭能力检测;
[0022]
图7为本发明ndufb3过表达肝细胞癌细胞与对照组肝细胞癌细胞伤口愈合能力检测。
具体实施方式
[0023]
下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
[0024]
实施例1
[0025]
组织样本提取与保存:本发明共选取24对临床组织标本和包含20对人肝细胞癌患者肝癌与癌旁组织cdna的芯片,所用的24对临床肝细胞癌患者的肝癌组织与癌旁正常组织样本来自郑州大学第一附属医院,包含20对人肝细胞癌患者肝癌与癌旁组织cdna的芯片购自上海芯超生物公司。该研究得到郑州大学伦理委员会的批准,每位患者均知情样本用途并签署知情同意书。取出来的组织样本保存在液氮中。
[0026]
临床肝细胞癌患者的肝癌组织与癌旁正常组织中ndufb3蛋白表达水平的检测:
[0027]
1.组织蛋白的提取:收集待检测组织,液氮中研磨后加入ripa缓冲液(10%np-40,10%sodium deoxycholate,100mm nacl,20mm tris-hcl ph 7.4,100mm edta),冰上裂解
30min。随后将样品在4℃,13,000
×
g离心15min,收集上清液。根据蛋白说明书,使用bca蛋白质测定法(品牌:pierce;thermo fisher scientific,inc)评估蛋白质的浓度。
[0028]
2.western blot检测:制备分离胶浓度为12%和浓缩胶浓度为5%的sds-聚丙烯酰胺凝胶,分离等量的蛋白样品(50μg),按照先恒压70v,30min,后恒压100v,90min进行电泳。电泳结束后,配制含25mm tris,192mm glycine,20%ch3oh,ph 8.3的转膜液,构建三明治转膜结构:负极(黑色)-海绵垫-两层滤纸-凝胶-pvdf膜-两层滤纸-海绵垫-正极(白色),恒流200ma,50min,将样品转移到0.45μm厚的聚偏二氟乙烯(pvdf)膜(品牌:merck millipore,billerica,ma,usa)上。以gapdh作为内部对照。膜上的非特异性结合位点用5%脱脂牛奶(品牌:bbi,cat#a600669-0250)于室温下封闭2h。然后,将膜与一抗在4℃孵育过夜。使用tbst溶液(含0.01m tris,0.15m nacl,0.1%tween-20,ph 7.5)将膜清洗3次,每次15min。随后,用辣根过氧化物酶偶联的二抗在室温下孵育2h。最后,用增强的化学发光液(品牌:genview,cat#ge2301-50ml)检测印迹观察免疫反应,并使用amersham imager 600(品牌:ge healthcare life sciences,logan,ut,usa)对印迹进行成像。
[0029]
临床肝细胞癌患者的肝癌组织与癌旁正常组织中ndufb3的mrna表达水平的检测:
[0030]
以购买的20对人肝细胞癌患者肝癌与癌旁组织的cdna为模板,使用sybr premix ex taq ii(品牌:takara biotechnology co.,ltd.,dalian,china)进行pcr反应。按照表1成分配制pcr反应液:
[0031]
表1
[0032]
试剂使用量premix ex taq(probe qpcr)(2
×
)10.0μlpcr forward primer(10μm)0.4μlpcr reverse primer(10μm)0.4μl荧光探针溶液0.8μlrox reference dye(50
×
)0.4μldna模板2.0μlddh2o6.0μltotal20.0μl
[0033]
采用两步法扩增程序:先95℃预变性30秒,1个循环;然后进行pcr反应:95℃5秒,60℃30秒,40个循环。ndufb3的引物如下:正向引物:5'-gcaaaagggctaaggga-3';反向引物:5'-gcaaagccacccatgtat-3'。使用quantstudiotm12k flex real-time pcr system(品牌:applied biosystems,usa)检测目标基因的表达水平,并以公司质检基因β-actin为内部对照。数据通过2-δδct
方法计算得到,结果如图1所示。
[0034]
如图1所示,经western blot及qpcr检测,临床肝细胞癌组织中ndufb3蛋白与其mrna的表达水平明显低于癌旁正常组织。
[0035]
实施例2
[0036]
肝细胞癌细胞系与正常肝细胞中ndufb3蛋白表达水平的检测:
[0037]
1.细胞培养及培养条件:人肝细胞癌细胞系huh7和smmc-7721购自中国科学院典型培养物保存委员会细胞库(中国上海),正常肝细胞系l02、人肝细胞癌细胞系snu449和hepg2购买自武汉普诺赛生命科技有限公司。培养条件:l02采用包含1%青霉素和1%链霉
素以及10%胎牛血清的rpmi-1640培养基,其它几种细胞系均采用包含1%青霉素和1%链霉素以及10%胎牛血清的dmem培养基,置于5%co2,37℃培养箱中进行培养。取对数生长的细胞用于所有试验。其中胎牛血清购自gibco,thermo fisher scientific,rpmi-1640和dmem购自:hyclone,ge healthcare life sciences,logan,ut,usa。
[0038]
2.上述细胞蛋白提取和检测过程同实施例1,以gapdh作为内部对照。
[0039]
结果如图2所示,经western blot检测,在huh7和smmc-7721肝细胞癌细胞系中ndufb3蛋白的表达水平明显低于正常肝细胞。
[0040]
实施例3
[0041]
构建ndufb3过表达肝细胞癌细胞株并检测ndufb3蛋白与mrna表达水平:
[0042]
1.慢病毒转染与稳转细胞株构建:分别将huh7和smmc-7721细胞铺六孔板,当细胞密度达到30-50%时开始转染慢病毒,ndufb3过表达慢病毒为plv-cmv-ndufb3-ef1-zsgreen1-t2a-puro,对照慢病毒为plv-cmv-mcs-ef1-zsgreen1-t2a-puro,均购买自湖南丰晖公司。首先,根据病毒滴度和细胞感染慢病毒moi值计算出所需慢病毒体积,加入慢病毒之前需更换为新鲜的培养基,加入慢病毒之后,轻轻混匀,将培养板置于细胞培养箱中,12h后更换为新鲜培养基。96h后加入含嘌呤霉素(终浓度:2μg/ml)的培养基,连续筛选3代获得稳定过表达ndufb3的细胞株。
[0043]
对上述得到的稳定过表达ndufb3的细胞株经qpcr实验和western blot实验验证后用于后续实验,验证实验过程如下。
[0044]
2.qpcr实验过程如下:
[0045]
(1)rna提取:使用trizol试剂(品牌:invitrogen,美国卡尔斯巴德,美国)于室温下充分裂解上述步骤1得到的细胞:按照200μl氯仿/1ml trizol的比例加入氯仿,剧烈震荡混匀,室温静置3min;4℃下12000rpm离心15min,离心后样品分为三层,吸取内含rna的最上层水相至另一离心管中;向该离心管中加入与水相等体积的异丙醇,混匀并室温静置10min,再次在4℃下12000rpm离心10min获得rna沉淀;最后用75%乙醇洗涤两次后晾干,并用depc水溶解rna沉淀获得rna溶液。
[0046]
(2)逆转录合成cdna:使用primescript rt试剂盒(品牌:takara,japan)反转录合成cdna;
[0047]
(2.1)去除基因组dna反应:按表2所示成分配制反应混合液,配制好的反应液置于42℃2min,然后置于4℃环境中保存。
[0048]
表2
[0049]
试剂使用量5
×
gdna eraser buffer2.0μlgdna eraser1.0μltotal rna1.0μgrnase free ddh2o补足反应体系体积为10μl
[0050]
(2.2)反转录反应:按表3所示成分配制反应液。
[0051]
表3
[0052][0053][0054]
(3)pcr扩增:pcr反应液的配制与扩增程序与实施例1中相同。ndufb3的引物如下:正向引物:5'-gcaaaagggctaaggga-3';反向引物:5'-gcaaagccacccatgtat-3'。使用quantstudio
tm
12k flex real-time pcr system(品牌:applied biosystems,usa)检测目标基因的表达水平,并以gapdh作为内部对照,gapdh的引物如下:正向引物:5
′-
tcaagaaggtggtgaagcagg-3
′
,反向引物:5
′-
tcaaaggtggaggagtgggt-3
′
。数据通过2-δδct
方法计算得到,结果如图3所示。
[0055]
3.western blot的实验过程同实施例1。
[0056]
结果如图3a所示,在huh7细胞系中ndufb3的mrna高表达,表明稳定过表达ndufb3的细胞株成功构建;图3b所示为相对于wt(空白对照)和vector(空载体对照),构建ndufb3过表达肝细胞癌细胞株中ndufb3蛋白高表达。smmc-7721细胞系中结果与huh7细胞系相同,如图3c、3d所示。
[0057]
实施例4
[0058]
细胞增殖能力检测:将ndufb3过表达的huh7、smmc-7721细胞与对照组huh7(vector)、smmc-7721(vector)细胞铺于96孔板中,每孔细胞数量约2.5
×
103个,每组五个复孔,添加100μl含10%fbs的培养基,置于细胞培养箱中培养。检测时间点包括0、24、48、72h共四个时间点。分别在各个时间点向每孔加入10μl cck-8(品牌:dojindo,japan),置于培养箱中孵育2h后,使用酶标仪(品牌:bio-tek instruments,winooski,vt,usa)在450nm处评估吸光度值。每个实验至少独立重复三次。
[0059]
如图4所示,培养24h后,ndufb3过表达的huh7、smmc-7721细胞与对照组细胞相比,450nm处吸光度降低,并具有明显差异,这种差异随着培养时间的延长而增大。说明ndufb3过表达对肝细胞癌细胞增殖有一定的抑制作用。
[0060]
实施例5
[0061]
transwell迁移能力检测:在迁移能力检测中,首先,取100μl无血清培养基于24孔板中的上腔室内(品牌:corning costar,usa),润洗上腔室。然后,收集ndufb3过表达的huh7和smmc-7721细胞与对照组huh7(vector)和smmc-7721(vector)细胞并用无血清培养基分别稀释细胞,弃去无血清培养基后,另取100μl细胞液(细胞量约1
×
105个)接种在上腔室内,向下腔室中加入600μl含10%fbs的完全培养基,放于培养箱中培养。24h后,取出上腔室,用pbs润洗三次后,用甲醇固定,然后用0.1%结晶紫染色,pbs润洗后,显微镜观察并随
机选择五个视野进行拍照和细胞计数。
[0062]
如图5所示,ndufb3过表达的huh7与smmc-7721细胞与对照组细胞相比,细胞迁移数量明显偏低,表明ndufb3过表达对肝细胞癌细胞迁移能力有抑制作用。
[0063]
实施例6
[0064]
transwell侵袭能力检测:在侵袭能力检测中,在上腔室内添加细胞液之前,需用matrigel基质胶(品牌:bd biosciences,franklin lakes,nj,usa)预处理上腔室。处理过程:取100μl无血清培养基润洗小室2次,并于冰上按照无血清培养基:matrigel基质胶(品牌:bd biosciences,franklin lakes,nj,usa)原液=6:1配制基质胶溶液,取出100μl加入润洗后的小室中,放置于37℃,5%co2培养箱中,4-5个小时后,吸去小室内没有凝固的基质胶,其他实验步骤参考细胞迁移实验。
[0065]
如图6所示,ndufb3过表达的huh7与smmc-7721细胞与对照组细胞相比,细胞侵袭数量明显偏低,表明ndufb3过表达对肝细胞癌细胞侵袭能力有抑制作用。
[0066]
实施例7
[0067]
伤口愈合能力检测:将ndufb3过表达的huh7和smmc-7721细胞与对照组huh7(vector)和smmc-7721(vector)细胞按照每孔细胞数约为5
×
105个分别接种在6孔板中,置于培养箱中培养直至细胞密度达到90-100%。用200μl移液器吸头垂直刮擦6孔板底部的细胞形成直线伤口,使用预冷的pbs清洗去除分离的细胞。随后,加入含10%fbs的完全培养基,置于培养箱中培养。分别在0h、48h时在光学显微镜下观察伤口愈合情况,并拍摄照片。使用imagej 1.48软件分析细胞的迁移能力。根据以下公式计算伤口愈合率:伤口愈合率=[(0h时的划痕宽度-48h时的划痕宽度)/0h时的划痕宽度]
×
100%。每个实验至少独立重复三遍。
[0068]
如图7所示,ndufb3过表达的huh7、smmc-7721细胞与对照组细胞相比,48h时划痕宽度更宽,伤口愈合比例更小,ndufb3过表达的细胞伤口愈合能力低于正常细胞,表明ndufb3过表达对肝细胞癌细胞伤口愈合能力有抑制作用。
[0069]
统计分析:连续变量显示为平均值
±
标准差,并使用student's t检验(正态分布)或非参数检验(非正态分布)对两组进行比较。所有的检验都是双尾,并且p<0.05说明结果有显著差异。使用spss 18.0软件进行数据分析,并使用graphpad prism 7.0版本绘制图形。
[0070]
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


