一种制备手性叔丁基亚磺酰胺的方法与流程
 2021-02-02 00:02:33|
2021-02-02 00:02:33| 312|
312| 起点商标网
起点商标网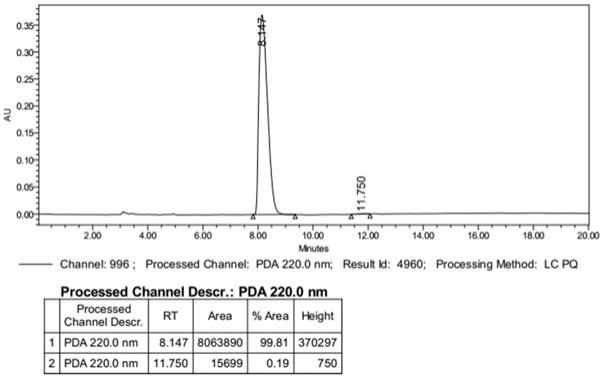
[0001]
本发明属于化学合成技术领域,具体地涉及一种制备(r)-叔丁基亚磺酰胺的方法。
背景技术:
[0002]
手性胺类化合物在药物和天然产物合成中具有重要的应用价值。75%以上的药物及候选药物都带有胺的官能团,因此含有胺基的化合物近年来受到不少药物学家和合成化学家的重视。叔丁基亚磺酰胺是ellman 1997年设计合成的一种新型的手性化合物,它在众多不对称合成反应中作为一类手性辅助试剂,表现出良好的诱导作用(参考文献:ellman,j.a.;owens,t.d.:tang,t .p . acc. chem. res.,2002,35,984.),较好地实现了高活性手性胺类化合物的合成。
[0003]
手性叔丁基亚磺酰胺包括r型和s型两种手性构型,合成路线主要分为以下几种。
[0004]
一类合成路线:用叔丁基硫醇做原料,通过催化剂和双氧水氧化,再通过双氧水、钒催化剂和手性配体进行不对称氧化得到手性叔丁基硫代亚磺酸酯,随后通过液氨、金属锂和硝酸铁深冷条件下得到光学纯的叔丁基亚磺酰胺。
[0005]
反应方程式如下:在上述方法中,叔丁基二硫在不对称手性氧化过程耗费的时间过长(大约4天)。上述方法存在的主要问题是液氨用量过大且排氨的过程不宜将液氨回收,对环境造成污染。另外,反应过程中的恶臭的叔丁基硫醇造成严重的环保问题。
[0006]
在另一种合成工艺中,以顺式手性茚胺醇为原料,通过氨基保护,用氯化亚砜反应,再与叔丁基格氏试剂发生亲核进攻,最后通过液氨、锂和硝酸铁在深冷的条件下反应得到手性叔丁基亚磺酰胺。该工艺的反应方程式如下:在该工艺方法中,虽然未使用具有恶臭气味的叔丁基硫醇,但是该工艺使用的其他物
料成本较高,整体步骤较长,不利于工业化生产。
技术实现要素:
[0007]
为解决现有工艺中存在的问题,本发明提供一种新的制备手性(r)-叔丁基亚磺酰胺的方法,该方法的合成路线如下:x选自cl、br、i;r选自甲基、乙基、异丁基、正丁基、异丙基、正丙基、3-戊基、苯甲基;所述方法包括以下步骤:步骤(1):在有机溶剂1中加入镁金属和卤代叔丁烷sm,通过格氏反应制备化合物1,向包含化合物1的格氏反应液中通入二氧化硫气体,经反应得到化合物2;步骤(2):将化合物2、n,n-二甲基甲酰胺(dmf)加到有机溶剂2中,在5℃至10℃的温度下,滴加氯化亚砜,反应得到化合物3;步骤(3):将醇试剂、手性生物碱化合物加到有机溶剂3中,在-35℃
±
5℃的温度下,滴加化合物3在有机溶剂3中的溶液,反应得到化合物4;其中,所述醇试剂选自甲醇、乙醇、异丁醇、正丁醇、异丙醇、正丙醇、3-戊醇、苯甲醇中的至少一种;所述手性生物碱化合物选自奎尼丁、辛克宁、辛可尼丁、奎宁中的至少一种;步骤(4):在液氨中加入硝酸铁、金属锂或金属钠、以及化合物4在有机溶剂4的溶液,反应得到化合物tm。
[0008]
根据本发明的一些实施方案,在步骤(1)中,所述格氏反应在镁屑的存在下进行,其中,镁屑∶卤代叔丁烷∶二氧化硫=1.0∶1.2-1.3∶2-2.5;所述卤代叔丁烷为叔丁基溴或叔丁基碘;优选地,在-5℃至5℃的温度下,向格氏反应液中通入二氧化硫气体。较低的温度可以提高气体的溶解度,提高原料利用率。
[0009]
根据本发明的一些实施方案,在步骤(1)中,所述有机溶剂1选自四氢呋喃、2-甲基四氢呋喃、甲基叔丁基醚、异丙醚中的至少一种。
[0010]
根据本发明的一些实施方案,在步骤(2)中,化合物2∶氯化亚砜∶n,n-二甲基甲酰胺(dmf)=1.0∶1.1-1.4∶0.1;优选地,在5℃至10℃的温度下,滴加氯化亚砜。
[0011]
根据本发明的一些实施方案,在步骤(2)中,所述有机溶剂2选自二氯甲烷、二氯乙
烷中的至少一种。
[0012]
根据本发明的一些实施方案,在步骤(3)中,化合物3:醇试剂:手性生物碱化合物=1:3.0-5.0∶1.05-1.2;优选地,在-35℃
±
5℃的温度下,滴加化合物3的有机溶剂3中的溶液。在步骤(3)中,醇试剂优选采用位阻较小的醇,例如异丁醇。大位阻的醇试剂(例如,叔丁醇)在一些条件下几乎不能发生反应。与其他几种醇试剂相比,采用异丁醇可以获得更高的r构型产物,ee%值可以高达95%。
[0013]
根据本发明的一些实施方案,在步骤(3)中,所述手性生物碱化合物选自奎尼丁、辛克宁、辛可尼丁、奎宁中的至少一种。在本发明中,采用单一一种生物碱化合物即可获得良好的手性催化效果,无需结合其他类型的催化剂。单独采用这几种生物碱化合物一种或几种的组合均可获得理想的手性收率。此外,发明人发现,采用奎尼丁作为反应试剂可以得到更高比例(相对于s构型的比例)的r构型产物。反应产物粗品中的r构型产物与s构型产物的比例可以达到约96%。另外,手性生物碱化合物奎尼丁方便回收,回收率可以达到99%。
[0014]
根据本发明的一些实施方案,在反应步骤(3)中,以化合物3计,所述手性生物碱化合物的摩尔当量为1.0-2.0。在本发明中的步骤(3)中,反应结束后,加入的绝大部分的手性生物碱化合物可以回收并套用,可大大降低了生产成本。
[0015]
根据本发明的一些实施方案,在步骤(3)中,所述有机溶剂3选自异丙醚、甲基叔丁基醚、四氢呋喃、乙酸乙酯、甲苯中的至少一种。在本步骤中,优选采用常见的醚类溶剂异丙醚、甲基叔丁基醚。选择这些溶剂不仅带来高的收率,而且成本低,适于工业化生产。
[0016]
在本发明的一些实施方案中,在步骤(4)中,化合物4、金属锂与硝酸铁的摩尔比为1∶0.07-0.01∶3-5。液氨用作溶剂,用于溶解硝酸铁,以便硝酸铁与金属钠或金属锂发生反应。
[0017]
根据本发明的一些实施方案,在步骤(4)中,有机溶剂4选自四氢呋喃、2-甲基四氢呋喃、甲基叔丁基醚、异丙醚中的至少一种。
[0018]
本发明的有益效果本发明采用新的方法制备手性(r)-叔丁基亚磺酰胺,该方法避开了现有工艺的缺点,未使用恶臭的叔丁基硫醇,使用的原料卤代叔丁烷、溶剂等都是常见试剂且价格便宜的物料,且手性生物碱化合物可以回收利用,更适合工业化生产。
附图说明
[0019]
图1是本发明实施例4制备得到的化合物4-3粗品的正相hplc图谱;图2是(r)-叔丁基亚磺酰胺标准品的正相hplc图谱;图3是本发明实施例制备得到的(r)-叔丁基亚磺酰胺的正相hplc图谱;图4是本发明的实施例制备的(r)-叔丁基亚磺酰胺的1hnmr图谱。
具体实施方式
[0020]
下面通过具体的实施例对本发明作进一步的说明。
[0021]
实施例1化合物2的制备
在干燥的玻璃反应釜中,氮气保护,加入镁屑(24g,1.0eq),加热至45-55℃。另取配制瓶,加入叔丁基溴(177g,1.3eq)、2-甲基四氢呋喃methf(500g),混合均匀,滴加部分混合液加入到反应瓶中,形成格氏反应体系,降温至40-50℃,滴加叔丁基溴混合溶液,,滴加完毕后,搅拌反应5h以上,将格氏反应液降温至-5到5℃,往反应釜中通入二氧化硫,通入的二氧化硫的重量为(171g,2.5eq)。在0℃左右保温反应1h后,向反应釜中滴加入浓硫酸淬灭反应,减压蒸馏,温度控制在30-45℃,减压蒸馏干至粘稠液(除去过量的二氧化硫),然后加入四氢呋喃、乙酸乙酯,滴加水,加入食盐,室温搅拌10-30分钟使体系饱和,静置分层,保留有机相。有机相在30-45℃的温度下减压蒸馏,得到油状物。往釜内加入二氯甲烷,然后加入无水硫酸钠进行干燥。将反应釜中的混合物排出,抽滤,在35-50℃的温度下减压蒸馏去除溶剂,得到化合物2——叔丁基亚磺酸85g(收率65%)。
[0022]
化合物3的制备在干燥的反应瓶中依次加入化合物2(15g,1.0eq)、n,n-二甲基甲酰胺(dmf,0.9g,0.1eq)、二氯乙烷(75ml,5v),在氮气保护下搅拌,降温至5-10℃,将氯化亚砜(20g,1.4eq)缓慢滴加反应瓶中,滴加完毕后,升至室温20-25℃。将反应瓶抽真空,压力不断减小,保持至反应瓶中无气泡产生。将反应瓶的外温升至50-55℃,采用油泵进行蒸馏,得到12g化合物3,收率为70%。
[0023]
化合物4-1(正丙酯)的制备将5g(1.0eq)化合物3溶于20ml甲基叔丁基醚中,制备化合物3的甲基叔丁基醚溶液,待用。
[0024]
在500ml的三口瓶中,加入正丙醇10.7g(5.0eq)、辛可宁12.5g(1.2eq)和150ml甲
基叔丁基醚,氮气保护,降温至-35℃(
±
5℃),滴加化合物3的甲基叔丁基醚溶液,滴加过程中温度控制在-35℃(
±
5℃)左右;滴完后在-35℃左右保温反应1h,结束反应。
[0025]
后处理:向反应体系中加入水,滴加10wt%硫酸水溶液调ph,最终搅拌至体系澄清分层,下层水相再用甲基叔丁基醚萃取一次,有机相加入水搅洗10分钟,有机相分别用饱和碳酸氢钠水溶液与饱和nacl水溶液搅洗,分层,有机相加无水硫酸钠干燥,过滤,减压蒸馏掉甲基叔丁基醚,得到化合物4-1的粗品6.3g。通过正相hplc色谱检测可见r构型产物与s构型产物的比例为82∶18。
[0026]
化合物tm的制备在300ml的四口瓶中,氮气保护,配备干冰浴、氨气冷凝装置和氨气尾气吸收装置。
[0027]
在-75℃左右用氨气钢瓶通氨气进入瓶中,收集约150ml干燥液氨。加入0.51g(0.1eq)九水合硝酸铁,搅拌溶解澄清。分批加入共14.7g(5.0eq)的金属钠。然后滴加21g(1.0eq)化合物4-1的甲基叔丁基醚溶液,温度控制在-65~-55℃,反应结束,分批加入23g固体氯化铵,温度控制在-50℃以下,撤去干冰浴,连通氨气尾气吸收装置,水泵减压除去氨气。加入水,加入四氢呋喃和乙酸乙酯,萃取分液,有机相暂存。水相加入甲基叔丁基醚萃取两次,合并有机相,半饱和盐水洗一次,无水硫酸钠干燥,过滤,油泵减压蒸不出溶剂,此时粗品约20g。在粗品中加入400ml正庚烷,加热至约65℃,使固体溶清;趁热过滤,滤饼弃去。滤液在外温为65℃的温度下减压蒸馏至约130ml后在室温下(约25℃)析晶,析晶后期将析晶体系的温度降至10℃以下继续析晶2小时。过滤,滤液弃去。将晶体干燥,得到化合物tm的纯品14.5g。
[0028]
实施例2化合物2的制备在干燥的玻璃反应釜中,氮气保护,加入镁屑(10g,1.0eq),加热至45-55℃,另取配制瓶,加入叔丁基碘(98g,1.3eq)、甲基叔丁基醚(300g),混合均匀,滴加混合液加入到反应瓶中,形成格氏反应体系,降温至40-50℃,继续滴加叔丁基溴混合溶液,滴加完毕后,搅拌反应5h以上,将格氏反应液降温至-5到5℃,往反应釜中通入二氧化硫,通入的二氧化硫的重量为(60g,2.3eq)。在0℃左右保温反应1h后,向反应釜中滴加入浓硫酸淬灭反应,减压蒸馏,温度控制在30-45℃,减压蒸馏干至粘稠液(除去过量的二氧化硫),然后加入四氢呋喃、
乙酸乙酯,滴加水,加入食盐,室温搅拌10-30分钟使体系饱和,静置分层,保留有机相。有机相在30-45℃的温度下减压蒸馏干,得到油状物,往反应釜内加入二氯甲烷,加入无水硫酸钠进行干燥。将反应釜中的混合物排出,抽滤,在35-50℃的温度下减压蒸馏干得到化合物2——叔丁基亚磺酸50g,收率为20%。
[0029]
化合物3的制备干燥的反应釜中依次加入化合的2(150g,1.0eq)、n,n-二甲基甲酰胺(9g,0.1eq)、二氯乙烷(750ml,5v),在氮气保护下搅拌,降温至5-10℃,将氯化亚砜(190g,1.3eq)缓慢滴加反应瓶中,滴加完毕后,升至室温20-25℃,将反应釜抽真空,压力不断减小,保持至反应瓶中无气泡产生,将反应釜的外温升至50-55℃,采用油泵进行蒸馏,得到121g化合物3,收率为70%。
[0030]
化合物4-2(异丙酯)的制备将15g化合物3溶于60ml甲基叔丁基醚中,制备化合物3的甲基叔丁基醚溶液,待用。
[0031]
在1000ml的三口瓶中,加入异丙醇26g、奎宁38g和400ml甲基叔丁基醚,在氮气保护下,降温至-35℃(
±
5℃),滴加化合物3的甲基叔丁基醚溶液,滴加过程中控制温度在-35℃(
±
5℃);滴完后-35℃保温反应1h。
[0032]
后处理:向反应体系中加入水,滴加10wt%硫酸水溶液调ph至2,最终搅拌至体系澄清分层,下层水相再用甲基叔丁基醚萃取一次,有机相加入水搅洗10分钟,有机相分别用饱和碳酸氢钠水溶液与饱和nacl水溶液搅洗,分层,有机相加无水硫酸钠干燥,过滤,减压蒸馏掉甲基叔丁基醚,得到化合物4-2(异丙酯)的粗品18g。通过正相hplc色谱检测可见r构型产物与s构型产物的比例为9.7∶90.3。
[0033]
化合物tm的制备
在500ml的四口瓶中,氮气保护,配备干冰浴、氨气冷凝装置和氨气尾气吸收装置。
[0034]
在-75℃左右用氨气钢瓶将氨气通入瓶四口瓶中,收集约22ml干燥液氨。加入0.6g九水合硝酸铁,搅拌溶解澄清。分批加入共3.2g金属锂。然后滴加25g化合物4-2的2-甲基四氢呋喃溶液,温度控制在-65~-55℃,反应结束,分批加入30g固体氯化铵淬灭生成的氨基锂,温度控制在-50℃以下,撤去干冰浴,连通氨气尾气吸收装置,水泵减压除去氨气。加入水,加入四氢呋喃和乙酸乙酯,萃取分液,有机相暂存。水相萃取两次,合并有机相,半饱和盐水洗一次,无水硫酸钠干燥,过滤,油泵减压蒸馏至不出溶剂,此时粗品约21g。粗品用正庚烷纯化,得到化合物tm((r)-叔丁基亚磺酰胺)11g,收率60%。
[0035]
实施例3 在本实施例中,其他步骤与实施例1相同,区别在于,化合物4-3通过以下方法制备。
[0036]
化合物4-3(异丁酯)的制备将2g(14.2 mmol,1.0eq)化合物3溶于6ml甲基叔丁基醚中,待用;在200ml的三口瓶中,加入异丁醇3.2g(42.6 mmol,3.0eq)、奎尼丁5.07g(15.6 mmol,1.1 eq)和60ml甲基叔丁基醚,氮气保护,降温至-50℃
±
5℃,滴加化合物3的甲基叔丁基醚溶液,滴加过程中控制温度在-30℃(
±
5℃)以下;滴完后在-35℃的温度下保温反应2h,发现反应体系变粘稠,无法继续搅拌。将反应体系升温至-25℃,继续反应两小时,经检测原料反应完全。
[0037]
后处理:加入冰水,滴加10%的硫酸水溶液调节ph=2,最终搅拌至体系澄清分层,下层水相再用甲基叔丁基醚萃取一次,有机相加入水溶液搅洗10分钟,有机相分别用饱和碳酸氢钠水溶液与饱和nacl水溶液搅洗,分层,有机相加无水硫酸钠干燥,过滤,减压蒸馏掉甲基叔丁基醚,得到化合物4-3(异丁酯)的粗品2.1g。通过正相hplc检测可见r构型产物与s构型产物的比例为94.5∶5.5。
[0038]
手性生物碱化合物奎尼丁的回收:在后处理得到的水相中,采用乙酸乙酯萃取,弃去有机相。采用氢氧化钠溶液将水相的ph调节至11-12,收集析出的固体,水洗或打浆,过滤后,得到回收的奎尼丁5.02g,回收率99%。
[0039]
实施例4
在本实施例中,其他步骤与实施例3相同,区别在于,化合物4-3通过以下方法制备:化合物4-3(异丁酯)的制备将2g(14.2 mmol,1.0eq)化合物3溶于60ml异丙醚中,待用;在200ml的三口瓶中,加入异丁醇3.2g(42.6 mmol,3.0eq)、异丙醚(40ml)、回收的奎尼丁5.07g(15.6 mmol,1.1 eq)和60ml异丙醚,氮气保护,降温至-50℃
±
5℃,滴加化合物3的异丙醚溶液,滴加过程中控制温度在-30℃(
±
5℃)以下;滴完后在-35℃的温度下保温反应2h,经检测原料反应完全。
[0040]
后处理:向反应体系中加入冰水,滴加10%的硫酸水溶液调节ph=2,最终搅拌至体系澄清分层,下层水相再用异丙醚萃取一次,有机相加入水搅洗10分钟,有机相分别用饱和碳酸氢钠水溶液与饱和nacl水溶液搅洗,分层,有机相加无水硫酸钠干燥,过滤,减压蒸馏掉异丙醚,得到化合物4-3(异丁酯产物)的粗品2.2g。通过正相hplc检测可见r构型产物与s构型产物的比例为95.35∶4.65(参见图1)。
[0041]
参照实施例1,采用化合物4-3制备化合物tm。通过正相hplc检测,在化合物4-3中,r构型产物与s构型产物的比例(ee%)为99.81%。
[0042]
将化合物tm的市售标准品的正相hplc图谱(参见图2)与本实施例得到的化合物tm的正相hplc图谱(参见图3)进行对比,可见二者的出峰位置和峰面积基本一致。图4为(r)-叔丁基亚磺酰胺的1h nmr图谱。根据图谱数据,可以确定本发明的方法制备得到的化合物tm正是(r)-叔丁基亚磺酰胺。
[0043]
参照实施例的方法回收手性生物碱化合物。
[0044]
实施例5在本实施例中,其他步骤与实施例3相同,区别在于,化合物4-3通过以下方法制备。
[0045]
化合物4-3(异丁酯)的制备在50ml的三口瓶中,加入0.5g化合物3(3.56 mmol,1.0 eq)、异丁醇0.79g(10.68 mmol,3.0 eq)、乙酸乙酯10ml(20v)、奎尼丁1.27g(3.92 mmol,1.1 eq)和,搅拌,固体未完全溶解。氮气保护,降温至-15℃
±
5℃。滴加化合物3的乙酸乙酯(4v)溶液,滴加过程中控制温度在-10℃(
±
5℃)以下;滴完后在-15℃的温度下保温反应3h,经检测原料反应完全。
[0046]
后处理:向反应体系中加入冰水,滴加1m hcl调节ph=2,最终搅拌至体系澄清分层,下层水相再用乙酸乙酯萃取一次,有机相加入水搅洗10分钟,有机相分别用饱和碳酸氢钠水溶液与饱和nacl水溶液搅洗,分层,有机相加无水硫酸钠干燥,过滤,减压蒸馏掉乙酸乙酯,得到化合物4-3(异丁酯)的粗品0.5g。通过正相hplc检测可见r构型产物与s构型产物的比例为89.6∶10.4。
[0047]
实施例6在250ml的三口瓶中,加入5.0g化合物3(35.56 mmol,1.0 eq)、异丁醇89g(10.7 mmol,3.0 eq)、异丙醚150ml(30v)、奎宁12.7g(39.1 mmol,1.1 eq),搅拌。氮气保护,降温至-50℃
±
5℃。滴加化合物3的异丙醚溶液,滴加过程中控制温度在-30℃(
±
5℃)以下;滴完后-25℃保温反应2h,经检测原料反应完全。
[0048]
后处理:向反应体系中加入冰水,滴加10%硫酸溶液调节ph=2-3,最终搅拌至体系澄清分层,下层水相再用异丙醚萃取一次,有机相加入水搅洗10分钟,有机相分别用饱和碳酸氢钠水溶液与饱和nacl水溶液搅洗,分层,有机相加无水硫酸钠干燥,过滤,减压蒸馏掉异丙醚,得到化合物4-3(异丁酯产物)的粗品4.9g。通过正相hplc检测可见r构型产物与s构型产物的比例为8.2∶91.8。。
[0049]
实施例7在本实施例步骤与加料比例与实施例5相同,与实施例5的区别在于:将反应步骤中的乙酸乙酯替换为甲苯。
[0050]
化合物4-3(异丁酯)的制备在100ml的三口瓶中,加入1.0g化合物3(7.11 mmol,1.0 eq)、异丁醇1.6g(21.3 mmol,3.0 eq)、甲苯20ml(20v)、奎尼丁2.54g(7.832 mmol,1.1 eq),搅拌。氮气保护,降温至-15℃
±
5℃。滴加化合物3的甲苯酯(4v)溶液,滴加过程中控制温度在-10℃(
±
5℃)以下;滴完后在-15℃下保温反应0.5h,经检测原料反应完全。
[0051]
后处理:向反应体系中加入冰水,滴加10wt%硫酸溶液调节ph=2,最终搅拌至体系澄清分层,下层水相再用甲苯萃取一次,有机相加入水搅洗10分钟,有机相分别用饱和碳酸氢钠水溶液与饱和nacl水溶液搅洗,分层,有机相加无水硫酸钠干燥,过滤,减压蒸馏掉甲苯,得到化合物4-3(异丁酯)的粗品1.4g。通过正相hplc检测可见r构型产物与s构型产物的比例为91.4∶8.6。
[0052]
实施例8本实施例步骤与加料比例与实施例5相同,与实施例5的区别在于:将反应步骤中的乙酸乙酯替换为四氢呋喃。
[0053]
化合物4-3(异丁酯)的制备
在50ml的三口瓶中,加入0.5g化合物3(3.56 mmol,1.0 eq)、异丁醇0.79g(10.68 mmol,3.0 eq)、四氢呋喃10ml(20v)、奎尼丁1.27g(3.92 mmol,1.1 eq)和,搅拌,固体未完全溶解。氮气保护,降温至-15℃
±
5℃。滴加化合物3的四氢呋喃(4v)溶液,滴加过程中控制温度在-50℃(
±
5℃)以下;滴完后-55℃保温反应2h,经检测原料反应完全。
[0054]
后处理:向反应体系中加入冰水,滴加1m hcl调节ph=2,最终搅拌至体系澄清分层,下层水相再用25ml乙酸乙酯萃取一次,有机相加入水搅洗10分钟,有机相分别用饱和碳酸氢钠水溶液与饱和nacl水溶液搅洗,分层,有机相加无水硫酸钠干燥,过滤,减压蒸馏掉四氢呋喃,得到化合物4-3(异丁酯)的粗品0.67g。通过正相hplc检测可见r构型产物与s构型产物的比例为92.5:7.5。
[0055]
实施例9本实施例的步骤与加料比例与实施例8相同,与实施例8的区别在于:将异丁醇替换为叔丁醇。
[0056]
在50ml的三口瓶中,加入0.5g化合物3(3.56 mmol,1.0 eq)、叔丁醇0.80g(10.68 mmol,3.0 eq)、四氢呋喃10ml(20v)、奎尼丁1.27g(3.92 mmol,1.1 eq)和,搅拌,固体未完全溶解。氮气保护,降温至-55℃
±
5℃。滴加化合物3的四氢呋喃(4v)溶液,滴加过程中控制温度在-50℃(
±
5℃)以下;滴完后-60℃保温反应1h,经检测原料未反应。
[0057]
将反应体系的温度升高至-30℃至-25℃,继续反应1h,经检测原料未反应。
[0058]
将反应体系的温度升高至0℃至5℃,继续反应2.5h,经检测原料仍未反应。
[0059]
将反应体系的温度升高至室温,继续反应2h,经检测原料仍未反应。经分析,可能是由于叔丁醇位阻较大,难以与化合物3反应生成生成叔丁酯。
[0060]
实施例10本实施例的步骤与加料比例与实施例8相同,与实施例8的区别在于:将反应步骤中的异丁醇替换为3-戊醇。
[0061]
经反应和后处理得到化合物4-10的粗品0.72g,通过正相hplc色谱检测可见r构型产物与s构型产物的比例为60∶40。
[0062]
实施例11本实施例的步骤与加料比例与实施例8相同,与实施例8区别在于:将反应步骤中的异丁醇替换为苄醇。
[0063]
按照实施例8的步骤和操作,经反应和后处理得到化合物4-11的粗品0.81g,通过正相hplc色谱检测可见r构型产物与s构型产物的比例为90.3∶9.7。
[0064]
实施例12在本实施例中,其他步骤与实施例4相同,区别在于,化合物4-3通过以下方法制备:化合物4-3(异丁酯)的制备。
[0065]
将3g(21.4 mmol,1.0eq)化合物3溶于6ml(2v)异丙醚中,待用。在200ml的三口瓶中,加入异丁醇4.8g(64.0 mmol,3.0eq)、异丙醚(60ml,20v)、奎尼丁3.5g(1.74 mmol,0.5 eq)、咪唑1.75g(25.7 mmol,1.2eq)和60ml异丙醚,氮气保护,降温至-35℃
±
5℃,滴加化合物3的异丙醚溶液,滴加过程中控制温度在-20℃(
±
5℃)以下;滴完后在-35℃的温度下保温反应2h,经检测原料反应完全。
[0066]
后处理与实施例4相同。经后处理后,得到化合物4-3(异丁酯产物)的粗品2.2g。通过正相hplc检测,得到消旋的产物,r构型与s构型产物各占50%,未继续下一步的反应。
[0067]
实施例13在本实施例中,操作步骤、加料比例与实施例12相同,区别在于,将咪唑替换为dmap(n,n-二甲基-4-吡啶胺)。反应产物经正相hplc检测,得到消旋的产物,r构型与s构型产物各占50%,未继续下一步的反应。
[0068]
实施例14在本实施例中,操作步骤、加料比例与实施例12相同,区别在于,将咪唑替换为dbn(1,5-二氮杂双环[4.3.0]-5-壬烯)。反应产物经正相hplc检测,得到的r构型产物占60%,s构型产物占40%,未继续下一步的反应。
[0069]
实施例15
在本实施例中,操作步骤、加料比例与实施例12相同,区别在于,将咪唑替换为1-甲基吡咯烷。反应产物经正相hplc检测,得到的r构型产物占70.4%,s构型产物占29.6%,未继续下一步的反应。
[0070]
实施例16与实施例12相比,在本实施例的区别在于,将咪唑替换为n,n-二苯基丙胺,且n,n-二苯基丙胺相对于化合物3的投料量为0.8eq。反应产物经正相hplc检测,得到的r构型产物占80.3,s构型产物占19.7%,未继续下一步的反应。
[0071]
从实施例12-16可以看出,手性生物碱化合物奎尼丁的加料摩尔比对手性产物中r构型产物和s构型产物的比例具有较大的影响。在手性生物碱化合物的投料摩尔比较小时,难以得到比例较高的r构型产物。
[0072]
实施例17在本实施例中,其他步骤与实施例4相同,区别在于,奎尼丁相对于化合物3的投料量为1.0eq,反应产物经正相hplc检测,得到的r构型产物占94.0%,s构型产物占6.0%,未继续下一步的反应。
[0073]
实施例18在本实施例中,其他步骤与实施例4相同,区别在于,奎尼丁相对于化合物3的投料量为2.0eq,反应产物经正相hplc检测,得到的r构型产物占95.2%,s构型产物占4.8%,未继续下一步的反应。
[0074]
从实施例12-18可以看出,手性生物碱化合物奎尼丁的加料摩尔比对手性产物中r构型产物和s构型产物的比例具有较大的影响。在手性生物碱化合物的投料摩尔比较小时,难以得到比例较高的r构型产物。
[0075]
本发明提供了一种制备(r)-叔丁基亚磺酰胺的方法,该方法以卤代叔丁烷为作为起始原料,采用手性生物碱化合物作为反应试剂,制备(r)-叔丁基亚磺酰胺,可以获得较高的手性纯度的(r)-叔丁基亚磺酰胺,且手性生物碱化合物可以回收利用,手性生物碱化合物回收率高,具有良好的工业化前景。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



