一种用于可视化检测芋疫霉的LFD-RPA引物与探针组合及其检测方法与流程
 2021-02-02 00:02:35|
2021-02-02 00:02:35| 310|
310| 起点商标网
起点商标网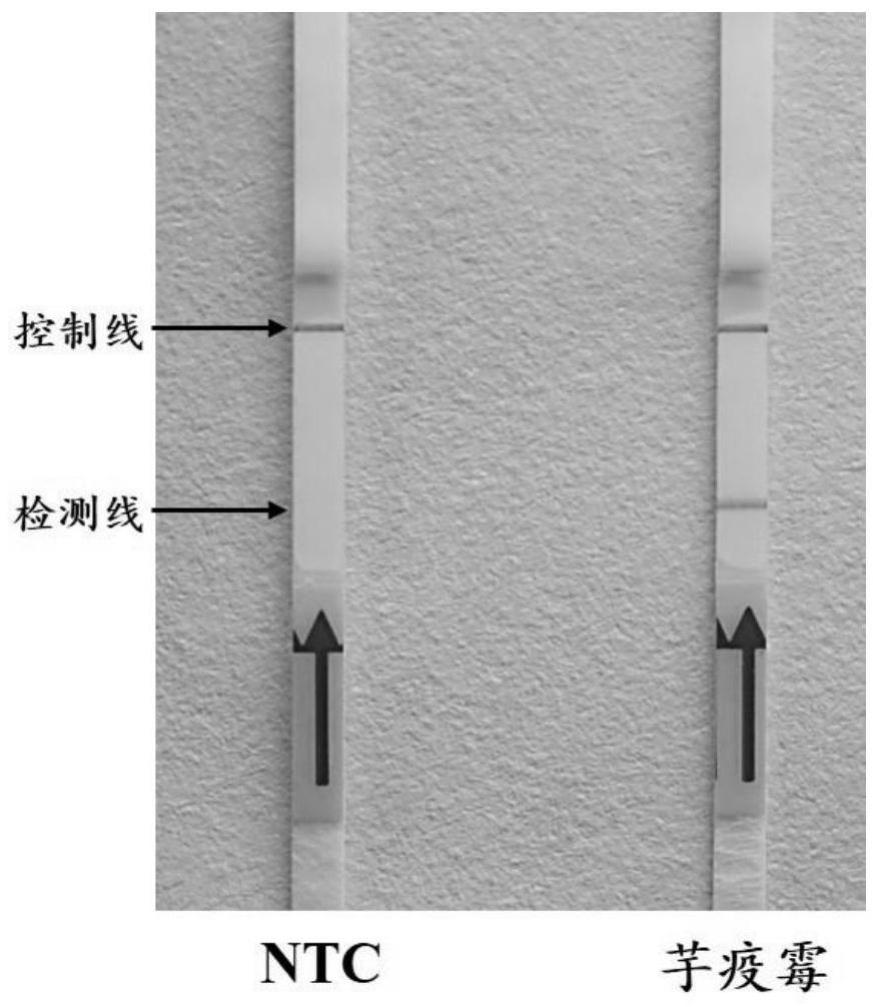
一种用于可视化检测芋疫霉的lfd-rpa引物与探针组合及其检测方法
技术领域
[0001]
本发明涉及生物技术领域,更具体的说是涉及一种用于可视化检测芋疫霉的lfd-rpa引物与探针组合及其检测方法。
背景技术:
[0002]
芋(colocasia esculenta)又称芋头、芋艿或毛芋等,是天南星科(araceae)芋属(colocasia)多年生块茎植物,但常被作为一年生植物来栽培,是一种重要的经济作物,主要在我国华南、西南和长江流域种植。芋疫病是芋生产上的一种常见的病害,其分布范围较广,特别是在我国南方发生普遍,该病由芋疫霉菌(phytophthora colocasiae racib.)侵染引起,一般4月开始零星发病,6~9月盛行,主要危害叶片、叶柄,严重时亦危害球茎,遇高温、雨天病斑快速发展,导致叶片大量腐烂、植株折倒,一般田间发病率在20%~30%,严重时发病率达100%,造成芋头产量和品质下降,严重制约各种芋品种产业发展。
[0003]
疫霉菌传统的检测鉴定方法是以分离物形态学、生物学、致病性和生理生化特征指标作为依据,对照已有的研究数据确定其分类地位。但由于疫霉属卵菌形态变异大,一些用于分类、鉴定的形态学特征易受环境条件和人为因素影响,存在不稳定性,特别是有些典型的形态学特征难以产生,使得传统鉴定十分困难。基于pcr的分子检测技术已经成功用于芋疫霉的检测,但是巢式pcr需要经过两轮扩增,耗费时间较长,并且依赖精密、专业的温度循环仪器,不能满足快速检测的需求。
[0004]
重组酶聚合酶扩增(recombinase ploymerase amplification,rpa)技术是一项由多种酶和蛋白参与,在恒定温度条件下实现核酸指数扩增的新技术,具有反应灵敏、高效、性价比高的特点。它与pcr不同,不需要退火反应过程,可在25℃~42℃等温条件下快速完成核酸扩增,产物可以通过探针法荧光定量进行实时监测,也可以与侧流层析试纸条、生物芯片、凝胶电泳等多种方法相结合进行检测。
[0005]
重组酶聚合酶核酸扩增技术(rpa)与侧流层析试纸条(lateral flow dipstick,lfd)结合应用形成的lfd-rpa体系经过恒温短时间扩增反应后,肉眼即可观察扩增产物在侧流试纸条上的检测结果,不需复杂仪器设备,适合现场快速检测。目前lfd-rpa检测主要应用于人畜病原物、食品安全和环境卫生的检测,但在植物病原卵菌检测中报道较少,尤其是对芋疫霉的检测国内外均未见相关应用报道。
[0006]
因此,提供一种用于可视化检测芋疫霉的lfd-rpa引物与探针组合及其检测方法是本领域技术人员亟需解决的问题。
技术实现要素:
[0007]
有鉴于此,本发明提供了一种用于可视化检测芋疫霉的lfd-rpa引物与探针组合及其检测方法,本发明的lfd-rpa检测引物与探针组合特异性强、灵敏度高;检测方法简便快速,且结果可靠。
[0008]
为了实现上述目的,本发明采用如下技术方案:
[0009]
一种用于可视化检测芋疫霉的lfd-rpa检测引物与探针组合,所述lfd-rpa检测引物与探针核苷酸序列分别为:
[0010]
上游引物pcorpalfd-f:5
’-
caggattgctgacttggtggtattctctag-3
’
;seq id no.4;
[0011]
下游引物pcorpalfd-r:5
’-
gatgacgagtcttaaactttggttgcttac-3
’
;seq id no.5;5
’
端加入一个生物素biotin标记位点;
[0012]
探针pcorpalfd-p:5
’-
[fam]ggtggtattctctagaaaatccgtacgatc[thf]agttggacggcaaga[c3 spacer]-3
’
。
[0013]
与常规pcr反应不同,rpa反应所需引物的长度通常为30~35bp,探针序列的长度为46~52bp,引物设计时为了避免形成引物内部及之间的二级结构,其长度的增加也使引物设计及选择难度的增加;因此,引物的设计和选择对rpa的结果至关重要。rpa技术正处于起步研究阶段,尚无专门的引物、探针设计软件,也没有大量的数据为其引物设计原则提供依据。因此,本发明的引物和探针组合具备创造性。
[0014]
进一步,一种利用所述可视化检测芋疫霉的lfd-rpa检测引物与探针组合进行lfd-rpa反应检测芋疫霉的方法,包括以下步骤:
[0015]
(1)提取待检测样品基因组dna;
[0016]
当用于芋头组织中存在芋疫霉的检测时,采用naoh快速裂解法提取样品dna,具体过程如下:(1)将芋头病茎或带病叶片洗净、晾干,剪取发病部位;(2)按1mg病组织中加入10μl(0.5mol/l naoh,0.5%pvp)计量,将组织充分磨碎成糊,12,000rpm离心5min;(3)取上清20μl与80μl的0.1mol/l的tris-hcl(ph8.0)混合;(4)混匀后取2.0μl模板进行扩增;
[0017]
发病土壤中芋疫霉基因组dna提取采用土壤dna提取试剂盒提取基因组dna;
[0018]
(2)lfd-rpa检测反应体系:以步骤(1)提取的基因组dna为模板,利用引物pcorpalfd-f和生物素标记的pcorpalfd-r及pcorpalfd-p探针进行扩增;反应体系为50μl,包含29.5μl反应缓冲液rehydrationbuffer,10μm pcorpalfd-f和生物素标记的pcorpalfd-r各2.1μl,探针10μm pcorpalfd-p 0.6μl,待测模板dna 2.0μl,无菌双蒸水11.2μl,将上述组分混匀后加入到50mg rpa冻干酶粉中,随后加入2.5μl 280mm醋酸镁并颠倒混匀;
[0019]
(3)lfd-rpa反应:步骤(2)的反应体系在39℃温育5min,将反应管再次混匀,继续39℃温育25min;
[0020]
(4)结果检测:采用侧流层析试纸条进行检测;取10μl步骤(3)的反应产物与100μl hybridetectassaybuffer混合,然后将试纸条垂直插入混合液中,室温静置5min后观察结果;试纸条出现两条紫红色条带,一条位于质控区内,一条位于检测区,则结果为阳性,表明样本中含有芋疫霉;当试纸条只有质控区出现一条紫红色条带,检测区没有条带,则结果是阴性,表明样本中不含有芋疫霉。
[0021]
进一步,所述的芋疫霉的lf-rpa检测引物与探针组合在芋疫霉的诊断、检测、鉴定中的应用。
[0022]
进一步,所述的芋疫霉lf-rpa检测引物与探针组合进行lf-rpa反应检测芋疫霉的方法在芋头疫病的诊断、检测、鉴定中的应用。
[0023]
本发明方法可用于带芋疫霉菌的植株和土壤的高灵敏度快速检测;建立芋疫霉快
速、简便、特异性强、灵敏度高的监测技术体系,对于芋疫霉引起病害显症之前的早期监测,确定病害防治最佳时期具有十分重要的意义。
[0024]
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种用于可视化检测芋疫霉的lfd-rpa引物与探针组合及其检测方法,适用于生产实践中发病组织或土壤中芋疫霉的快速可靠的检测和鉴定,对于农业生产中芋疫霉引起的病害防治具有重要的实用价值。具体具有以下的技术优势和积极效果:
[0025]
(1)本发明首次采用lfd-rpa技术建立可视化快速检测芋疫霉的分子检测方法,其具有特异性强、灵敏度高、结果可靠、实用性好及操作简便快捷的特点;
[0026]
(2)本发明基于芋疫霉ypt基因序列设计了特定引物和探针,该基因包含有多个内含子,其保守序列和进化区域相互间隔,因此在不同菌株间高度保守,并且对其它病原菌高度特异;由于目前对于rpa技术的引物和探针的设计尚未形成特定规则,也无专门的设计软件,因此本发明创造性地设计了引物与探针组合,扩增效果良好,条带特异性强,与其它病原菌无交叉反应;所建立的检测方法灵敏度高,对芋疫霉的检测灵敏度在dna水平上可达到1pg;
[0027]
(3)本发明的检测方法对芋疫霉dna的扩增和可视化检测可在30min内完成,且反应是在恒温条件下进行,无需热循环仪器,再者rpa反应的最适温度在37℃-40℃之间,无需变性,甚至常温下也可完成反应,极大的扩展了rpa适用范围,同时,其结果肉眼直接可见,可以真正实现便捷式的现场快速检测;
[0028]
(4)本发明对芋疫霉的检测方法实用性强,能够对组织中存在的芋疫霉进行快速检测和鉴定,是一种检测芋疫霉的有效手段。
附图说明
[0029]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
[0030]
图1附图为本发明芋疫霉的lfd-rpa检测结果图;
[0031]
其中,第1管(ntc)为阴性对照;第2管(芋疫霉)为含芋疫霉dna的阳性检测;
[0032]
图2附图为本发明芋疫霉的lfd-rpa特异性检测结果图;
[0033]
其中,ntc为阴性对照;1为芋疫霉dna(福建、江西、广西的22株芋疫霉检测结果一致,放一个图为代表);2-16为表1中编号4-18对应的其它病原卵菌和真菌菌株dna;
[0034]
图3附图为本发明芋疫霉lfd-rpa检测的反应温度结果图;
[0035]
其中,ntc为阴性对照;1-9反应温度分别为20℃、25℃、28℃、31℃、34℃、37℃、39℃、43℃、45℃;
[0036]
图4附图为本发明芋疫霉lfd-rpa检测的反应时间结果图;
[0037]
其中,ntc为阴性对照;1-7反应时间分别为5min、10min、15min、20min、25min、30min、35min;
[0038]
图5附图为本发明芋疫霉的lfd-rpa灵敏性检测结果图;
[0039]
其中,ntc为阴性对照;1-8模板dna浓度分别为100ng
·
μl-1
,10ng
·
μl-1
,1ng
·
μl
-1,100pg
·
μl-1
,10pg
·
μl-1
,1pg
·
μl-1
,100fg
·
μl-1
和10fg
·
μl-1
;
[0040]
图6附图为本发明对发病植株检测结果图;
[0041]
其中,ntc为阴性对照;1为芋疫霉dna(阳性对照);2-13为采自福建不同地区带有芋疫病的芋头叶片。
具体实施方式
[0042]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0043]
rpa扩增试剂盒twistamp
tm nfo kits是twistdx公司的产品,产品目录号为tanf002kit;其中,重组酶、单链结合蛋白和dna聚合酶以冻干粉状态储存于rpa反应管中;检测用milenia genline hybridetect试剂盒包含侧流层析试纸条和hybridetect assay buffer溶液,为德国milenia biotec gmbh公司产品,货号041;检测引物与探针由生工生物工程(上海)股份有限公司合成。
[0044]
实施例1芋疫霉lfd-rpa检测引物与探针的设计
[0045]
(1)芋疫霉(phytophthora colocasiae racib.)ypt基因的获得
[0046]
①
芋疫霉基因组dna的提取
[0047]
采用ctab法提取芋疫霉基因组dna,具体过程如下:取50mg冷冻干燥后的菌丝粉于1.5ml离心管中,加入900μl 2%ctab(十六烷基三甲基溴化铵)提取液(2%ctab;100mmol/l tris-hcl(三羟甲基氨基甲烷盐酸盐),ph 8.0;20mmol/l edta(乙二胺四乙酸二钠),ph 8.0;1.4mol/l nacl)和90μl 10%sds(十二烷基苯磺酸钠)后混匀,于55~60℃水浴1.5h,每10min振荡混匀一次,水浴1.5h后离心(12,000rpm)15min,取上清液加入与上清液等体积的酚/氯仿/异戊醇(酚、氯仿和异戊醇的体积比为25:24:1),离心(12,000rpm)5min,取上清液(水相),加入与上清液等体积的氯仿抽提一次(12,000rpm)离心5min,吸上清(350μl),加0.1倍体积(35μl)的3mol/l naac溶液和2倍体积(700μl)的冰无水乙醇,-20℃下沉淀30min后12,000rpm离心5min,轻轻地倒去上清液,加入700μl冰70%乙醇进行洗涤(稍离心,倾掉上清),在超净工作台上自然晾干无酒精味后用1
×
te(10mmol/l tris-hcl,0.1mmol/l edta,ph 8.0)溶液进行溶解,得到dna溶液,用紫外分光光度计检测dna浓度并稀释至100ng/μl待用。
[0048]
②
pcr反应体系:50μl反应体系,包含2
×
taq pcr mastermix 25μl,通用引物yph1f/yph2r(10μmol/l)各2μl,步骤
①
中提取的模板dna 100ng,用无菌双蒸水补足至50μl。
[0049]
通用引物的引物序列如下:
[0050]
yph1f:5
’-
cgaccatkggtgtggacttt-3
’
;seq id no.1;
[0051]
yph2r:5
’-
acgttctcmcaggcgtatct-3
’
;seq id no.2。
[0052]
③
pcr反应体系:步骤
②
的反应体系置于下列条件中反应,94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸30s,28个循环;最后72℃延伸10min。
[0053]
④
将步骤
③
反应所得产物送至生工生物工程(上海)股份有限公司进行测序,得
ypt基因的核苷酸序列,如seq id no.3所示。
[0054]5’-
tcaggattgctgacttggtggtattctctagaaaatccgtacgatcgagttggacggcaagaccatcaagctccagattgtaagcaaccaaagtttaagactcgtcatccacctgagtactctggactaattaatggttgtgccaactcccttgtgctcctgtagtgggacacggctggccaggagcgtttccgcacgattactagcagctactaccgtggtgcacacggcattatcgtggtgtacgatgtgacggaccaagagtcgttcaacaacgtcaagcagtggctgcatgagattgataggttcgtgacagaattattttaccagtgagtccctcagaaatgagctaactattttgtcgtgataaatttcagatacgcc-3
’
;seq id no.3。
[0055]
(2)芋疫霉lfd-rpa检测引物与探针的设计
[0056]
将所得芋疫霉ypt基因的核苷酸序列与其它已知疫霉属及亲缘关系较近病原菌的序列进行多重序列比对,选取芋疫霉特异序列,设计检测引物与探针。
[0057]
rpa引物长度一般为30至35个核苷酸,扩增片段大小在100~400bp之间,根据测序所得ypt基因的核苷酸序列,利用primer premier 5.0软件设计rpa上下游引物对,得到扩增效率高、灵敏度和特异性最好的引物对。引物序列如下:
[0058]
pcorpalfd-f:5
’-
caggattgctgacttggtggtattctctag-3
’
;seq id no.4;
[0059]
pcorpalfd-r:5
’-
gatgacgagtcttaaactttggttgcttac-3
’
;seq id no.5;在seq id no.5序列的5
’
端加入一个生物素(biotin)标记位点。
[0060]
根据rpa引物扩增片段设计一条大小为45bp的探针,探针的5
’
端添加有fam,3
’
端添加有c3-spacer,且在探针中距离5
’
端30bp处进行thf修饰。探针序列如下:
[0061]
pcorpalfd-p:5
’-
[fam]ggtggtattctctagaaaatccgtacgatc[thf]agttggacggcaaga[c3 spacer]-3
’
。
[0062]
实施例2lfd-rpa引物与探针组合对芋疫霉的可视化检测
[0063]
(1)芋疫霉基因组dna的提取:
[0064]
采用实施例1中ctab法提取芋疫霉基因组dna,用紫外分光光度计检测dna浓度并稀释至100ng/μl待用。
[0065]
(2)lfd-rpa反应体系:反应体系为50μl,包含29.5μl反应缓冲液(rehydration buffer),10μm pcorpalfd-f和生物素标记的pcorpalfd-r各2.1μl,探针10μm pcorpalfd-p 0.6μl,待测模板dna 2.0μl,无菌双蒸水11.2μl,将上述组分混匀后加入到rpa冻干酶粉中,随后加入2.5μl 280mm醋酸镁(mgac)并颠倒混匀;将模板dna替换为等量的ddh2o做阴性对照。
[0066]
(3)lfd-rpa反应:步骤(2)的反应体系在39℃温育5min,将反应管再次混匀,继续39℃温育25min;
[0067]
(4)结果检测:取10μl步骤(3)的反应产物与100μl hybridetect assay buffer混合,然后将试纸条垂直插入混合液中,室温静置5min后观察结果。试纸条出现两条紫红色条带,一条位于质控区内,一条位于检测区,则结果为阳性,表明样本中含有芋疫霉;当试纸条只有质控区出现一条紫红色条带,检测区没有条带,则结果是阴性,表明样本中不含有芋疫霉。
[0068]
本实施例的检测结果见图1。图1可视化检测结果表明:实验组以芋疫霉基因组dna为模板,试纸条出现两条紫红色条带,一条位于质控区内,一条位于检测区,为阳性;而对照组以ddh2o为模板,只在质控区出现一条紫红色条带,检测区没有条带,为阴性。说明本发明
的lfd-rpa检测引物与探针组合能够用于芋疫霉的可视化检测。
[0069]
实施例3lfd-rpa引物与探针组合对芋疫霉的特异性扩增
[0070]
以我国福建、江西、广西的22株芋疫霉和15种其它病原真菌及卵菌为供试材料,对检测引物与探针的特异性进行lfd-rpa验证。
[0071]
(1)供试菌株
[0072]
编号种名寄主来源菌株数1芋疫霉phytophthora colocasiae racib.芋colocasia esculenta福建152芋疫霉phytophthora colocasiae racib.芋colocasia esculenta江西33芋疫霉phytophthora colocasiae racib.芋colocasia esculenta广西44辣椒疫霉p.capsici辣椒capsicum frutescent福建15恶疫霉p.cactorum苹果malus pumila陕西16致病疫霉p.infestans马铃薯solanum tuberosum福建17大豆疫霉p.sojae大豆glycine max福建18荔枝霜疫霉peronophythora litchii荔枝litchi chinensis福建19掘氏疫霉p.drechsleri甜菜beta vularis福建110肉桂疫霉p.cinnamomi肉桂cinnamonmum cassia陕西111柑橘褐腐疫霉p.citrophthora柑橘citrus reticulata blanco陕西112隐地疫霉p.cryptogea非洲菊gerbera jamesonii福建113瓜果腐霉pythium aphanidermatum黄瓜cucumis sativus福建114尖孢镰刀菌fusarium oxysporum大豆glycine max福建115番茄早疫病菌alternaria solani番茄solanum lycopersicum福建116立枯丝核菌rhizoctonia solani水稻oryza glaberrima福建117核盘菌sclerotinia sclerotiorum油菜brassica napus福建118稻瘟病菌magnaporthe oryzae水稻oryza sativa福建1
[0073]
(2)供试菌株基因组dna的提取:
[0074]
采用实施例1中ctab法提取供试菌株基因组dna,用紫外分光光度计检测dna浓度并稀释至100ng/μl待用。
[0075]
(3)lfd-rpa反应体系:反应体系为50μl,包含29.5μl反应缓冲液(rehydration buffer),10μm pcorpalfd-f和生物素标记的pcorpalfd-r各2.1μl,探针10μm pcorpalfd-p 0.6μl,待测模板dna 2.0μl,无菌双蒸水11.2μl,将上述组分混匀后加入到rpa冻干酶粉中,随后加入2.5μl 280mm醋酸镁(mgac)并颠倒混匀;将模板dna替换为等量的ddh2o做阴性对照。
[0076]
(4)lfd-rpa反应:步骤(3)的反应体系在39℃温育5min,将反应管再次混匀,继续39℃温育25min。
[0077]
(5)结果检测:取10μl步骤(4)的反应产物与100μl hybridetect assay buffer混合,然后将试纸条垂直插入混合液中,室温静置5min后观察结果。试纸条出现两条紫红色条带,一条位于质控区内,一条位于检测区,则结果为阳性,表明样本中含有芋疫霉;当试纸条只有质控区出现一条紫红色条带,检测区没有条带,则结果是阴性,表明样本中不含有芋疫霉。
[0078]
本实施例的检测结果见图2。检测的特异性:除了芋疫霉检测结果可观察到试纸条出现两条紫红色条带,一条位于质控区内,一条位于检测区外,其它15种病原菌菌株检测试
纸条只有质控区出现一条紫红色条带,检测区没有条带,说明此检测引物与探针组合具有很强的特异性。
[0079]
实施例4芋疫霉lfd-rpa检测的反应温度
[0080]
(1)芋疫霉基因组dna提取:采用实施例1中ctab法提取芋疫霉基因组dna。
[0081]
(2)lfd-rpa反应体系:反应体系为50μl,包含29.5μl反应缓冲液(rehydrationbuffer),10μm pcorpalfd-f和生物素标记的pcorpalfd-r各2.1μl,探针10μm pcorpalfd-p 0.6μl,待测模板dna 2.0μl,无菌双蒸水11.2μl,将上述组分混匀后加入到rpa冻干酶粉中,随后加入2.5μl 280mm醋酸镁(mgac)并颠倒混匀;将模板dna替换为等量的ddh2o做阴性对照。
[0082]
(3)lfd-rpa反应:步骤(2)的反应体系分别在不同温度梯度(20℃、25℃、28℃、31℃、34℃、37℃、39℃、43℃、45℃)温育5min,将反应管再次混匀,继续相应温度温育25min。其中,20℃、25℃、28℃、31℃、34℃、37℃、43℃、45℃作为对比。
[0083]
(4)结果检测:取10μl步骤(3)的反应产物与100μl hybridetect assay buffer混合,然后将试纸条垂直插入混合液中,室温静置5min后观察结果。
[0084]
本实施例的检测结果见图3。结果显示试纸条在25℃-45℃之间均出现两条紫红色条带,一条位于质控区内,一条位于检测区,则结果为阳性,表明检测反应均可进行,但是在39℃时,其显色条带颜色最深且清晰,表明本发明选用的反应温度39℃结果最佳。
[0085]
实施例5芋疫霉lfd-rpa检测的反应时间
[0086]
(1)芋疫霉基因组dna提取:采用实施例1中ctab法提取芋疫霉基因组dna。
[0087]
(2)lfd-rpa反应体系:反应体系为50μl,包含29.5μl反应缓冲液(rehydration buffer),10μm pcorpalfd-f和生物素标记的pcorpalfd-r各2.1μl,探针10μm pcorpalfd-p 0.6μl,待测模板dna 2.0μl,无菌双蒸水11.2μl,将上述组分混匀后加入到rpa冻干酶粉中,随后加入2.5μl 280mm醋酸镁(mgac)并颠倒混匀;将模板dna替换为等量的ddh2o做阴性对照。
[0088]
(3)lfd-rpa反应:步骤(2)的反应体系在39℃温育5min,将反应管再次混匀,继续39℃温育至反应总时间分别为5min、10min、15min、20min、25min、30min、35min。其中,5min、10min、15min、20min、25min、35min作为对比。
[0089]
(4)结果检测:取10μl步骤(3)的反应产物与100μl hybridetect assay buffer混合,然后将试纸条垂直插入混合液中,室温静置5min后观察结果。本实施例的检测结果见图4。结果显示试纸条在20min~35min之间均出现两条紫红色条带,一条位于质控区内,一条位于检测区,则结果为阳性,表明检测反应均可进行,但是在30min时,其显色条带颜色最深且清晰,表明该检测反应最适总时间为30min。
[0090]
实施例6lfd-rpa引物与探针组合对芋疫霉的灵敏性检测
[0091]
(1)采用10倍浓度系列稀释法将提取的芋疫霉dna稀释成100ng
·
μl-1
,10ng
·
μl-1
,1ng
·
μl-1
,100pg
·
μl-1
,10pg
·
μl-1
,1pg
·
μl-1
,100fg
·
μl-1
和10fg
·
μl-1
dna,共8个不同浓度梯度。
[0092]
(2)lfd-rpa反应体系:反应体系为50μl,包含29.5μl反应缓冲液(rehydration buffer),10μm pcorpalfd-f和生物素标记的pcorpalfd-r各2.1μl,探针10μm pcorpalfd-p 0.6μl,待测模板dna 2.0μl,无菌双蒸水11.2μl,将上述组分混匀后加入到rpa冻干酶粉中,
随后加入2.5μl 280mm醋酸镁(mgac)并颠倒混匀;将模板dna替换为等量的ddh2o做阴性对照。
[0093]
(3)lfd-rpa反应:步骤(2)的反应体系在39℃温育5min,将反应管再次混匀,继续39℃温育25min。
[0094]
(4)结果检测:取10μl步骤(3)的反应产物与100μl hybridetect assay buffer混合,然后将试纸条垂直插入混合液中,室温静置5min后观察结果。试纸条出现两条紫红色条带,一条位于质控区内,一条位于检测区,则结果为阳性,表明样本中含有芋疫霉;当试纸条只有质控区出现一条紫红色条带,检测区没有条带,则结果是阴性,表明样本中不含有芋疫霉。
[0095]
本实施例的检测结果见图5。图5结果表明50μl体系中含有1pg/μl的芋疫霉dna的试纸条出现两条紫红色条带,呈阳性反应,表明lfd-rpa检测芋疫霉dna的灵敏度可达1pg/μl,具有很高的灵敏度。
[0096]
实施例7发病组织中芋疫霉的检测。
[0097]
(1)样品采集:采自福建省顺昌、龙岩、蒲城等地带病样品。
[0098]
(2)病组织基因组dna提取:发病植物组织采用naoh快速裂解法提取病组织基因组dna,具体过程如下:(1)将芋头病茎或带病叶片洗净、晾干,剪取发病部位;(2)按1mg病组织中加入10μl(0.5mol/l naoh,0.5%pvp)计量,将组织充分磨碎成糊,12,000rpm离心5min;(3)取上清20μl与80μl的0.1mol/l的tris-hcl(ph8.0)混合;(4)混匀后取2.0μl模板进行扩增。
[0099]
(3)lfd-rpa反应体系:反应体系为50μl,包含29.5μl反应缓冲液(rehydration buffer),10μm pcorpalfd-f和生物素标记的pcorpalfd-r各2.1μl,探针10μm pcorpalfd-p 0.6μl,待测模板dna 2.0μl,无菌双蒸水11.2μl,将上述组分混匀后加入到rpa冻干酶粉中,随后加入2.5μl 280mm醋酸镁(mgac)并颠倒混匀;将模板dna替换为等量的ddh2o做阴性对照。
[0100]
(4)lfd-rpa反应:步骤(3)的反应体系在39℃温育5min,将反应管再次混匀,继续39℃温育25min。
[0101]
(5)结果检测:取10μl步骤(4)的反应产物与100μl hybridetect assay buffer混合,然后将试纸条垂直插入混合液中,室温静置5min后观察结果。试纸条出现两条紫红色条带,一条位于质控区内,一条位于检测区,则结果为阳性,表明样本中含有芋疫霉;当试纸条只有质控区出现一条紫红色条带,检测区没有条带,则结果是阴性,表明样本中不含有芋疫霉。
[0102]
本实施例的检测结果见图6;图6结果表明,采自福建不同地区的带病样品及阳性对照rpa检测试纸条呈现两条紫红色条带,一条位于质控区内,一条位于检测区,结果为阳性,表明样本中含有芋疫霉;阴性对照只有质控区出现一条紫红色条带,证明了芋疫霉lfd-rpa检测方法检测结果准确可靠,具有很强的实用性。
[0103]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一
致的最宽的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



