猪星状病毒2型TaqMan荧光定量PCR试剂盒及其应用的制作方法
 2021-02-02 00:02:41|
2021-02-02 00:02:41| 328|
328| 起点商标网
起点商标网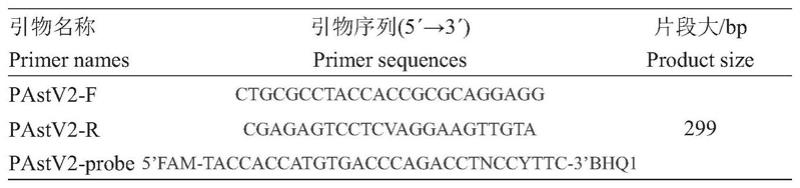
猪星状病毒2型taqman荧光定量pcr试剂盒及其应用
技术领域
[0001]
本发明涉及猪星状病毒2型taqman荧光定量pcr及其应用,属于生物医药领域,具体属于分子生物学技术领域。
背景技术:
[0002]
星状病毒是一种无囊膜包被的单股正链rna病毒,其基因组全长约6.4kb~7.3kb。星状病毒的宿主范围极广,可感染人、猪、牛、犬、猫等多种哺乳动物,以及鸡、鸭、火鸡等禽类动物。猪在感染星状病毒后常常表现为无症状或轻微腹泻等临床症状,因而被认为是一种腹泻相关病原。猪星状病毒目前可分为5个基因型(pastv1~pastv5),遗传进化分析结果显示,各基因型可能存在不同的进化祖先。流行病学调查结果显示,pastv在我国猪群内的流行率较高,且5个基因型均有发现。因此,建立一种快速、准确的pastv2实验室诊断方法,对于了解pastv2在我国猪群中的流行情况具有重要意义。本发明旨在建立一种可以快速、准确地检测pastv2的taqman荧光定量pcr方法,并以此为基础制备试剂盒,为pastv2的流行病学调查以及检测诊断pastv2提供准确、可靠的技术工具。
技术实现要素:
[0003]
为了弥补现有技术的不足,本发明的目的在于提供一种快速、准确地检测pastv2的taqman荧光定量pcr的试剂盒。
[0004]
因此,本发明一方面提供了一种猪星状病毒2型taqman荧光定量pcr检测试剂盒,所述的试剂盒包括检测猪星状病毒2型orf1ab保守基因序列的pcr反应液,所述的pcr反应液包括引物对和taqman探针,所述引物对和taqman探针的序列如下:
[0005]
pastv2-f:5
’-
ctgcgcctaccaccgcgcaggagg-3
’
;
[0006]
pastv2-r:5
’-
cgagagtcctcvaggaagttgta-3
’
;
[0007]
pastv2-probe:5
’-
fam-taccaccatgtgacccagacctnccyttc-3
’
bhq1。
[0008]
优选地,本发明所述的猪星状病毒2型taqman探针的核苷酸序列的5
’
端标记fam荧光报告基团,3
’
端标记bhq1淬灭基团。
[0009]
优选地,本发明所述的pcr反应液还包括2
×
primdirect probe rt-qpcr mix with ung
[0010]
优选地,本发明所述的试剂盒的反应体系为2
×
primdirect probe rt-qpcr mix with ung 12.5μl,pastv2-f、pastv2-r各0.5μl,pastv2-probe 0.5μl,处理后样本2μl,灭菌水补齐至25μl。
[0011]
优选地,本发明所述的试剂盒还包括标准品,所述标准品为猪星状病毒2型阳性样品cdna扩增片段回收纯化后克隆至pmd18-t中所得,所述标准品浓度为1.4
×
107copies/μl、1.4
×
106copies/μl、1.4
×
105copies/μl、1.4
×
104copies/μl、1.4
×
103copies/μl、1.4
×
102copies/μl。
[0012]
优选地,本发明所述的标准品中目的片段的序列如seq id no.1所示。
[0013]
优选地,本发明所述的试剂盒的反应条件为:90℃3min,56℃5min,为第一步循环;95℃5s,56℃30s,为第二步40个循环,所述第二步每个循环的延伸结束时进行荧光信号检测。
[0014]
另一方面,本发明还提供了一种使用所述的试剂盒检测猪星状病毒2型的方法,其特征在于,所述的方法包括以下步骤:1)样品的处理;2)将上述步骤所得样品作为模板,加到试剂盒的反应体系中,进行荧光定量pcr反应,并同时以标准品作为样品进行荧光定量pcr反应;3)以标准品ct值为纵坐标,以标准品浓度为横坐标做标准曲线,将样品的ct值代入标准曲线中计算样品的拷贝数。
[0015]
优选地,本发明所述的试剂盒检测猪星状病毒2型的方法中的步骤1)中的样品为粪便。
[0016]
再一方面,本发明还提供了一种所述的猪星状病毒2型taqman荧光定量pcr检测试剂盒在猪星状病毒2型诊断中的应用。
[0017]
本发明根据ncbi数据库上公布的pastv2的orf1ab基因序列进行比较分析,在保守区域设计1对特异性引物和探针,建立检测pastv2的taqman实时定量pcr的方法,并在此基础上形成了一种检测猪星状病毒2型taqman荧光定量pcr检测试剂盒。该试剂盒的重复性试验得到的平均变异系数结果较好(<2%);运用该试剂盒建立的标准曲线有良好的线性关系,相关系数可达0.9971。与其他病毒同时检测无交叉反应,能特异性检测pastv2,并具有较好的稳定性和重复性。目前,针对pastv2的研究尚处于初级阶段,pastv2尚未被分离到,pastv2单独感染以及与其他pastv基因型混合感染的致病力均有待于进一步研究。本发明所建立的pastv2 taqman荧光定量检测试剂盒,为pastv2的快速检测及其流行病学调查提供了快速、简便、可靠的检测手段。
[0018]
相比于传统的sybr green法,本发明所使用的的taqman探针法具有如下优点:(1)本发明无需提取样品内rna,收集的粪便等样品经处理后可直接加入反应液中进行rt-qpcr反应,节约了大量的时间成本。(2)本发明根据保守性特异序列设计并合成特异性引物及taqman探针,采用荧光定量pcr方法快速灵敏地检测猪星状病毒2型,准确性、特异性和敏感性高,稳定性好,可实现对待测样本的快速、有效检测。(3)由于采用定量检测技术-taqman-荧光定量pcr(real-time pcr),该方法(real-time pcr)具有单管封闭操作防污染、自动化程度高、特异性强、可实时监控等优点,有效地解决了传统方法只能终点检测的局限。(4)由于探针的3
’
端的淬灭基团为不发光的荧光基团,并且与报告基团在空间上的位置更接近,实验灵敏度更高,特异性更强。(5)taqman探针法荧光定量pcr方法简便、快速,整个过程可在一个小时内完成,计算机自动报告结果,无需电泳及其他后续的工作,即方便了操作又减少了污染。
附图说明
[0019]
图1为本发明中标准品重组质粒的pcr扩增结果。
[0020]
图2为本发明中pastv2 taqman pcr扩增曲线(a)和标准曲线(b)。
[0021]
图3为本发明中pastv2 qpcr扩增引物的熔解曲线,其中1~7:猪星状病毒2型1.4
×
101copies/μl~1.4
×
107copies/μl的dna;8:阴性对照。
[0022]
图4为本发明中pastv2 taqman荧光定量qpcr的特异性分析图。
具体实施方式
[0023]
以下结合具体实施例进一步阐述本发明。下述实施例中所涉及各种原料,如无特别说明,均为市售。
[0024]
实施例1材料与方法
[0025]
1.1阳性样品材料
[0026]
猪星状病毒2型(pastv2)、猪肠道病毒(porcine enteric virus,pev)、猪塞内卡病毒(senecavirus,svv)、猪伪狂犬病病毒(porcine pseudorabies virus,prv)、猪瘟病毒(classical swine fever virus,csfv)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory virus,prrsv)的阳性核酸样本,均由本实验室鉴定保存。猪流行性腹泻病毒(porcine epidemic diarrhea virus,pedv)、猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus,tgev)、猪轮状病毒(porcine rotavirus,rv)三联活疫苗购自哈尔滨维科生物技术开发公司。猪乙脑病毒(japanense encephalitis virus,jev)购于武汉科前生物股份有限公司。
[0027]
1.2主要试剂
[0028]
pmd18-t载体、e.coli dh5α感受态细胞购自全式金生物技术有限公司。琼脂糖凝胶回收试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司。premix taq
tm
、dl2000 dna marker、rnaiso plus、2
×
primdirect probe rt-qpcr mix with ung均为宝日医生物技术公司产品。
[0029]
1.3主要仪器
[0030]
nanodrop onec超微量紫外分光光度计购自美国赛默飞世尔科技公司。lightcycler 96实时荧光定量pcr仪购自德国罗氏诊断有限公司。核酸水平电泳仪购自北京六一生物科技有限公司。pcr仪购自美国伯乐bio-rad公司。
[0031]
1.4引物、探针的设计与合成
[0032]
收集genbank上登录的pastv2 orf1ab基因序列,并进行比对分析,在其保守区域设计特异性引物(pastv2-f/r)和荧光探针(pastv2-probe),序列见表1,探针及引物由生工生物工程(上海)股份有限公司合成,并用ddh2o稀释至浓度为10μmol/l,-20℃保存备用。
[0033]
表1引物序列
[0034][0035]
1.5样品处理
[0036]
用pbs将粪便样品进行10倍漩涡震荡稀释,8 000
×
g,4℃离心,取上清,-80℃保存。
[0037]
1.6标准品的制备
[0038]
以阳性pastv2样品cdna作为模板,利用以上qpcr引物pcr扩增相应片段,经琼脂糖凝胶电泳后,胶回收纯化目的片段并克隆至pmd18-t载体。将所得重组质粒转化e.coli dh5α感受态细胞,取单克隆菌落,lb培养基增菌培养16h后提取质粒。提取的重组质粒经双酶切
鉴定和测序鉴定为阳性后命名为pmd19-t-pastv2,利用分光光度计测定质粒的浓度,根据公式:dna拷贝数=质粒浓度(ng/μl)
×
10-9
/(660
×
标准质粒碱基数)计算质粒的拷贝数,标准质粒碱基数为2899。重组质粒以10倍稀释后作为标准品,-20℃保存备用。
[0039]
1.7标准曲线的建立
[0040]
在不同退火温度下(52℃、55℃、58℃、60℃、62℃和65℃)进行pcr反应,以确定引物的最适退火温度,采用矩阵法对探针浓度(1.25μmol/l、2.5μmol/l、5.0μmol/l、10μmol/l)和引物浓度(1.25μmol/l、2.5μmol/l、5.0μmol/l、10μmol/l)进行优化,最终获得最适合的探针引物浓度配比,确定反应体系。将1.6中制备的标准品进行荧光定量pcr反应,以获得标准曲线和熔解曲线。
[0041]
1.8荧光定量pcr方法的特异性试验
[0042]
利用建立的taqman qpcr方法对本实验室保存的pev、prrsv、svv、csfv、jev及猪三联活疫苗(pedv、rv、tgev)阳性样本的cdna及prv阳性样本的dna模板进行扩增,以pastv2的重组质粒为阳性对照,设ddh2o为阴性对照,以验证该方法的特异性。
[0043]
实施例2试验结果
[0044]
2.1标准质粒的制备
[0045]
以提取的pastv2阳性样品的cdna为模板进行pcr扩增,结果显示,目的条带为299bp(图1和seq id no.1),与预期相符。目的片段回收纯化后克隆至载体pmd18-t中,构建的重组质粒标准品,经pcr和测序鉴定,结果显示目的片段与预期插入片段相同,表明重组质粒标准品正确构建。
[0046]
2.2反应条件的优化
[0047]
优化后的荧光定量反应体系:2
×
primdirect probe rt-qpcr mix with ung 12.5μl,pastv2-f、pastv2-r各0.5μl,pastv2-probe 0.5μl,处理后样本2μl,灭菌水补齐至25μl。优化后的反应条件:90℃3min,56℃5min,为第一步循环;95℃5s,56℃30s,为第二步40个循环,所述第二步每个循环的延伸结束时进行荧光信号检测。
[0048]
2.3荧光标准曲线的建立
[0049]
测定的标准质粒后换算拷贝数为1.4
×
10
10
copies/μl,10倍稀释后,取1.4
×
102~1.4
×
107copies/μl的标准品质粒进行荧光定量pcr反应,获得标准曲线(图2),结果显示,标准曲线线性关系良好,相关系数r2为0.9932,可作为后续试验的参照。
[0050]
2.3熔解曲线分析
[0051]
熔解曲线(图3)显示,质粒标准品均出现了单峰,熔解温度在85℃
±
0.5℃,说明建立的pastv2 qpcr检测方法无非特异性扩增。
[0052]
2.4特异性试验
[0053]
利用建立的taqman qpcr方法对本实验室保存的pev、prrsv、svv、csfv、jev、猪3联活疫苗(pedv、rv、tgev)阳性样本的cdna及prv阳性样本的dna模板进行特异性检测。结果显示,除pastv2阳性对照扩增得到目的片段以外,其他病原的检测结果均为阴性,该方法与其他主要猪病病原无交叉反应,表明该方法具有良好的特异性(图4)。
[0054]
上述说明并非对发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



