CvHSF30-2基因及编码的蛋白提高植物或细胞高温耐性的应用的制作方法
 2021-02-01 23:02:10|
2021-02-01 23:02:10| 276|
276| 起点商标网
起点商标网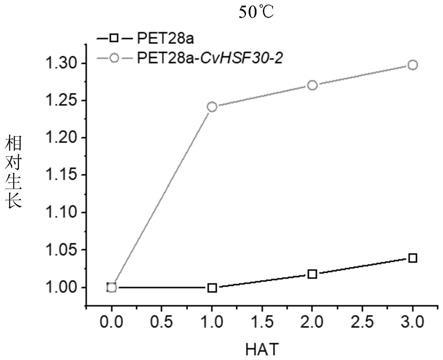
cvhsf30-2基因及编码的蛋白提高植物或细胞高温耐性的应用
技术领域
[0001]
本发明属于分子生物学、基因工程技术领域,具体涉及一种提高植物高温耐性的基因及其应用。
背景技术:
[0002]
由于“温室效应”现象日益明显,全球气温持续升高,夏季高温已成为制约植物生长和发育的主要环境因子,植物生长发育面临高温逆境的严峻挑战。热激转录因子(heat shock transcription factor,hsf)是植物一类重要转录因子,通过和热激反应相关基因启动子顺式作用元件结合,精确调控下游基因时空表达,调节植物热激应答。热激转录因子(heat shock factor,hsf)是真核生物中较早被发现的一种转录因子,在细菌、藻类、动物、植物中普遍存在。与酵母、果蝇和动物等其他真核生物相比(酵母,线虫,果蝇中1个,脊椎动物中4个),植物基因组中具有更多编码 hsf的基因,许多植物物种中hsf家族成员的数目超过20个(拟南芥中21个),这可能是由于植物进化过程中的基因复制和功能分化导致的。
[0003]
hsf受热诱导是植物的一个特性,这种特征在酵母和动物中并未被发现。拟南芥中class a1的成员(hsfa1a/hsfa1b/hsfa1 d/hsfa1e)在激活热诱导基因(包括hsfa2)的转录中起主要作用,当植物受到热激时,它们能触发由许多转录因子组成的转录级联反应。在番茄中,hsfa1是植物耐热性的主要调控因子。hsfa1控制热应激的保护途径。在小麦中,tahsfa6f和tahsfc2a也可保护植物免受热应激的影响。
[0004]
随着生活水平的提高,园林观赏植物越来越受到人们关注,研究观赏植物对温度逆境抗性的遗传机制有广泛的应用前景。因此,本领域技术人员致力于寻找提高植物高温耐性的基因及其应用。
技术实现要素:
[0005]
有鉴于现有技术中的缺陷,本发明提供了一种提高植物或细胞高温耐性的基因及其应用。
[0006]
本发明的第一个方面提供了一种提高植物或细胞高温耐性的基因,在一个具体实施方式中,其核苷酸序列选自如下序列:
[0007]
1)seq id no.1或seq id no.5所示的核苷酸序列;
[0008]
2)seq id no.1或seq id no.5所示的核苷酸序列通过一个或几个核苷酸的取代、缺失、或添加衍生产生的核苷酸序列;
[0009]
3)与seq id no.1或seq id no.5具有至少80%同源性的核苷酸序列。
[0010]
本发明的第二个方面提供了一种氨基酸序列,其能提高植物或细胞高温耐性,在一个具体实施方式中,该氨基酸序列,选自如下序列:
[0011]
1)seq id no.2所示的氨基酸序列;
[0012]
2)seq id no.2所示的氨基酸序列通过一个或几个氨基酸的取代、缺失、或添加衍
生产生的氨基酸序列;
[0013]
3)与seq id no.2具有至少80%同源性的氨基酸序列。
[0014]
本发明的第三个方面提供了如上所述的核苷酸序列或如上所述的氨基酸序列在提高植物或细胞高温耐性中的应用。
[0015]
进一步地,细胞为原核细胞或真核细胞。
[0016]
进一步地,原核细胞包括大肠杆菌;真核细胞包括酵母。
[0017]
本发明的第四个方面提供了一种提高植物高温耐性的方法,包括向目标植物中导入如上所述的核苷酸序列。
[0018]
进一步地,将如上所述的核苷酸序列连接到植物表达载体上,然后将重组植物表达载体转入目标植物中,通过筛选获得高温耐性的植物。
[0019]
本发明的第五个方面提供了一种提高细胞高温耐性的方法,包括向目标细胞中导入如上所述的核苷酸序列。
[0020]
进一步地,将如上所述的核苷酸序列连接到表达载体上,然后将重组表达载体转入目标细胞中,通过筛选获得高温耐性的细胞。
[0021]
进一步地,细胞包括大肠杆菌和酵母。
[0022]
本发明提供的从铁线莲中克隆的热激转录因子cvhsf30-2(铁线莲热激蛋白,clematis florida thunb.heat shock protein,cvhsf30-2),转入大肠杆菌、酵母后提高转基因菌株对高温胁迫耐性,表明该热激转录因子可以提高原核生物、低等真核生物的温度抗性。同时在本氏烟草trv-nbhsf30-2中vigs后影响本氏烟草对温度的耐受性,也表明上述热激转录因子及其同源序列的确能影响植物的高温耐受性。
附图说明
[0023]
图1是本发明实施例2中转入cvhsf30-2的大肠杆菌以及空载对照的37℃生长曲线。
[0024]
图2是本发明实施例2中转入cvhsf30-2的大肠杆菌以及空载对照50℃热处理生长曲线。
[0025]
图3是本发明实施例2中转入cvhsf30-2的大肠杆菌以及空载对照37℃和 50℃菌落生长情况。
[0026]
图4是本发明实施例3中转入cvhsf30-2的酵母ah109以及空白对照的28℃生长曲线。
[0027]
图5是本发明实施例3中转入cvhsf30-2的酵母ah109以及空白对照的37℃和42℃热处理生长曲线。其中,图5a是37℃培养的生长曲线,图5b是42℃培养的生长曲线。
[0028]
图6是本发明实施例3中转入cvhsf30-2的酵母ah109以及空白对照的37℃和42℃热处理菌落生长情况。
[0029]
图7是本发明实施例4中转trv:nbhsf30-2烟草的qpcr结果。
[0030]
图8是本发明实施例4中转trv:nbhsf30-2烟草的热处理表型。
[0031]
图9是本发明实施例4中转trv:nbhsf30-2烟草的热处理表型明显的烟草叶片的nbt和dab染色结果。
具体实施方式
[0032]
以下将结合实施例对本发明作进一步地说明,应理解这些实施例仅作为例证的目的,不用于限制本发明的保护范围。
[0033]
下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如 sambrook等分子克隆:实验室手册(new york:cold spring harbor laboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。所采用的试剂,若无特殊说明,均为市售或公开渠道可以获得的试剂。
[0034]
在本发明中,可选用本领域已知的各种载体,如市售的载体,包括质粒等。
[0035]
铁线莲具有耐热品种和不耐热品种,通过研究发现,铁线莲中的cfhsf30-2 基因为热激诱导表达,但在高温胁迫条件下,cfhsf30-2只在耐热铁线莲品种中强表达,而在不耐热品种中弱表达甚至不表达,该基因的表达与否与铁线莲品种的田间耐热性差异观察结果相吻合。
[0036]
实施例1铁线莲cvhsf30-2基因的克隆
[0037]
提取热激处理后的葡萄叶铁线莲嫩叶总rna,提取试剂盒为rnaplant(市售),利用反转录试剂盒(市售)将总rna反转录成cdna。根据转录组测序结果设计引物,引物序列如seq id no.3和seq id no.4所示,采用rt-pcr 方法从葡萄叶铁线莲cdna中扩增出一条927bp的条带。pcr产物回收,获取 cvhsf30-2基因,其核苷酸序列如seq id no.1所示,该核苷酸序列编码的氨基酸序列如seq id no.2所示,由308个氨基酸残基组成,分子量为35.21千道尔顿。
[0038]
实施例2葡萄叶铁线莲cvhsf30-2原核表达提高大肠杆菌耐热性
[0039]
(1)将cvhsf30-2基因的开放阅读框可操作地连接于原核表达载体 (pet-28a),形成含有该基因的原核表达载体pet-28a-cvhsf30-2。
[0040]
(2)将pet-28a-cvhsf30-2表达载体转入原核生物大肠杆菌dh5α,从获得的阳性克隆中提取质粒pet-28a-cvhsf30-2。
[0041]
(3)将质粒pet-28a-cvhsf30-2转化到大肠杆菌bl(de3)中进行表达,即将含有质粒pet-28a-cvhsf30-2的bl(de3)在液体lb(kan+,终浓度为 100mg/l)振荡培养过夜(37℃,220rpm),将菌液的od
600
值调成od
600
=1,将菌液按照1:100接种到lb(kan+)液体培养基中,进行37℃摇菌,每1h 取菌液测量od值,培养10h,绘制生长曲线。以转入空载pet-28a载体的bl21 (de3)为对照,查看引入cvhsf30-2后是否会影响大肠杆菌的正常生长。如图1所示,引入cvhsf30-2不影响原核生物bl(de3)的正常生长,其生长趋势与转入空载的生长趋势一致。
[0042]
(4)取上述调节od
600
为1菌液,按照1:100的比例接种菌液(lb,kan+), 20ml接种200ul,将菌液置于50℃高温摇菌,每小时取菌测量od值,培养3h。以转入空载pet-28a载体的bl21(de3)为对照,查看在50℃高温胁迫下,转cvhsf30-2菌株的生长情况。
[0043]
(5)取上述调节od
600
为1菌液,在lb平板(kan+)上进行z字划线,分别在37℃和50℃下过夜培养。以转入空载pet-28a载体的bl21(de3)为对照,观察引入cvhsf30-2后的大肠杆菌在50℃高温胁迫下的生长情况。
[0044]
如图2和图3所示,无论是在液体培养基或是在固体培养基中培养,转 cvhsf30-2菌株生长曲线与菌落生长情况均显示cvhsf30-2能明显提高原核生物bl(de3)的耐热性。
[0045]
实施例3铁线莲cvhsf30-2真核表达提高酵母耐热性
[0046]
将cvhsf30-2基因的开放阅读框可操作地连接于真核表达载体,形成含有该基因的真核表达载体,将表达载体转入真核生物酵母ah109,如图4所示, cvhsf30-2不影响酵母ah109的正常生长:通过高温处理,如图5a、图5b和图6所示,与对照相比,转cvhsf30-2菌株在37℃和42℃的菌液生长与菌落生长情况显示,cvhsf30-2能明显提高真核酵母ah109的耐热性。
[0047]
(1)将cvhsf30-2基因的开放阅读框可操作地连接于真核表达载体(bd),形成含有该基因的原核表达载体bd-cvhsf30-2。
[0048]
(2)将步骤(1)中的载体转入酵母(ah109),将含表达载体的酵母在液体sd/-trp(终浓度为100mg/l)振荡培养(28℃,220rpm)。
[0049]
(3)取步骤(2)中培养的酵母菌液,调节至od
600
值为0.05,并振荡培养(28℃,220rpm),每两小时测量菌液od
600
值,总共32h,绘制酵母生长曲线。以转入空载bd载体的ah109为对照,查看引入cvhsf30-2后是否会影响酵母的正常生长。如图4所示,引入cvhsf30-2不影响真核生物酵母 (ah109)的正常生长,其生长趋势与转入空载的生长趋势一致。
[0050]
(4)取步骤(2)中培养的酵母菌液,调节至od
600
值为0.05,置于37℃和42℃摇床,220rpm分别培养0、6、12、18、24小时,分别测量其od
600
值,绘制生长曲线。以转入空载bd载体的ah109为对照,查看在42℃高温胁迫下,转cvhsf30-2菌株的生长情况。
[0051]
(5)取步骤(2)中培养的酵母菌液,调节至od
600
值为1,点板,同时稀释不同倍数进行点板,然后进行37℃,42℃生长过夜。以转入空载bd载体的ah109为对照,查看在42℃高温胁迫下,转cvhsf30-2菌株的生长情况。
[0052]
如图5a、图5b和图6所示,无论是在液体培养基或是在固体培养基中培养,转cvhsf30-2的酵母菌株生长曲线与菌落生长情况均显示cvhsf30-2能明显提高真核酵母ah109的耐热性。
[0053]
实施例4 vigs下调烟草nbhsf30-2同源基因使烟草耐热性降低
[0054]
(1)选取本氏烟草中与铁线莲cvhsf30-2基因同源性最高的序列, nbhsf30-2(如seq id no.5所示),以此为模板,设计vigs引物,并将该序列中的一部分序列(如seq id no.6所示)连接到trv2病毒载体上,形成重组载体。
[0055]
(2)重组载体转根瘤农杆菌gv3101,同时将病毒trv1载体也转化到根瘤农杆菌gv3101中,培养获得两种gv3101菌液,然后共同注射本氏烟草,通过病毒诱导基因沉默(virus induced gene silence,vigs)方式沉默烟草 nbhsf30-2基因。
[0056]
(3)注射2周后,进行qpcr验证烟草nbhsf30-2的下调。
[0057]
(4)对qpcr验证为nbhsf30-2的下调的烟草进行42℃热处理(在42℃光照培养箱热处理1h),查看表型,以进一步验证cvhsf30-2的耐热功能。
[0058]
(5)热处理后,trv2-hsf30-2出现了明显的失水与萎蔫,而对照 trv2-gfp的表型与处理前没有明显差异。对trv2-hsf30-2和trv2-gfp烟草叶片,进行氮蓝四唑(nbt)染色法测定超氧物歧化酶(sod)活力,以及二氨基联苯胺染色法(dab)检测细胞中过氧化物酶(pod)活性。
[0059]
上述步骤(2)、(3)、(4)、(5)均以trv2-gfp作平行对照。
[0060]
如图7所示,通过vigs顺利的降低了烟草中的nbhsf30-2基因。如图8 所示,pds为八氢番茄红素脱氢酶基因,在此次实验中,trv-pds基因沉默后显示白色,表明基因沉默效果良好。在进行42℃热处理后,与trv2-gfp相比, vigs下调烟草nbhsf30-2同源基因的烟草植株表现出叶片低垂、萎缩的现象,表明下调烟草nbhsf30-2使烟草耐热性降低。如图9所示,vigs下调烟草 nbhsf30-2后,烟草的sod与kod水平均升高,即活性氧水平明显升高,其受热胁迫损伤较大,使烟草耐热性降低。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



