MST1基因在检测和/或调控心肌细胞过度凋亡中的应用的制作方法
 2021-02-01 23:02:44|
2021-02-01 23:02:44| 445|
445| 起点商标网
起点商标网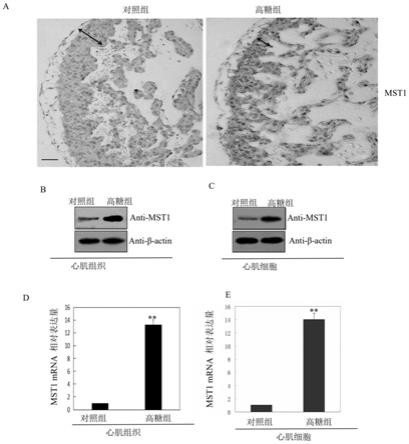
mst1基因在检测和/或调控心肌细胞过度凋亡中的应用
技术领域
[0001]
本发明属于分子生物学领域,特别涉及mst1基因在检测和/或调控心肌细胞过度凋亡中的应用,尤其是高糖环境导致的心肌细胞过度凋亡中的应用。
背景技术:
[0002]
先天性心脏病(congenital heart disease,chd)是指由于胎儿时期心脏、血管发育障碍所导致的形态、结构和功能异常的一组先天畸形。先天性心脏病是婴儿死亡的主要原因之一。在亚洲,每1000名活产婴儿中有9.3名患有chd。
[0003]
chd的确切病因依然不明。多年来研究已经证实,chd是一种多基因遗传病,主要是由胚胎期遗传因素和环境因素共同作用导致心脏血管引起的典型复杂性状疾病,其遗传度为55%~65%。因此从遗传分子水平研究chd的发病机制是了解引起人类chd复杂原因的最重要途径之一。发现chd的致病/易患基因并深入研究其功能与作用机制,成为当前和今后相当长时间内备受关注的多基因疾病研究热点课题。
[0004]
心脏的发育受遗传和环境的影响,其影响因素包括生化、血糖,血压、辐射、温度、氧气的改变以及致畸剂等。研究发现高血糖患者在妊娠最初三个月内,其血糖水平越高,发生胎儿畸形的几率越大。高血糖孕妇其胎儿患心血管畸形的几率是正常妊娠的五倍。
[0005]
有学者提出心肌细胞过度凋亡可能是妊娠期高血糖致胎儿心脏结构功能改变的原因之一。虽然心肌细胞的过度凋亡与先天性心脏病之间并不是绝对的对应关系,也就是说心肌细胞的过度凋亡可能导致胚胎心脏发育异常,但并不必然导致先天性心脏病的发生;但是,了解胚胎心肌细胞过度凋亡的情况可以为先天性心脏病的诊断提供很高的参考价值。目前,高糖通过怎样的分子机制引起心肌细胞过度凋亡仍不是非常明确,现有技术中也没有一种可用于间接测定心肌细胞过度凋亡的标志物或方法。
[0006]
哺乳动物不育系20相关激酶((mammalian sterile 20-like kinase,mst)是哺乳动物系统中体内普遍泛素化表达的一种丝氨酸/苏氨酸蛋白激酶,主要包括mst1、mst2、mst3和mst4四个成员。其中,mst1激酶与细胞增殖、生长、凋亡和器官大小等多种生物学功能有关。然而,关于mst1的表达及其在母亲孕期高血糖引起的胎儿心脏异常发生和心肌细胞凋亡中的作用知之甚少。
[0007]
yes相关蛋白1(yap1)是hippo通路的核心蛋白,在细胞生长、增殖和凋亡中起着重要作用。yap1蛋白ser127磷酸化导致yap1在细胞质中的滞留,细胞质yap1可经历进一步磷酸化和泛素化依赖的降解,yap1蛋白ser397磷酸化也可以介导yap1的泛素化。据报道,yap1蛋白ser127和ser397残基受lats1/2磷酸化调控。但是对于高糖环境下yap1磷酸化水平的改变情况,及其在高糖环境下诱导心肌细胞凋亡中的作用未见报道。
[0008]
survivin是凋亡抑制蛋白(iap)家族的代表性成员,在许多肿瘤类型中高度表达。据报道,血液中survivin的异常表达水平已被研究认为几种肿瘤发生的潜在生物标志物。虽然survivin在肿瘤中已经得到了很好的研究,但它在高糖环境下与心肌细胞凋亡的关系也没有任何的报道。
技术实现要素:
[0009]
为了解决现有技术中存在的上述问题,本发明提供了mst1基因在检测和/或调控心肌细胞过度凋亡中的应用,尤其是高糖环境导致的心肌细胞过度凋亡中的应用。
[0010]
本发明的第一个方面提供了一种用于检测心肌细胞过度凋亡的制剂,所述制剂中包括用于检测mst1基因的mrna表达量和/或蛋白质表达量的组分。
[0011]
本发明的第二个方面提供了一种用于检测心肌细胞过度凋亡的方法,所述方法包括检测心肌细胞中mst1基因表达的操作。
[0012]
本发明的第三个方面提供了mst1基因表达质粒在制备用于提高高糖环境下心肌细胞凋亡率的制剂中的应用。
[0013]
本发明的第四个方面提供了mst1基因的sirna干涉质粒在制备用于降低高糖环境下心肌细胞凋亡率的制剂中的应用。
[0014]
本发明的第五个方面提供了一种调控心肌细胞凋亡率的方法,所述方法包括降低心肌细胞凋亡率和提高心肌细胞凋亡率;
[0015]
当需要提高心肌细胞凋亡率时,所述方法包括将mst1基因表达质粒转入心肌细胞中的操作;
[0016]
当需要降低心肌细胞凋亡率时,所述方法包括将mst1基因的sirna干涉质粒转入心肌细胞中的操作。
[0017]
本发明利用mst1基因与心肌细胞过度凋亡,尤其是高糖环境下的心肌细胞过度凋亡之间的关系,提供了一种用于检测心肌细胞过度凋亡的制剂,该制剂可以高效准确地检测高糖环境下心肌细胞的凋亡情况,从而为体外培养的心肌细胞或者母体内胎儿发育时的心肌组织的发育作出是否过度凋亡的准确判断。本发明同时还综合利用了yap1基因与mst1基因的表达之间的关系,为心肌细胞的过度凋亡的判断作出更加准确的判断。
附图说明
[0018]
图1为胎鼠心肌组织/心肌细胞中mst1表达情况比较图。其中,
[0019]
图1-a示出了免疫组化检测胎鼠心肌组织中mst1蛋白的表达情况。其中,左侧的图为对照组胎鼠胚胎心肌组织的结果,右侧图为高糖组胎鼠胚胎心肌组织的结果;图中双箭头代表心室壁的厚度,左侧的图中左下角的黑色横线比例尺代表50μm。
[0020]
图1-b示出了提取对照组胎鼠心肌组织蛋白,通过western blot检测mst1蛋白表达情况。其中,图中左侧的条带为对照组胎鼠胚胎心肌组织的结果,右侧的条带为高糖组胎鼠胚胎心肌组织的结果。
[0021]
图1-c示出了提取对照组和高糖组h9c2细胞蛋白,通过western blot检测mst1蛋白表达情况。其中,图中左侧条带为对照组h9c2细胞的结果,右侧条带为高糖组h9c2细胞的结果。
[0022]
图1-d示出了提取胎鼠心肌组织rna,通过qrt-pcr检测mst1 mrna表达情况。其中,图中左侧柱状图为对照组胎鼠胚胎心肌组织mst1 mrna表达的结果,右侧的柱状图为高糖组胎鼠胚胎心肌组织mst1 mrna表达的结果。
[0023]
图1-e示出了提取h9c2细胞rna,通过qrt-pcr检测mst1 mrna表达情况。其中,图中左侧柱状图为对照组h9c2细胞中mst1 mrna表达的结果,右侧柱状图为高糖组h9c2细胞中
mst1 mrna表达的结果。
[0024]
图2为mst1异常表达与心肌细胞凋亡的相关性之间的结果图。其中,
[0025]
图2-a示出了向对照组h9c2细胞中转入mst1 sirna,通过western blot检测mst1蛋白质的表达情况。其中,左侧的条带为转入了对照sirna的结果,右侧的条带为转入mst1 sirna的结果。
[0026]
图2-b和2-c示出了向h9c2细胞中转入mst1 sirna后,通过hoechst33342染色分析细胞凋亡情况。其中,左侧的图/条带示出了向对照组h9c2细胞中转入对照sirna的结果,中间的图/条带示出了向高糖组h9c2细胞中转入对照sirna的结果,右侧的图/条带示出了向高糖组h9c2细胞中转入mst1 sirna的结果。
[0027]
图2-d示出了向对照组h9c2细胞中转入mst1表达质粒后,通过western blot检测mst1蛋白质的表达情况。其中,左侧的条带为转入了空白质粒的结果,右侧的条带为转入了mst1表达质粒的结果。
[0028]
图2-e和2-f示出了向对照组h9c2细胞中转入mst1表达质粒后,通过hoechst33342染色分析细胞凋亡情况。其中,左侧的图/条带为转入了空白质粒的结果,右侧的图/条带为转入mst1表达质粒的结果。
[0029]
图3为yap1作为mst1下游效应基因参与调节mst1诱导的心肌细胞凋亡的相关结果图。其中,
[0030]
图3-a示出了通过免疫组化检测yap1蛋白的表达情况。其中,左侧的图为对照组胎鼠心肌组织免疫组化结果,右侧的图为高糖组胎鼠心肌组织免疫组化结果;左侧图中左下角的黑色横线比例尺代表50μm。
[0031]
图3-b示出了提取胎鼠心肌组织蛋白,通过western blot检测yap1蛋白表达情况。其中,左侧的图为对照组胎鼠心肌组织yap1蛋白表达情况,右侧的图为高糖组胎鼠心肌组织yap1蛋白表达情况。
[0032]
图3-c示出了western blot检测培养的h9c2细胞中yap1蛋白表达情况。其中,左侧的图为对照组的h9c2细胞中的yap1蛋白表达情况,右侧的图为高糖组的h9c2细胞中的yap1蛋白表达情况。
[0033]
图3-d示出了提取胎鼠心肌组织rna,通过qrt-pcr检测yap1 mrna表达情况。其中,图中左侧柱状图为对照组胎鼠胚胎心肌组织yap1 mrna表达结果,右侧的柱状图为高糖组胎鼠胚胎心肌组织yap1 mrna表达结果。
[0034]
图3-e示出了提取h9c2细胞rna,通过qrt-pcr检测yap1 mrna表达情况。其中,左侧的柱状图为对照组h9c2细胞中的yap1 mrna表达情况,右侧的柱状图为高糖组h9c2细胞中的yap1 mrna表达情况。
[0035]
图3-f示出了向培养的h9c2细胞中分别转入对照sirna和mst1sirna后,western blot检测yap1蛋白表达情况。其中,左侧的条带为向对照组h9c2细胞中转入对照sirna(control sirna)的结果,中间的条带为向高糖组h9c2细胞中转入对照sirna的结果,右侧的条带为向高糖组h9c2细胞中转入mst1 sirna的结果。
[0036]
图3-g示出了向培养的对照组h9c2细胞中转入mst1表达质粒后,western blot检测yap1蛋白表达情况。其中,左侧的条带为转入空白质粒后yap1蛋白表达的结果,右侧的条带为转入mst1表达质粒后yap1蛋白表达的结果。
[0037]
图3-h示出了向培养的对照组h9c2细胞中转入yap1表达质粒后,western blot检测yap1蛋白表达情况。其中,左侧的条带为转入空白质粒的结果,右侧的条带为转入yap1表达质粒的结果。
[0038]
图3-i示出了细胞凋亡分析yap1过表达对心肌细胞凋亡的影响。其中,左侧的条带为向对照组h9c2细胞中转入空白质粒的结果,中间的条带为向对照组h9c2细胞中共同转入mst1表达质粒和空白质粒的结果,右侧的条带为向对照组h9c2细胞中共同转入mst1和yap1表达质粒的结果。
[0039]
图4为yap1作为mst1下游效应基因参与调节mst1诱导的心肌细胞凋亡的相关结果图。其中,
[0040]
图4-a示出了在对照组h9c2细胞中转入mst1表达质粒,通过western blot检测yap1蛋白的表达情况和其磷酸化水平变化情况。其中,左侧的条带为转入空白质粒的结果,右侧的条带为转入mst1表达质粒的结果。
[0041]
图4-b示出了在对照组h9c2细胞中转入mst1表达质粒,通过western blot检测last1/2蛋白的表达情况和其磷酸化水平变化。其中,左侧的条带为转入空白质粒的结果,右侧的条带为转入mst1表达质粒的结果。
[0042]
图4-c示出了在h9c2细胞中转入mst1 sirna干涉质粒,通过western blot检测last1/2蛋白表达情况和其磷酸化水平变化。其中,左侧的条带为向对照组h9c2细胞中转入对照sirna质粒的结果,中间的条带为向高糖组h9c2细胞中转入对照sirna质粒的结果,右侧的条带为向高糖组h9c2细胞中转入mst1 sirna干涉质粒的结果。
[0043]
图4-d示出了提取胎鼠心肌组织蛋白,western blot检测对照组和高糖组last1/2蛋白表达情况和其磷酸化水平变化。其中,左侧的条带为对照组胎鼠心肌组织的结果,右侧的条带为高糖组胎鼠心肌组织的结果。
[0044]
图5为yap1调节survivin表达抑制心肌细胞凋亡的相关结果图。其中,
[0045]
图5-a示出了分别提取对照组和高糖组胎鼠心肌组织的全蛋白,通过western blot定量分析survivin和cyclind蛋白表达情况。其中,左侧的条带为对照组胎鼠心肌组织的结果,右侧的条带为高糖组胎鼠心肌组织的结果。
[0046]
图5-b示出了分别提取对照组和高糖组h9c2细胞的全蛋白,通过western blot定量分析survivin和cyclind蛋白表达情况。其中,左侧的条带为对照组h9c2细胞的结果,右侧的条带为高糖组h9c2细胞的结果。
[0047]
图5-c示出了向对照组h9c2细胞中转入yap1表达质粒,通过western blo检测survivin蛋白的表达情况。其中,左侧的条带为未转入yap1表达质粒的结果,右侧的条带为转入yap1表达质粒的结果。
[0048]
图5-d示出了分别提取对照组和高糖组h9c2细胞的全蛋白,通过western blot检测survivin蛋白表达情况。其中,左侧的条带为对照组h9c2细胞转入空白质粒的结果,中间的条带为高糖组h9c2细胞转入空白质粒的结果,右侧的条带为高糖组h9c2细胞转入yap1表达质粒后的结果。
[0049]
图5-e示出了向高糖组h9c2细胞的培养液中加入survivin抑制剂ym-155后,统计心肌细胞凋亡比率。其中,按照从左往右的顺序,第一个柱状条带为对照组h9c2细胞转入空白质粒的结果(未加入ym-155),第二个柱状条带为高糖组h9c2细胞转入空白质粒的结果
(未加入ym-155),第三个柱状条带为高糖组h9c2细胞转入了yap1表达质粒后的结果(未加入ym-155),第四个柱状条带为高糖组h9c2细胞转入了yap1表达质粒、且加入了ym-155的结果。
具体实施方式
[0050]
为使本发明的技术方案、目的和优点更加清楚,下面通过具体的实施例子对本发明做进一步的详细描述。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
[0051]
本发明中,除非特别说明,术语“高糖环境”是指:在体外培养的心肌细胞中,培养液中的葡萄糖浓度为33mm(mm即mmol/l)的培养液环境;或者是指在胚胎时,母体血糖浓度至少为16.7mm的血糖环境。术语“心肌细胞过度凋亡”是指:在体外培养的心肌细胞中,与培养液中的葡萄糖浓度为5.3-5.5mm的正常培养液环境相比,凋亡的心肌细胞所占的比例介于15%-30%之间;或者在胚胎中,与母体血糖浓度为正常值(3.1-5.6mm)的血糖环境相比,凋亡的心肌细胞所占的比例介于15%-35%之间。
[0052]
本发明的第一个方面提供了一种用于检测心肌细胞过度凋亡的制剂,所述制剂中包括用于检测mst1基因的mrna表达量和/或蛋白质表达量的组分。
[0053]
根据本发明的第一个方面,所述制剂尤其适用于检测高糖环境导致的心肌细胞过度凋亡。
[0054]
根据本发明的第一个方面,所述用于检测mst1基因的mrna表达量的组分可以包括用于从心肌细胞中提取总rna的组分;用于将rna反转录成cdna的组分;以及用于以cdna为模板,使用下述mst1基因扩增引物,采用qrt-pcr对mst1基因的mrna表达量进行定量测定的组分:
[0055]
正向引物(序列表中的序列1):
[0056]5′-
catggctcaggtgaacagtat-3
′
;
[0057]
反向引物(序列表中的序列2):
[0058]5′-
ggtctctgggtccaaagtataac-3
′
。
[0059]
其中,所述用于从心肌细胞中提取总rna的组分;用于将rna反转录成cdna的组分;以及用于以cdna为模板,使用上述mst1基因扩增引物,采用qrt-pcr对mst1基因的mrna表达量进行定量测定的组分均为本领域常用的试剂成分,均可以从各种商业渠道获得,本发明中不再赘述。
[0060]
根据本发明的第一个方面,所述用于检测mst1基因的蛋白质表达量的组分可以包括用于从心肌细胞中提取蛋白质的组分,以及用于将提取的蛋白质进行western blot操作以测定mst1蛋白质的组分。
[0061]
其中,所述用于从心肌细胞中提取蛋白质的组分,以及用于将提取的蛋白质进行western blot操作以测定mst1蛋白质的组分均为本领域常用的试剂成分,均可以从各种商业渠道获得,本发明中不再赘述。
[0062]
根据本发明的第一个方面,所述制剂中还包括用于检测yap1基因的蛋白质表达量的组分。
[0063]
其中,所述用于检测yap1基因的蛋白质表达量的组分可以包括用于从心肌细胞中
提取蛋白质的组分,以及用于将提取的蛋白质进行western blot操作以鉴定yap1蛋白质的组分。其中,所述用于从心肌细胞中提取蛋白质的组分,以及用于将提取的蛋白质进行western blot操作以鉴定yap1蛋白质的组分均为本领域常用的试剂成分,均可以从各种商业渠道获得,本发明中不再赘述。
[0064]
根据本发明的第一个方面,所述制剂中还包括用于检测last1/2磷酸化水平的组分。
[0065]
其中,所述用于检测last1/2磷酸化水平的组分可以为本领域中任何用于检测last1/2磷酸化水平的试剂组分,均可以从各种商业渠道获得,本发明中不再赘述。
[0066]
根据本发明的第一个方面,所述制剂中还包括用于检测抗凋亡蛋白survivin含量的组分。
[0067]
其中,所述用于检测抗凋亡蛋白survivin含量的组分可以包括用于从心肌细胞中提取蛋白质的组分,以及用于将提取的蛋白质进行western blot操作以鉴定抗凋亡蛋白survivin含量的组分。其中,所述用于从心肌细胞中提取蛋白质的组分,以及用于将提取的蛋白质进行western blot操作以鉴定yap1蛋白质的组分均为本领域常用的试剂成分,均可以从各种商业渠道获得,本发明中不再赘述。
[0068]
本发明的第二个方面提供了一种用于检测心肌细胞过度凋亡的方法,所述方法包括检测心肌细胞中mst1基因表达的操作。
[0069]
根据本发明的第二个方面,所述方法尤其适用于检测高糖环境导致的心肌细胞过度凋亡。
[0070]
根据本发明的第二个方面,所述检测心肌细胞中mst1基因表达的操作包括检测心肌细胞中mst1基因的mrna表达量的操作;并按照下述标准判断心肌细胞是否过度凋亡:
[0071]
在体外培养的心肌细胞中,与培养液中的葡萄糖浓度为5.3-5.5mm的正常培养液环境中培养的心肌细胞相比,mst1基因的mrna表达量升高至少10倍,例如10-15倍,优选12.5倍时,心肌细胞过度凋亡;或者,
[0072]
在胚胎中,与母体血糖浓度为正常值(3.1-5.6mm)的血糖环境相比,mst1基因的mrna表达量升高至少10倍,例如10-15倍,优选12.5倍时,心肌细胞过度凋亡。
[0073]
根据本发明的第二个方面,所述检测心肌细胞中mst1基因的mrna表达量的操作可以为本领域中常规的用于检测mrna表达量的操作方式。
[0074]
在一种优选的具体实施方式中,所述检测心肌细胞中mst1基因的mrna表达量的操作可以包括:首先提取心肌细胞中的总rna,然后将总rna反转录成cdna,并以获得的cdna为模板,使用下述mst1基因扩增引物,采用qrt-pcr进行定量测定:
[0075]
正向引物(序列表中的序列1):
[0076]5′-
catggctcaggtgaacagtat-3
′
;
[0077]
反向引物(序列表中的序列2):
[0078]5′-
ggtctctgggtccaaagtataac-3
′
。
[0079]
根据本发明的第二个方面,所述检测心肌细胞中mst1基因表达的操作包括检测心肌细胞中mst1基因的蛋白质表达量的操作;并按照下述标准判断心肌细胞是否过度凋亡:
[0080]
在体外培养的心肌细胞中,与培养液中的葡萄糖浓度为5.3-5.5mm的正常培养液环境中培养的心肌细胞相比,mst1基因的蛋白质表达量升高至少6.5倍,例如6.5-10.5倍,
优选9倍时,心肌细胞过度凋亡;或者,
[0081]
在胚胎中,与母体血糖浓度为正常值(3.1-5.6mm)的血糖环境相比,mst1基因的蛋白质表达量升高至少6倍,例如6-10倍,优选9倍时,心肌细胞过度凋亡。
[0082]
根据本发明的第二个方面,所述检测心肌细胞中mst1基因的蛋白质表达量的操作可以为本领域中常规的用于检测蛋白质表达量的操作方式,例如可以为采用western blot的操作方式。
[0083]
根据本发明的第二个方面,所述方法还包括检测last1/2磷酸化水平的操作。
[0084]
其中,所述检测last1/2磷酸化水平的操作可以为本领域中任何用于检测last1/2磷酸化水平的操作方式,包括但不限于激酶活性分析法、western blot法、酶联免疫吸附分析(elisa)法、细胞内流式细胞术和免疫细胞化学/免疫组织化学(icc/ihc)法、质谱法等;并按照下述标准判断心肌细胞是否过度凋亡:
[0085]
在体外培养的心肌细胞中,与培养液中的葡萄糖浓度为5.3-5.5mm的正常培养液环境中培养的心肌细胞相比,last1/2磷酸化水平升高至少7倍,例如7-10倍,优选9倍时,心肌细胞过度凋亡。
[0086]
在胚胎中,与母体血糖浓度为3.1-5.6mm的血糖环境相比,last1/2磷酸化水平升高至少7倍,例如7-10倍,优选9倍时,心肌细胞过度凋亡。
[0087]
根据本发明的第二个方面,所述方法还包括检测抗凋亡蛋白survivin含量的操作。
[0088]
其中,所述检测抗凋亡蛋白survivin含量的操作可以为本领域中常规的用于检测蛋白质表达量的操作方式,例如可以为采用western blot的操作方式;并按照下述标准判断心肌细胞是否过度凋亡:
[0089]
在体外培养的心肌细胞中,与培养液中的葡萄糖浓度为5.3-5.5mm的正常培养液环境中培养的心肌细胞相比,抗凋亡蛋白survivin含量降低至少50%,例如50%-70%,优选64%时,心肌细胞过度凋亡。
[0090]
在胚胎中,与母体血糖浓度为3.1-5.6mm的血糖环境相比,抗凋亡蛋白survivin含量降低至少50%,例如50%-70%,优选64%时,心肌细胞过度凋亡。
[0091]
本发明的第三个方面提供了mst1基因表达质粒在制备用于提高高糖环境下心肌细胞凋亡率的制剂中的应用。
[0092]
根据本发明的第三个方面,所述mst1基因表达质粒的载体可以为本领域常用的质粒载体,只要能用于将mst1基因顺利转入心肌细胞中并发挥其生物学活性即可,本发明对此并无限制。
[0093]
本发明的第四个方面提供了mst1基因的sirna干涉质粒在制备用于降低高糖环境下心肌细胞凋亡率的制剂中的应用。
[0094]
根据本发明的第四个方面,所述mst1基因的sirna干涉质粒的干涉序列为:
[0095]
sirna(序列表中的序列7):5
′-
gccgagccttccactacaata-3
′
。
[0096]
本发明的第五个方面提供了一种调控心肌细胞凋亡率的方法,所述方法包括降低心肌细胞凋亡率和提高心肌细胞凋亡率;当需要提高心肌细胞凋亡率时,所述方法包括将mst1基因表达质粒转入心肌细胞中的操作;当需要降低心肌细胞凋亡率时,所述方法包括将mst1基因的sirna干涉质粒转入心肌细胞中的操作。
[0097]
其中,所述mst1基因的sirna干涉质粒的干涉序列如上所述。
[0098]
根据本发明的第五个方面,所述方法尤其适用于调控高糖环境导致的心肌细胞过度凋亡。
[0099]
根据本发明的第五个方面,所述方法还包括:当需要提高心肌细胞凋亡率时,所述方法包括将yap1基因的sirna干涉质粒转入心肌细胞中的操作;当需要降低心肌细胞凋亡率时,所述方法包括将yap1表达质粒转入心肌细胞中的操作。
[0100]
下面以具体的实施例子对本发明进行详细说明。
[0101]
下述实施例中所使用的各种试剂、材料等,若无特别说明,均为可以从商业渠道获得的产品;下述实施例中所使用的各种测试、检测方法若无特别说明,均为本领域中的常规测试、检测方法,均可以从教科书、工具书或学术期刊中获得。
[0102]
下述实施例中,除非另作说明,所有浓度均为质量百分比浓度。
[0103]
实施例1
[0104]
按照如下操作方式建立高血糖妊娠大鼠模型(或称:高糖组):
[0105]
将雌性和雄性sd(sprague-dawley)大鼠(10-11周龄)在温度为22
±
2℃、湿度为55
±
5%、和12小时光照/12小时黑暗循环条件下,自由获取食物和水的方式在代谢笼中进行饲养。
[0106]
采用链脲佐菌素(stz)诱发大鼠糖尿病,以获得高糖组试验大鼠。具体操作如下:
[0107]
将雌性sd大鼠与雄性sd大鼠合笼饲养。如果第二天早上观察到了交配栓,见交配栓那一天被认为是怀孕的第0.5天。在见交配栓后,禁食12h,按照50mg/kg的标准对孕鼠腹腔注射stz。72小时后,尾尖取血,用血糖仪测定母鼠的血糖水平,血糖水平达到或大于16.7mm的孕鼠为高血糖妊娠模型组(简称:高糖组)。在怀孕第15.5天时,对孕鼠实施安乐死,剖宫产,取胎鼠胚胎心脏冻存,作为高糖组材料。
[0108]
对照组如下:
[0109]
除了将高糖组的stz更换成等量的枸橼酸缓冲液之外,其他操作同上述高糖组的建立。并且,72小时后,监测的血糖水平均位于4-6mm之间。在孕鼠怀孕第15.5天时,对孕鼠实施安乐死,剖宫产,取胎鼠胚胎心脏冻存,作为对照组材料。
[0110]
h9c2细胞培养按照如下操作方式进行:
[0111]
对照组细胞培养方式如下:
[0112]
将h9c2细胞在37℃、5%的co2培养箱中,用含有10%胎牛血清、100mg/ml青霉素和100mg/ml链霉素的心肌细胞培养基(购自美国gibco)中培养。
[0113]
高糖组细胞培养方式如下:
[0114]
除了在h9c2细胞培养液(此处的h9c2细胞培养液包括前述的心肌细胞培养基和添加的10%胎牛血清、100mg/ml青霉素和100mg/ml链霉素)中加入终浓度为33mm的葡萄糖外,其他均与上述对照组细胞培养方式相同。
[0115]
免疫印迹(western blot)的操作方式如下:
[0116]
取出冻存的胎鼠胚胎心脏或者培养的h9c2细胞,经裂解后,收集蛋白质,使用12%的十二烷基硫酸钠聚丙烯酰胺凝胶(sds-page)电泳。电泳完毕后,将蛋白质转移到聚偏氟乙烯(pvdf)膜上。将pvdf膜分别与以下抗体进行孵育:mst1抗体(美国abcam)、yap1抗体(abcam)、yap1(ser397)抗体(cell signaling)、yap1(ser127)抗体、(cell signaling)、
lats1/2抗体(mybiosource)、lats1/2(thr1079/1041)抗体(biorbyt)、survivin抗体(abcam)和β-actin(sigma-aldrich)抗体孵育过夜。然后加入相应的二抗孵育1小时后,使用supersignal west pico化学发光底物试剂盒(美国pierce biotechnology),进行曝光。
[0117]
免疫组化的操作方式如下:
[0118]
胎鼠心脏经石蜡包埋后,获得石蜡包埋切片,取切片,用二甲苯脱蜡,梯度醇溶液脱水。用水冲洗后,将切片在0.1m柠檬酸缓冲液(ph 6.1)中煮沸10分钟,然后冷却至室温。再将切片用磷酸盐缓冲液冲洗,置于0.3%的h2o2中以抑制内源性过氧化物酶活性。再次洗涤后,用正常血清培养切片1小时,然后分别用抗yap1和mst1抗体孵育过夜(购自abcam,uk)。洗涤后,用生物素化二级抗体孵育1小时,然后用抗生物素和生物素化过氧化物酶复合物培养。最后,切片在过氧化物酶底物(二氨基联苯胺四氯化)溶液中培养,直到达到所需的染色强度。切片用水冲洗、脱水,然后封片用于观察。
[0119]
基因表达质粒构建和转染操作方式如下:
[0120]
从polepolar公司构建mst1表达质粒和yap1表达质粒。
[0121]
利用转染试剂lipofectamine 3000,参照使用说明书(thermo fisher scientific,usa)将大鼠mst1和/或yap1表达质粒,分别转入到h9c2细胞,转染48h后,将转染后的h9c2细胞用于凋亡分析和western blot等后续的操作。
[0122]
rna提取和qrt-pcr的操作方式如下:
[0123]
用trizol试剂(购自invitrogen,usa)从h9c2细胞中提取总rna。
[0124]
用access-rt-pcr系统将rna反转录成cdna,然后用荧光实时定量qrt-pcr进行定量分析。
[0125]
pcr扩增的体系为:
[0126][0127][0128]
pcr扩增的程序为:
[0129]
将加入样品的pcr管混匀后,使用step one实时荧光定量pcr仪系统(abi,美国)上进行real-time pcr。pcr反应用两步法进行,反应条件为95℃60秒;然后95℃15秒,接着60℃60秒,重复40-50个循环。得到的数据用abi公司(appliedbiosystems)提供的软件以2
–
δδct
的方法来计算,公式中的ct值代表达到超出荧光信号的检测阈值时所需要的pcr循环数。
[0130]
pcr扩增的引物如下:
[0131]
mst1基因:
[0132]
正向引物(序列表中的序列1):
[0133]5′-
catggctcaggtgaacagtat-3
′
;
[0134]
反向引物(序列表中的序列2):
[0135]5′-
ggtctctgggtccaaagtataac-3
′
。
[0136]
yap1基因:
[0137]
正向引物(序列表中的序列3):
[0138]5′-
tcggcaggcaatacggaata-3
′
;
[0139]
反义引物(序列表中的序列4):
[0140]5′-
catgctgaggccactgtctgt-3
′
。
[0141]
β-actin基因:
[0142]
正向引物(序列表中的序列5):5
′-
tcgtgcgtgacattaaggag-3
′
;
[0143]
反向引物(序列表中的序列6):5
′-
atgccagggtacatggtggt-3
′
。
[0144]
rna干扰(rnai)的操作方式如下:
[0145]
mst1基因的小干扰rna(sirna)的序列组成为5
′-
gccgagccttccactacaata-3
′
(序列表中的序列7)。阴性对照序列为:5
′-
cgtcacatgggctttcacc-3
′
。含有上述mst1基因的小干扰rna序列和阴性对照序列的重组质粒均购自优宝生物公司,其中,质粒载体为psilencer 4.1-cmv neo(ambion,usa)。根据制造商的建议,使用lipofectamine 3000(thermo fisher scientific,usa)将mst1干扰质粒转入到h9c2细胞中。转染48h后,将转染后的h9c2细胞用于后续的操作。
[0146]
hoechst 33342染色细胞凋亡检测的操作方式如下:
[0147]
用hoechst33342(购自sigma)染色观察h9c2细胞核形态变化,荧光显微镜观察细胞凋亡情况。实验重复5次。随机选取5个视野,计数凋亡细胞核数,计算凋亡比率。
[0148]
获得的数据按照如下方式进行统计分析:
[0149]
数据以平均值
±
标准差(mean
±
s.d.)表示,代表来自三次独立平行实验的结果。平均值间统计的差异显著性由anova(方差)检验。平均值有显著差异,则通过t检验进行多比较来检验。概率值p<0.05代表差异显著,用“*”表示;p<0.01代表差异极显著,用“**”表示。
[0150]
结果如下:
[0151]
mst1基因表达与高糖诱导心脏发育异常发生的相关性:
[0152]
对上述获得的胎鼠胚胎心肌组织进行he染色后发现,同对照组相比,高血糖妊娠大鼠的胎鼠的心脏发育异常,具体体现为心室壁偏薄(未图示)。
[0153]
如图1-a所示的免疫组化检测结果,同对照组胎鼠胚胎心肌组织(左侧图)相比,妊娠高血糖大鼠的胎鼠心肌组织(心室壁偏薄部分的心肌组织)中mst1蛋白质表达升高(根据图1-a,mst1蛋白质表达量约升高8.5倍)。如图1-b所示的western blot检测结果,也证实了妊娠高血糖大鼠的胎鼠心肌组织中mst1蛋白质表达升高(根据图1-b,mst1蛋白质表达量约升高9倍)。与此同时,如图1-c所示的体外细胞试验的western blot检测结果,也证实了体外培养的心肌细胞在高糖环境下心肌细胞中mst1蛋白质表达升高(根据图1-c,mst1蛋白质在h9c2细胞中表达量约升高9倍)。如图1-d所示,在转录水平上,经qrt-pcr检测发现,与对照组胎鼠胚胎心肌组织相比,妊娠高血糖大鼠的胎鼠心肌组织中mst1的mrna表达也明显升高(根据图1-d,mst1的mrna表达量约升高12倍)。如图1-e所示,通过体外细胞试验检测高糖环境下,心肌细胞中mst1基因mrna表达变化发现,在转录水平上,经qrt-pcr检测发现,与对照组相比,高糖环境下心肌细胞中mst1的mrna表达也明显升高(根据图1-e,mst1的mrna表
达量约升高12.5倍)。
[0154]
mst1异常表达对心肌细胞凋亡的影响:
[0155]
为深入研究mst1对心肌细胞凋亡的调节作用,构建了rnai干涉质粒,并通过体外细胞实验检测心肌细胞中mst1蛋白表达变化。如图2-a所示,向按前述方式培养的对照组h9c2细胞中转入mst1 sirna干涉质粒后,可以发现mst1蛋白质表达水平明显降低(根据图2-a,mst1蛋白质表达降低了65%)。通过图2-b和2-c所示的凋亡染色分析结果可以发现,向h9c2细胞中转入mst1 sirna之后,凋亡细胞减少(根据图2-b和2-c,向h9c2细胞中转如入mst1 sirna之后,凋亡细胞减少了约15%),这说明干涉h9c2细胞中mst1表达后,可以部分抵制高糖对心肌细胞凋亡的促进作用。另外,如图2-d所示,将mst1表达质粒转入按前述方式培养的对照组h9c2细胞后,western bot结果显示,mst1蛋白表达显著增加(根据图2-d,mst1蛋白质表达升高了约9倍)。通过图2-e和2-f所示的凋亡染色结果可以发现,将mst1表达质粒转入按前述方式培养的对照组h9c2细胞中,可以诱导心肌细胞凋亡(根据图2-e和2-f,凋亡细胞比率增加了约15%)。
[0156]
yap1作为mst1下游效应基因参与调节mst1诱导的心肌细胞凋亡:
[0157]
如图3-a所示的通过免疫组化检测yap1在高糖组胎鼠心肌组织和正常的对照组胎鼠心肌组织中的表达情况,可以发现与正常的对照组胎鼠心肌组织相比,高糖组胎鼠心肌组织中的yap1蛋白表达降低(根据图3-a,yap1蛋白表达降低了60%)。如图3-b所示的western blot检测结果也证实了高糖组胎鼠心肌组织中的yap1蛋白表达降低(根据图3-b,yap1蛋白表达降低了62%)。如图3-c所示,与按照前述对照组的培养方式培养的h9c2细胞相比,高糖组的h9c2细胞中yap1蛋白表达明显降低(根据图3-c,yap1蛋白质表达降低了64%)。如图3-d所示的通过qrt-pcr检测yap1基因在高糖组胎鼠心肌组织和正常的对照组胎鼠心肌组织中的mrna表达情况,可以发现与正常的对照组胎鼠心肌组织相比,高糖组胎鼠心肌组织中的yap1基因mrna表达并不显著。如图3-e所示,经qrt-pcr检测发现,同对照组的h9c2细胞相比,高糖组的h9c2细胞中yap1基因的mrna降低的也同样并不显著。如图3-f所示,通过western blot检测发现,与转入对照sirna的高糖组h9c2细胞相比,转入mst1 sirna的高糖组h9c2细胞中yap1蛋白表达升高(根据图3-e,yap1蛋白表达升高了40%),说明转入mst1sirna可以部分抵制高糖对yap1蛋白表达的下调作用。通过图3-g和3-h所示的结果可以发现,当在对照组的h9c2细胞中过表达mst1后,yap1蛋白表达明显降低(约降低40%),说明mst1参与调节yap1蛋白表达。如图3-i所示,当向对照组的h9c2细胞中转入yap1表达质粒后,细胞凋亡分析结果显示,过表达yap1可以部分抵制mst1对心肌细胞凋亡的诱导作用(根据图3-i所示,凋亡细胞比率下降了约11%);由此说明yap1是mst1下游效应基因,调节mst1诱导的心肌细胞凋亡。
[0158]
mst1调节yap1表达需要last1/2的参与:
[0159]
如图4-a所示,western blot检测结果显示,在对照组h9c2细胞中mst1过表达后,yap1蛋白第127位和397位的丝氨酸磷酸化水平增加;其中,第127位丝氨酸磷酸化水平增加约31%,第397位丝氨酸磷酸化水平增加约33%。如图4-b所示,通过western blot检测last1/2磷酸化水平变化的结果可以发现,与转入空白质粒的对照组h9c2细胞相比,转入mst1表达质粒的对照组h9c2细胞(mst1过表达)中,last1/2磷酸化水平增加(根据图4-b,last1/2磷酸化水平增加约9倍。从图4-c所示的结果可以看出,在高糖组h9c2细胞中转入
mst1 sirna后,可以部分抵制高糖对last1/2磷酸化水平的上调作用。如图4-d所示,通过western blot检测发现,与对照组胎鼠心肌组织相比,高糖组胎鼠心肌组织中last1/2磷酸化水平明显升高。
[0160]
yap1调节survivin表达抑制心肌细胞凋亡:
[0161]
如图5-a所示,western blot检测结果显示,按照前述方式获取的高糖组胎鼠心肌组织中,抗凋亡蛋白survivin表达降低约64%(与按照前述方式获得的对照组胎鼠心肌组织相比)。如图5-b所示,western blot检测结果显示,按照前述方式培养的高糖组h9c2细胞中,抗凋亡蛋白survivin表达降低约64%(与按照前述方式培养的对照组h9c2细胞相比)。如图5-c所示,向按照前述方式培养的对照组h9c2细胞中转入yap1表达质粒后,yap1蛋白的表达增加。从图5-d所示的结果可以看出,向按照前述方式培养的高糖组h9c2细胞中转入yap1表达质粒后,与转入了空白质粒的高糖组h9c2细胞相比,抗凋亡蛋白survivin表达升高,说明yap1过表达可以部分抵制高糖对survivin的下调作用。从图5-e所示的结果可以看出,当向高糖组h9c2细胞培养液中加入survivin抑制剂ym-155后,可以抵制yap1对心肌细胞凋亡的抑制作用。由此说明survivin是yap1下游效应基因,调节yap1诱导的心肌细胞凋亡。
[0162]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



