用于治疗癌症、视网膜病症和心肌病的三取代嘧啶化合物和组合物的制作方法
 2021-02-01 23:02:30|
2021-02-01 23:02:30| 408|
408| 起点商标网
起点商标网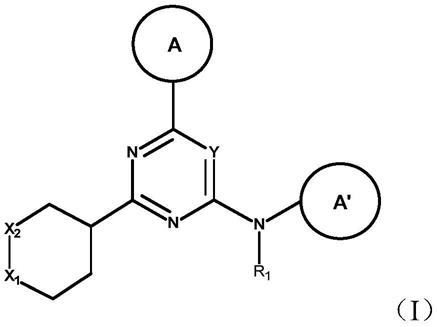
用于治疗癌症、视网膜病症和心肌病的三取代嘧啶化合物和组合物
[0001]
本申请是申请日为2018年5月2日的题为“用于治疗癌症、视网膜病症和心肌病的三取代嘧啶化合物和组合物”的中国专利申请第201880042801.0号的分案申请。
[0002]
优先权声明
[0003]
本申请要求2017年5月2日提交的意大利专利申请第102017000047189的优先权,其公开内容通过引用并入本文。
技术领域
[0004]
本发明涉及用于治疗心肌病、视网膜病症和癌症,特别是黑色素瘤的新型rhoj抑制剂。
[0005]
黑色素瘤是一种由黑色素细胞恶性转化发展而成的癌症,其发病率正在上升,而不幸的是,诸如达卡巴嗪和大剂量白细胞介素-2(il-2)化疗等传统疗法具有细胞毒性且疗效不佳,这就增加了对新治疗方法的需求。
[0006]
最近的策略包括使用braf抑制剂,例如维罗非尼。此外,使用阻断免疫检查点分子的抗体的免疫治疗方法,例如靶向抗细胞毒性t淋巴细胞抗原4(ctla-4)的易普利姆玛(ipilimumab),目前用于治疗不可切除的黑色素瘤。其他研究使用pd1抑制剂组合,如纳武单抗(nivolumab)和易普利姆玛。虽然这些治疗可以在一些患者中引起显著的反应,但是只有30%的患者对这些治疗有反应。早期疾病特别需要改进的治疗方法,只有白细胞介素2和溶瘤病毒治疗取得了非常有限的成功。
[0007]
在这种情况下,一种可替代且有前景的方法是将多种试剂和传统抗癌方式(放疗、化疗或手术)结合在一起来使用,以提高治疗效果并减少副作用。
[0008]
然而,所有这些可能的治疗策略并没有使黑色素瘤患者死亡率和转移性黑色素瘤的进展显着下降。对化疗的内在和/或获得性耐药仍然是一个主要问题,并产生了确定治疗它的新途径的强烈需求。此外,确定具有有限毒性并可用于治疗早期疾病(iii期)的试剂将具有重要的治疗适用性。
[0009]
由于rhoj表达调节黑色素瘤的发展,因此rhoj目前在联合治疗策略中被认为是有效的靶标。rhoj是小gtp酶rho家族的成员,已知能够结合和激活pak激酶。功能验证研究表明,rhoj激活pak1,然后其抑制p53信号转导和黑色素瘤细胞在体外的凋亡途径。
背景技术:
[0010]
其他研究表明,rhoj和pak1还调节黑色素瘤细胞在体外的迁移和侵袭,以及在黑色素瘤异种移植模型中的肿瘤生长和侵袭。虽然已知rhoj在内皮细胞生物学和血管生成中起作用,但尚不清楚rhoj是否对黑色素细胞肿瘤的生长具有细胞自主效应。最近的研究已经确定,在原生小鼠模型中rhoj调节黑色素瘤肿瘤的生长和发育,与iv期黑色素瘤相比,rhoj在iii期黑色素瘤中的表达水平更高。总体而言,这些体外和体内研究表明,rhoj和pak1促进新生黑色素瘤肿瘤的生长,抑制凋亡并刺激血管生成。最近的研究表明,rhoj在肿
瘤细胞中发挥作用,通过阻断bad的磷酸化来抑制凋亡,从而阻止bad诱导凋亡。rhoj相互作用抑制剂阻断pak激酶诱导的bad磷酸化,这与pak抑制剂观察到的效果相似。
[0011]
此外,rhoj还被认为在心肌病的病理生理学诸如扩张型心肌病(dcm)中发挥核心作用,并可能成为特异性操纵内皮丝状伪足突起的治疗靶点。
[0012]
由于这些原因,阻断rhoj可以被认为是治疗病理疾病诸如心肌病、视网膜疾病、iii期或iv期黑色素瘤以及对其他疗法表现出抗性的其他癌症的有用工具。
[0013]
因此,需要新的化合物来抑制rhoj。
技术实现要素:
[0014]
本发明的目的是提供用作rhoj抑制剂的新化合物。
附图说明
[0015]
现在将参照附图详细描述本发明,其中:
[0016]-图1示出了通过流式细胞术使用annexinv和pi测量的由rhoj相互作用抑制剂arn12405(化合物1)诱导wm3248黑色素瘤细胞凋亡;
[0017]-图2示出了用化合物1(arn12405)温育的wm3248细胞裂解物中rhoj pak相互作用的阻断,通过sds page和免疫印迹鉴定(板a)rhoj抗体;(板b)cdc42抗体;(板c)rac1抗体。(板d)用浓度为10μm或50μm的化合物1(arn12405)处理的细胞。
具体实施方式
[0018]
以下段落提供了根据本发明的化合物的各种化学部分(moieties)的定义,并且旨在均匀地应用于整个说明书和权利要求中,除非另外明确陈述的定义提供了更宽泛的定义。
[0019]
本文所用的术语“烷基”本身或作为另一取代基的一部分是指脂肪族烃基。该术语包括直(无支链的)链或支链,其可以是完全饱和的、单不饱和的或多不饱和的。
[0020]
术语“不饱和”脂肪族烃基包括链烯基和炔基。
[0021]
本文所用的术语“烯基”是指优选具有2-6个碳原子并含有至少一个碳-碳双键的烷基。
[0022]
本文所用的术语“炔基”是指优选具有2-6个碳原子并含有至少一个碳-碳三键烷基。
[0023]
根据本发明的烷基的非限制性实例是例如甲基、乙基、丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、正己基、乙烯基、1-丙烯基、2-丙烯基、1-或2-丁烯基、乙炔基、1-丙炔基、2-丙炔基、1-或2-丁炔基等。
[0024]
本文所用的术语“烷氧基”是指通过氧原子与化合物的其余部分连接的烷基。
[0025]
本文所用的术语“卤素”是指氟、氯、溴和碘。
[0026]
本文所用的术语“芳环”是指这样的部分,其中成分碳原子构成不饱和环系,环系中的所有原子是sp2杂化的,π-电子的总数等于4n+2,其中n是整数。
[0027]
本文所用的术语“杂芳环”是指其中1-4个碳原子独立地被选自由氮,氧和硫组成的组的杂原子取代的如上定义的芳环。杂芳环基团的非限制性实例是例如吡咯基、呋喃基、
噻吩基、咪唑基、吡唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、吲哚基、苯并呋喃基、苯并噻吩基、苯并咪唑基、苯并吡唑基、苯并噁唑基、苯并异噁唑基、苯并噻唑基、苯并异噻唑基、三唑基、噁二唑基、四唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、喹啉基、异喹啉基、喹唑啉基、喹喔啉基。
[0028]
除非另有说明,本文所用的术语“取代的”是指前文提及的基团的一个或多个氢原子被另一个非氢原子或官能团替代,条件是保持正常化合价并且取代产生稳定的化合物。
[0029]
术语“药学上可接受的盐”是指以下定义的式(i)化合物的盐,其保留期望的生物活性并且被监管机构接受。
[0030]
如本文所用,术语“盐”是指由无机或有机酸或碱和内部形成的盐制备的根据本发明的化合物的任何盐。通常,这种盐具有生理上可接受的阴离子或阳离子。
[0031]
此外,根据取代基的种类,式(i)化合物可以与碱形成酸加成盐或盐,并且这些盐包括在本发明中,只要它们是药学上可接受的盐。
[0032]
这些盐的实例包括但不限于与无机酸形成的酸加成盐(例如盐酸、氢溴酸、硫酸、磷酸、硝酸等)和与有机酸如乙酸、三氟乙酸、草酸、酒石酸、琥珀酸、苹果酸、富马酸、马来酸、抗坏血酸、苯甲酸、藻酸、聚谷氨酸和萘磺酸形成的盐。
[0033]
生理学或药学上可接受的盐特别适合于医学应用,因为对于母体化合物它们相具有更大的水溶性。
[0034]
药学上可接受的盐还可以使用常规方法由式(i)化合物的其它盐(包括其它药学上可接受的盐)制备。
[0035]
有机化学领域的普通技术人员将理解,许多有机化合物可与溶剂形成络合物,其中它们在溶剂中反应或从中沉淀或结晶。这些络合物称为“溶剂化物”。例如,与水的络合物称为“水合物”。本发明化合物的溶剂化物在本发明的范围内。通过适当溶剂的结晶或蒸发,可以容易地与溶剂分子结合分离式(i)的化合物,得到相应的溶剂化物。
[0036]
式(i)化合物可以是结晶形式。在某些实施方式中,式(i)化合物的结晶形式是多晶型物。
[0037]
本发明还包括同位素标记的化合物,其与式(i)和以下所述的那些相同,但不同之处在于一个或多个原子被原子质量或质量数不同于自然界中通常发现的原子质量或质量数的原子替代。可掺入本发明化合物及其药学上可接受的盐中的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、碘和氯的同位素、例如2h、3h、
11
c、
13
c、
14
c、
15
n、
17
o、
18
o、
31
p、
32
p、
35
s、
18
f、
36
cl、
123
i、
125
i。
[0038]
含有上述同位素和/或其它原子的其它同位素的本发明化合物和所述化合物的药学上可接受的盐在本发明的范围内。本发明的同位素标记化合物,例如掺入放射性同位素如3h、
14
c的那些化合物可用于药物和/或底物组织分布测定。氚化(即3h)和碳-14(即
14
c)同位素是特别优选的,因为它们易于制备和检测。
11
c和
18
f同位素特别可用于pet(正电子发射断层扫描),
125
i同位素特别可用于spect(单光子发射计算机断层扫描),所有这些都可用于脑成像。此外,用较重同位素(例如氘,即2h)取代可提供由较大代谢稳定性导致的某些治疗优势,例如增加体内半衰期或减少剂量需求,且因此在一些情况下可以是优选的。本发明的式(i)和以下同位素标记的化合物通常可以通过进行以下方案和/或实例中公开的步骤,通过用容易获得的同位素标记的试剂代替非同位素标记的试剂来制备。
[0039]
包括在本发明中的某些基团/取代基可以作为异构体或以一种或多种互变异构形式存在。因此,在某些实施方式中,取决于取代基的种类,式(i)化合物在一些情况下可以以其它互变异构体或几何异构体的形式存在。在本说明书中,化合物可以仅描述为这些异构体的一种形式,但本发明包括所有这些异构体、异构体的分离形式或其混合物。此外,式(i)的化合物在一些情况下可以具有不对称碳原子或轴向不对称,并且相应地,它们可以以光学异构体,例如(r)-形式、(s)-形式等的形式存在。本发明在范围内包括所有这些异构体,包括外消旋体、对映体及其混合物。
[0040]
特别地,在本发明的范围内包括所有立体异构形式,包括对映体、非对映体及其混合物,包括外消旋体,并且除非另有说明,对式(i)化合物的一般性提及包括所有立体异构形式。
[0041]
通常,本发明的化合物或盐应当解释为排除那些本身或在水中化学不稳定的化合物(如果有的话),使得它们明显不适合通过所有给药途径(无论是口服、胃肠外或其它)用于药物用途。这些化合物是专业化学家已知的。
[0042]
根据本发明的第一方面,提供了式(i)化合物:
[0043][0044]
或其药学上可接受的盐或溶剂化物。
[0045]
在式(i)的化合物中:
[0046]
x1和x2独立地选自由ch2、nr2和o组成的组,条件是x1和x2不同时为nr2、不同时为o或不同时为nr2和o;
[0047]
y选自由ch和n组成的组;
[0048]
a和a'独立地选自由含有1或2个氮原子的6-元杂芳环和由取代基在任意位置任选取代的6-元芳环组成的组,取代基选自由c
1-6
烷基、卤素、卤代-c
1-6
烷基、羟基、烷氧基-c
1-6
烷基、氨基、氨基-c
1-6
烷基和氨基-二c
1-6
烷基组成的组;
[0049]
r1选自由氢和c
1-6
烷基组成的组;
[0050]
r2选自由氢、c
1-6
烷基、c
1-6
烷基-烷氧基、co-c
1-6
烷基和co-c
1-6
烷基-烷氧基组成的组。
[0051]
根据第一实施方式:
[0052]
a和a'独立地选自由含有1个氮原子的6-元杂芳环和由取代基在任意位置任选取代的6-元芳环组成的组,取代基选自由卤素、烷氧基-c
1-6
烷基、氨基、氨基-c
1-6
烷基、氨基-二c
1-6
烷基组成的组;
[0053]
r1是氢;
[0054]
r2是氢。
[0055]
根据第二实施方式:
[0056]
x1选自由ch2、nh和o组成的组;
[0057]
x2选自由ch2和nh组成的组,条件是x1和x2不同时为n;
[0058]
y是ch2;
[0059]
a选自由在2位或3位含有1个氮原子的6元杂芳环和由取代基任选取代的6-元芳环组成的组,取代基选自由卤素和烷氧基-c
1-3
烷基组成的组;
[0060]
a'选自由被取代基在间位或对位任选取代的6元芳环组成的组,取代基选自由卤素、烷氧基-c
1-6
烷基和氨基-二c
1-6
烷基组成的组;
[0061]
r1是氢;
[0062]
r2是氢。
[0063]
在进一步的实施方式中,a选自由含有1个氮原子的杂芳香族6-元环和未取代的6-元芳环组成的组。
[0064]
在优选的实施方式中,a'是由取代基在对位或间位取代基取代的6元芳环,取代基选自由甲氧基或氨基-二-c2烷基组成的组。
[0065]
根据本发明的第三实施方式,式(i)化合物可选自以下项组成的组:
[0066]
[0067]
[0068]
[0069]
[0070]
[0071][0072]
本发明中示例的化合物可以使用例如迈克尔
·
史密斯,杰瑞
·
马奇,《马奇的高级有机化学:反应机理和结构-第六版》,约翰
·
威利父子公司,2007年(michael smith,jerry march-march
’
s advanced organic chemistry:reactions mechanisms and structure-6th edition,john wiley&sons inc.,2007)中示例的以下通用方法和步骤由容易获得的原料制备。
[0073]
本领域普通技术人员公知的是将化学官能团转化成另一种可能需要保护含有该官能团的化合物中的一个或多个反应中心,以避免不期望的副反应。这些反应中心的保护和随后在合成转化结束时的去保护可以按照例如西奥多拉
·
w
·
格林和彼得
·
g
·
m,《有机合成中的保护基》,第四版,约翰
·
威利父子公司,2006年(theodora w.green and peter g.m.wuts-protective groups in organic synthesis,fourth edition,john wiley&sons inc.,2006)中描述的标准方法完成。
[0074]
应当理解,当给出典型或优选的实验条件(即反应温度、时间、试剂的摩尔数、溶剂等)时,除非另有说明,否则也可以使用其它实验条件。最佳反应条件可随所用的特定反应物或溶剂而变化,但这些条件可由本领域技术人员使用常规优化法来确定。
[0075]
根据下述合成方法,式(i)化合物的合成可以以逐步方式进行,由此在进行随后的反应之前,通过标准纯化技术例如柱色谱法分离和纯化各中间体。或者,合成顺序的两个或多个步骤可以在本领域已知的所谓“一锅(one-pot)”法中进行,由此仅分离和纯化由两个或多个步骤得到的化合物。
[0076]
可以通过常规技术或手段,例如通过过滤、蒸馏、色谱法、重结晶及其组合,来处理或纯化用本文以下描述的方法制备的式(i)化合物。
[0077]
式(i)化合物的盐可通过使碱性化合物与所需酸在溶液中反应来制备。
[0078]
本发明的第二方面涉及药物组合物,其包括如上所述的式(i)化合物及其药学上可接受的载体、稳定剂、稀释剂或赋形剂。
[0079]
本领域技术人员知道适于配制药物组合物的各种载体、稀释剂或赋形剂化合物。
[0080]
本发明的化合物与常规使用的佐剂、载体、稀释剂或赋形剂可以一起置于药物组合物及其单位剂量的形式中,并且在这样的形式中可以作为固体使用(例如片剂或填充的胶囊),或液体使用(例如溶液、悬浊液、乳液、酏剂或填充有它们的胶囊),全部用于口服使用,或呈用于胃肠外施用(包括皮下和静脉内使用)的无菌可注射溶液的形式。这样的药物组合物及其单位剂型可以包括常规比例的成分,含有或不含有其他的活性化合物或成分,并且这样的单位剂型可以含有与所使用的预期每日剂量范围相称的任何合适的有效量的
活性成分。
[0081]
含有本发明化合物的药物组合物可以以药物领域熟知的方式制备并且包括至少一种活性化合物。通常,本发明化合物以药学有效量给药。实际施用的化合物的量通常由医师根据相关情况来确定,包括待治疗的病症、选择的施用途径、施用的实际化合物、个体患者的年龄、体重和反应、患者症状的严重程度等。
[0082]
本发明的药物组合物可以通过多种途径给药,包括口服、直肠、皮下、静脉内、肌内、鼻内、局部、瘤内注射和肺部途径。
[0083]
用于口服给药的组合物可以采取散装液体溶液或悬浊液、或散装粉末的形式。然而,更通常地,组合物以单位剂型存在以促进精确给药。术语“单位剂型”是指物理上离散的单位,适合作为人类受试者和其他哺乳动物的单位剂量,每个单位包括经计算可产生期望治疗效果的预定数量的活性物质,并与适当的药物赋形剂相结合。典型的单位剂型包括液体组合物的预填充的、预定量的安瓿或注射器,或固体组合物的丸剂、片剂、胶囊等。
[0084]
适于口服给药的液体形式可以包括具有缓冲剂、悬浮剂和分散剂、着色剂、调味剂等的合适的水性或非水性载体。固体形式可以包括例如以下成分中的任一种或类似性质的化合物:粘合剂,例如微晶纤维素、黄蓍胶或明胶;赋形剂如淀粉或乳糖,崩解剂如海藻酸、淀粉或玉米淀粉;润滑剂,例如硬脂酸镁;助流剂,例如胶体二氧化硅;调味剂,例如蔗糖或糖精;或调味剂如薄荷、水杨酸甲酯或橙子调味剂。
[0085]
可注射组合物通常基于可注射无菌盐水或磷酸盐缓冲盐水或本领域已知的其它可注射载体。
[0086]
药物组合物可以是片剂、丸剂、胶囊剂、溶液剂、悬浊液、乳剂、散剂、栓剂和缓释制剂的形式。
[0087]
如果需要,片剂可以通过标准的水性或非水性技术包衣。在某些实施方式中,这样的组合物和制剂可以含有至少0.1%的活性化合物。当然,这些组合物中活性化合物的百分比可以变化,并且可以方便地为单位重量的约1%至约60%。此类治疗上有用的组合物中活性化合物的量使得将获得治疗活性剂量。活性化合物还可以以例如液滴或喷雾的形式鼻内给药。
[0088]
片剂、丸剂、胶囊等还可以含有粘合剂,例如黄蓍胶、阿拉伯胶、玉米淀粉或明胶;赋形剂如磷酸氢钙;崩解剂,例如玉米淀粉、马铃薯淀粉、藻酸;润滑剂,例如硬脂酸镁;和调味剂,例如蔗糖、乳糖或糖精。当剂量单位形式是胶囊时,除了上述类型的材料之外,它还可以含有液体载体如脂肪油。各种其它材料可以作为包衣存在或改变剂量单位的物理形式。例如,片剂可以用虫胶、糖或两者包衣。除了活性成分之外,糖浆剂或酏剂还可以含有作为调味剂的蔗糖,作为防腐剂的对羟基苯甲酸甲酯和对羟基苯甲酸丙酯,染料和调味剂例如樱桃或橙子调味剂。为了防止在通过胃肠道上部的运输过程中分解,组合物是肠溶包衣制剂。
[0089]
当所需的治疗涉及通过局部施用容易接近的区域或器官时,药物组合物的局部施用是特别有用的。为了局部施用于皮肤,将用含有悬浮或溶解在载体中的活性组分的合适软膏剂配制药物组合物。用于局部施用本发明化合物的载体包括但不限于矿物油、液体石油、白矿脂、丙二醇、聚氧乙烯聚氧丙烯化合物、乳化蜡和水。或者,药物组合物可以用合适的洗剂或霜剂配制,该洗剂或霜剂含有悬浮或溶解在载体中的活性化合物。合适的载体包
括但不限于矿物油、山梨醇酐单硬脂酸酯、聚山梨醇酯60、十六烷基酯蜡、鲸蜡硬脂醇、2-辛基十二烷醇、苯甲醇和水。还描述了局部透皮贴剂和离子电渗给药。
[0090]
用于肺部给药的组合物包括但不限于由通式(i)化合物或其盐的粉末和合适的载体和/或润滑剂的粉末组成的干粉组合物。用于肺部给药的组合物可从本领域技术人员已知的任何合适的干粉吸入器装置吸入。
[0091]
本发明的化合物还可以通过肿瘤内注射或直接注射到肿瘤脉管系统中来施用。局部、区域或全身给药也是合适的。对于>4cm的肿瘤,施用的量为约4-10ml(优选10ml),而对于<4cm的肿瘤,使用的量为约1-3ml(优选3ml)。以单剂量递送的多次注射包括约0.1至约0.5ml的量。在外科干预的情况下,本发明可以在术前使用,以使不能手术的肿瘤受试者能接受切除。
[0092]
组合物的给药在足以减轻受试者炎症和疼痛的方案和剂量下进行。在一些实施方式中,在本发明的药物组合物中,一种或多种活性成分通常配制成剂量单位。剂量单位可以含有0.1-1000mg式(i)化合物/剂量单位用于每日给药。
[0093]
在一些实施方式中,对特定制剂有效的量将取决于疾病、障碍或病症的严重程度、先前的治疗、个体的健康状况和对药物的反应。在一些实施方式中,剂量为制剂的0.001重量%至约60重量%的范围内。
[0094]
当与一种或多种其它活性成分组合使用时,本发明化合物和其它活性成分可以以低于各自单独使用时的剂量使用。
[0095]
关于任何施用途径的制剂,施用药物的方法和制剂公开于《雷明顿药物科学》,第17版,真纳罗等人编,麦克出版社,1985年(remington
’
s pharmaceutical sciences,17th edition,gennaro et al.eds.,mack publishing co.,1985),和《雷明顿药物科学》,真纳罗
·
ar编,第20版,2000年,美国宾夕法尼亚州威廉姆斯和威尔金斯(remington
’
s pharmaceutical sciences,gennaro ar ed.20th edition,2000,williams&wilkins pa,usa,),和《雷明顿:药学科学与实践》,第21版,利平科特
·
威廉姆斯和威尔金斯编,2005年(remington:the science and practice of pharmacy,21st edition,lippincott williams&wilkins eds.,2005);以及《安塞尔药物剂型给药系统》,第8版,利平科特
·
威廉姆斯和威尔金斯编,2005年(ansel
’
s pharmaceutical dosage forms and drug delivery systems,8th edition,lippincott williams&wilkins eds.,2005)。
[0096]
上述用于口服给药或注射的组合物的组分仅仅是代表性的。
[0097]
本发明的化合物也可以以缓释形式或从缓释药物递送系统给药。
[0098]
式(i)化合物可用作独立的治疗剂,或与具有不同作用模式的其它化疗剂组合使用。优选的联合化疗剂选自顺铂、卡铂、奈达铂、奥沙利铂、赛特铂、四硝酸三铂、以及非经典的烷化剂如达卡巴嗪和替莫唑胺。式(i)化合物还可以与放射疗法组合使用。
[0099]
本发明的第三方面涉及如上公开的式(i)化合物或其药物组合物,或其药学上可接受的盐或溶剂化物作为药剂的用途。
[0100]
特别地,式(i)化合物可用于治疗与(相对于生理学或期望的)rhoj/cdc42表达或功能水平增加相关的疾病或病症。特别地,式(i)化合物可用作rhoj-pak的抑制剂,更特别地,它们可用于治疗原发性和转移性肿瘤疾病、癌前病症,例如增生、化生或异型增生、癌症、癌症转移、良性肿瘤、增生性疾病、心肌病和视网膜疾病。优选地,式(i)化合物用于治疗
黑色素瘤。
[0101]
在下文中,本发明将通过一些实例来说明,这些实例不应被解释为限制本发明的范围。
[0102]
以下缩写在下文用于所附实例中:乙酸(acoh)、乙腈(acn)、氨(nh3)、氘化氯仿(cdcl3)、氘化二甲亚砜(dmso-d6)、二氯甲烷(dcm)、二乙醚(et2o)、二甲亚砜(dmso)、乙醇(etoh)、乙酸乙酯(acoet)、盐酸(hcl)、叔丁基甲基醚(tbme)、甲醇(meoh)、室温(rt)、碳酸氢钠(nahco3)、氢氧化钠(naoh)、硫酸钠(na2so4)、二氯[1,1'-双(二苯基膦基)二茂铁]钯二氯甲烷络合物(pdcl2(dppf)二氯甲烷络合物)、水(h2o)。
[0103]
化学制品、材料和方法
[0104]
合成
[0105]
所有市售试剂和溶剂均未经进一步纯化即按购自供应商的方法使用。干溶剂购自西格玛奥德里奇(sigma-aldrich)。使用teledyne isco装置(rf)用不同尺寸的预填充硅胶柱(4g至120g)和极性增加的环己烷和乙酸乙酯(acoet),环己烷和叔丁基甲基醚(tbme)或二氯甲烷(dcm)和甲醇(meoh)的混合物进行自动柱色谱法纯化。
[0106]
表征
[0107]
nmr实验在配备有bbi探针和z-梯度的bruker avance iii 400系统(对于1h为400.13mhz)上进行。使用氘化二甲亚砜(dmso-d6)或氘化氯仿(cdcl3)作为溶剂,在300k获得光谱。对于1h-nmr,数据报告如下:化学位移、多重性(s=单峰、d=双峰、dd=双重双峰、t=三峰、q=四峰、m=多峰)、偶合常数(hz)和积分。uplc/ms分析在沃特世(waters)acquity uplc/ms系统上进行,该系统由配备有电喷雾离子化接口的sqd(单四极检测器)质谱仪和光电二极管阵列检测器组成。pda范围为210-400nm。在具有vanguard beh c18前置柱(5
×
2.1mmid,粒径1.7μm)的acquity uplc beh c18柱(100
×
2.1mm id,粒径1.7μm)上进行分析。流动相为用ph为5.0的ch3cn-h2o(95∶5)中的ch3cooh(a)和10mm nh4oac调节ph为5水中的10mm的nh4oac。对于分析方法1,流动相b比例在3分钟内从5%增加到95%。对于分析方法2,流动相b比例在3分钟内从50%增加到100%。电喷雾电离以正模式和负模式应用。esi以阳性和阴性模式应用。经nmr和uplc/ms分析,所有测试化合物的纯度均显示≥90%。
[0108]
制备和实例
[0109]
一般方案
[0110][0111]
反应a。苯硼酸(1eq),k2co
3 2m(2eq),pdcl2(dppf),dcm(0.05eq),1,4-二氧六环,60℃,微波,ar,1h,产率=72%。反应b。苯胺衍生物(1eq),pd(oac)2(0.05eq),racbinap(0.05eq),cs2co3(1.2eq),1,4-二氧六环,ar,60℃,微波,4h。反应c。4,4,5,5-四甲基硼酸酯(1.2eq),k2co
3 2m(2eq),pdcl2(dppf),dcm(0.05eq),1,4-二氧六环,120℃,微波,ar,2h。反应d和e
’
。hcoonh4(4eq),pd(oh)2/c(20重量%),meoh,回流,n2,4h,或h-cube装置(pd(oh)2柱体,50℃,50bar)。反应d'和e。hcl(4m),1,4-二氧六环,0℃至rt,1h。
[0112][0113]
反应1。1,1,1-三氟-n-苯基-n-(三氟甲磺酰基)甲烷磺酰胺(1.1eq),lda 2m thf/庚烷/乙苯(1.2eq),thf(干),-78℃至rt,ar,16h,产率28%。反应2。双联频哪醇基二硼(1.3eq),koac(2.8eq),pdcl2(dppf),dcm(0.1eq),1,4-二氧六环,80℃,ar,3h,产率80%。
[0114]
一般步骤反应b。钯催化苯胺衍生物偶联。
[0115]
将1,4-二氧六环(3ml)中pd(oac)2(0.05mmol)和rac binap(0.05mmol)的混合物在ar冲洗下搅拌10分钟。然后逐步加入1,4-二氧六环(1ml)中的中间体a(1mmol)的溶液,1,4-二氧六环(1ml)和cs2co3(1.2mmol)中相应的取代苯胺(1mmol)的溶液。将反应混合物在微波装置中在60℃下搅拌4小时,通过硅藻土粗贴片过滤,用dcm冲洗并在低压下浓缩至干燥。最终正相纯化得到中间体b.n。
[0116]
一般步骤反应c。铃木偶联反应。
[0117]
将由一般步骤b获得的化合物的悬浮液(1mmol),对应于1,4-二氧六环(10ml)中的4,4,5,5-四甲基硼酸酯(1.2mmol)、pdcl2(dppf)二氯甲烷络合物(0.1mmol)和k2co
3 2m溶液(2mmol)在微波装置中在120℃下搅拌2小时。将所得粗产物在二氯甲烷(25ml)、nahco3饱和溶液(25ml)之间分配,有机层用na2so4干燥并在低压下浓缩至干燥。最终正相纯化得到中间体c.n。
[0118]
一般步骤反应d和e'。双键还原。
[0119]
方法1。在n2气氛下,将待还原的化合物(1mmol)、甲酸铵(4mmol)、pd(oh)2/c(原料重量的20%)的悬浮液在回流温度下搅拌直至反应完成。通过硅藻土粗片滤出催化剂,并将所得滤液在低压下浓缩至干燥。最终正相纯化得到中间体d.n。
[0120]
方法2。在h-cube装置中,在50℃,50巴的h2压力下,通过pd(oh)
2-c柱洗脱meoh或thf中0.01m的起始物质溶液,直到反应完成。最终正相纯化得到中间体d
’
n。
[0121]
一般步骤反应d'和e。boc消去反应。
[0122]
向1,4-二氧六环(2.6ml)中boc保护化合物(1mmol)的0℃溶液中滴加1,4-二氧六环(2.6ml,10mmol)中hcl(4m)溶液,反应混合物在室温下搅拌1h,然后在低压下将反应粗产物浓缩至干燥,所得粗产物在dcm(20ml)和naoh 0.1m(20ml)之间分配,有机层用na2so4干燥并在低压下浓缩至干燥。最终正相纯化得到本发明的化合物。
[0123]
实施例1.n1,n1-二甲基-n4-[6-苯基-2-(3-哌啶基)嘧啶-4-基]苯-1,4-二胺(化合物8)
[0124][0125]
步骤1.2,4-二氯-6-苯基-嘧啶(中间体a)的合成。
[0126][0127]
将1,4-二氧六环(26.4ml)中2,4,6-三氯嘧啶(1000mg,5.29mmol)、苯基硼酸(665mg,5.29mmol),pdcl2(dppf)二氯甲烷络合物(204mg,0.26mmol)和k2co
3 2m溶液(5.3ml,10.58mmol)的悬浮液在微波装置中在60℃下搅拌1小时。将所得粗产物在二氯甲烷(150ml)、nahco3饱和溶液(100ml)之间分配,有机层用na2so4干燥并在低压下浓缩至干燥。最终正相纯化(环己烷/dcm从100/0至85/15)得到纯标题化合物(857mg,产率72%)。rt=1.38min(分析方法2);ms(esi)m/z:225.1[m-h]
+
,[m-h]
+
计算值:225.0。1h nmr(400mhz,cdcl3)δ8.13-8.03(m,2h),7.68(s,1h),7.62-7.48(m,3h)。
[0128]
步骤2.n1-(2-氯-6-苯基-嘧啶-4-基)-n4,n4-二甲基-苯-1,4-二胺(中间体b.1)的合成。
1.96(m,2h),1.81-1.73(m,2h),1.49(s,9h),1.32-1.17(m,12h)。
[0137]
步骤5.叔丁基5-[4-[4-(二甲基氨基)苯胺基]-6-苯基-嘧啶-2-基]-3,4-二氢-2h-吡啶-1-羧酸酯(中间体c.1)的合成。
[0138][0139]
按照前述一般步骤反应c,使用中间体b.1(100mg,0.35mmol)和中间体2(117.8mg,0.37mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至85/15)得到纯标题化合物(107.4mg,产率74%)。rt=2.58min(分析方法2);ms(esi)m/z 472.4[m-h]
+
,[m-h]
+
计算值:472.3。1h nmr(400mhz,dmso-d6)δ9.28(s,1h),8.12-7.96(m,2h),7.64-7.42(m,5h),7.15(s,1h),6.96(s,1h),6.86-6.69(m,2h),4.11(d,j=4.0hz,2h),3.55(t,j=5.7hz,2h),2.87(s,6h),2.67(d,j=7.0hz,2h),1.44(s,9h)。
[0140]
步骤6.叔丁基3-[4-[4-(二甲基氨基)苯胺基]-6-苯基-嘧啶-2-基]哌啶-1-羧酸酯(中间体d.1)的合成。
[0141][0142]
按照前述通用步骤d方法2,使用中间体c.1(60.5mg,0.12mmol)获得标题化合物。最终正相纯化(环己烷/tbme从90/10至70∶30)得到纯标题化合物(60mg,产率99%)。rt=2.22min(分析方法2);ms(esi)m/z:474.4[m-h]
+
,[m-h]
+
计算值:474.3。1h nmr(400mhz,dmso-d6)δ9.38(s,1h),8.24-7.80(m,2h),7.59-7.34(m,5h),6.98(s,1h),6.91-6.59(m,2h),3.37(d,j=9.8hz,1h),3.16-3.02(m,1h),3.02-2.91(m,2h),2.87(s,6h),2.68(td,j=11.9,3.0hz,1h),2.23-2.05(m,1h),1.89-1.70(m,2h),1.63(q,j=12.8hz,1h),1.45(s,9h)。
[0143]
步骤7.n1,n1-二甲基-n4-[6-苯基-2-(3-哌啶基)嘧啶-4-基]苯-1,4-二胺(化合物8)的合成。
[0144]
[0145]
按照前述一般步骤反应e,使用中间体d.1(61mg,0.13mmol)获得标题化合物。最终正相纯化(dcm/dcm∶nh
3 1m meoh 4∶1,从80/20至60/40),得到纯标题化合物(46mg,产率95%)。rt=1.96min(分析方法1);ms(esi)m/z:374.6[m-h]
+
,[m-h]
+
计算值:374.2。1h nmr(400mhz,dmso-d6)δ9.38(s,1h),8.24-7.80(m,2h),7.59-7.34(m,5h),6.98(s,1h),6.91-6.59(m,2h),3.37(d,j=9.8hz,1h),3.16-3.02(m,1h),3.02-2.91(m,2h),2.87(s,6h),2.68(td,j=11.9,3.0hz,1h),2.23-2.05(m,1h),1.89-1.70(m,2h),1.63(q,j=12.8hz,1h)。
[0146]
实施例2.n-(4-甲氧基苯基)-6-苯基-2-(3-哌啶基)嘧啶-4-胺(化合物9)
[0147][0148]
步骤1.2-氯-n-(4-甲氧基苯基)-6-苯基-嘧啶-4-胺(中间体b.2)的合成。
[0149][0150]
按照前述一般步骤反应b,使用中间体a(100mg,0.44mmol)和对甲氧基苯胺(55.2mg,0.44mmol)获得标题化合物。最终正相纯化(环己烷/tbme从95/5至75/25)得到纯标题化合物(86.8mg,产率63%)。rt=1.39min(分析方法2);ms(esi)m/z:312.1[m-h]
+
,[m-h]
+
计算值:312.1。1h nmr(400mhz,dmso-d6)δ9.91(s,1h),8.06-7.84(m,2h),7.65-7.37(m,5h),7.06(s,1h),7.02-6.92(m,2h),3.76(s,3h)。
[0151]
步骤2.叔丁基5-[4-(4-甲氧基苯胺基)-6-苯基-嘧啶-2-基]-3,4-二氢-2h-吡啶-1-羧酸酯(中间体c.2)的合成。
[0152][0153]
按照前述一般步骤c,使用中间体b.2(100mg,0.32mmol)和中间体2(119.0mg,0.38mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至80/20)得到纯标题化合物(64.7mg,产率44%)。rt=2.37min(分析方法2);ms(esi)m/z 459.6[m-h]
+
,[m-h]
+
计算值:459.2。1h nmr(400mhz,cdcl3)δ8.05-7.97(m,2h),7.46-7.37(m,3h),7.31(t,j=6.5hz,2h),6.98-6.90(m,2h),6.71(s,1h),6.68-6.46(m,1h),3.84(s,3h),3.66(d,j=9.5hz,2h),2.82-2.60(m,2h),2.02-1.86(m,2h),1.56(s,9h)。
[0154]
步骤3.叔丁基3-[4-(4-甲氧基苯胺基)-6-苯基-嘧啶-2-基]哌啶-1-羧酸酯(中间体d.2)的合成。
[0155][0156]
按照前述一般步骤反应d方法2,使用中间体c.2(65.0mg,0.14mmol)获得标题化合物。最终正相纯化(环己烷/tbme从100/0至80/20)得到纯标题化合物(40mg,产率62%)。rt=1.94min(分析方法2);ms(esi)m/z:461.2[m-h]
+
,[m-h]
+
计算值:461.2。1h nmr(400mhz,cdcl3)δ8.07-7.80(m,2h),7.46-7.38(m,3h),7.26(s,1h),7.01-6.89(m,2h),6.77(s,1h),6.71(s,1h),3.84(s,3h),3.01-2.68(m,2h),2.23(d,j=12.3hz,1h),1.80(qd,j=13.0,3.8hz,2h),1.73-1.52(m,4h),1.47(s,9h)。
[0157]
步骤4.n-(4-甲氧基苯基)-6-苯基-2-(3-哌啶基)嘧啶-4-胺(化合物9)的合成。
[0158][0159]
按照前述一般步骤反应e,使用中间体d.2(40mg,0.09mmol)获得标题化合物。最终正相纯化(dcm/dcm∶nh
3 1m meoh 4∶1,从85/15至65∶35),得到纯标题化合物(31mg,产率99%)。rt=0.49min(分析方法2);ms(esi)m/z:361.6[m-h]
+
,[m-h]
+
计算值:361.2。1h nmr(400mhz,dmso-d6)δ9.60(s,1h),8.15-7.90(m,2h),7.59(d,j=8.4hz,2h),7.56-7.47(m,3h),7.05(d,j=4.2hz,1h),7.00-6.90(m,2h),3.76(s,3h),3.60(d,j=11.9hz,1h),3.33-3.11(m,3h),2.96-2.91(m,1h),2.26-2.19(m,1h),1.97-1.65(m,2h)。
[0160]
实施例3.n3,n3-二甲基-n1-[6-苯基-2-(3-哌啶基)嘧啶-4-基]苯-1,3-二胺(化合物10)
[0161][0162]
步骤1.n1-(2-氯-6-苯基-嘧啶-4-基)-n3,n3-二甲基-苯-1,3-二胺(中间体b.3)的合成。
[0163][0164]
按照前述一般步骤反应b,使用中间体a(300mg,1.13mmol)和n1,n1-二甲基苯-1,3-二胺(181.5mg,1.33mmol)获得标题化合物。最终正相纯化(环己烷/tbme从100/0至80/20)得到纯标题化合物(246mg,产率57%)。rt=1.73min(分析方法2);ms(esi)m/z:325.1[m-h]
+
,[m-h]
+
计算值:325.1。1h nmr(400mhz,dmso-d6)δ9.93(s,1h),8.14-7.82(m,2h),7.60-7.47(m,3h),7.29-7.09(m,2h),7.04(s,1h),6.99-6.85(m,1h),6.51(ddd,j=8.4,2.5,0.8hz,1h),2.92(s,6h)。
[0165]
步骤2.叔丁基5-[4-[3-(二甲基氨基)苯胺基]-6-苯基-嘧啶-2-基]-3,4-二氢-2h-吡啶-1-羧酸酯(中间体c.3)的合成。
[0166][0167]
按照前述一般步骤反应c,使用中间体b.3(175mg,0.54mmol)和中间体2(199.9mg,0.65mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至85/15)得到纯标题化合物(109.2mg,产率43%)。rt=2.65min(分析方法2);ms(esi)m/z 472.3[m-h]
+
,[m-h]
+
计算值:472.3。1h nmr(400mhz,dmso-d6)δ9.34(s,1h),8.40(s,1h),8.04(dd,j=7.7,1.9hz,2h),7.59-7.44(m,4h),7.11(t,j=8.0hz,2h),6.99(s,1h),6.40(dd,j=9.1,2.5hz,1h),3.59(t,j=5.6hz,2h),2.92(s,6h),2.65-2.59(m,2h),1.88(p,j=6.0hz,2h),1.50(s,9h)。
[0168]
步骤3.叔丁基3-[4-[3-(二甲基氨基)苯胺基]-6-苯基-嘧啶-2-基]哌啶-1-羧酸酯(中间体d.3)的合成。
[0169][0170]
按照前述一般步骤反应d方法2,使用中间体c.3(105mg,0.22mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至80/20)得到纯标题化合物(12mg,产率12%)。rt=2.35min(分析方法2);ms(esi)m/z:474.6[m-h]
+
,[m-h]
+
计算值:474.3。1h nmr(400mhz,cdcl3)δ8.04-7.93(m,2h),7.49-7.37(m,4h),7.04(s,1h),6.78(s,1h),6.69(d,j=7.7hz,
1-羧酸酯(中间体c.4)的合成。
[0180][0181]
按照前述一般步骤反应c,使用中间体b.4(100mg,0.32mmol)和中间体2(119.0mg,0.38mmol)获得标题化合物。最终正相纯化(环己烷/tbme从100/0至80/20)得到纯标题化合物(65.0mg,产率44%)。rt=2.40min(方法2);ms(esi)m/z 459.6[m-h]
+
,[m-h]
+
计算值:459.2。
[0182]
步骤3.叔丁基3-[4-(3-甲氧基苯胺基)-6-苯基-嘧啶-2-基]哌啶-1-羧酸酯(中间体d.4)的合成。
[0183]
按照前述一般步骤反应d方法2,使用中间体c.4(65.0mg,0.14mmol)
[0184][0185]
获得标题化合物。最终正相纯化(正己烷/acoet从100/0至80∶20)得到纯标题化合物(32.6mg,产率50%)。rt=2.13min(分析方法2);ms(esi)m/z:461.6[m-h]
+
,[m-h]
+
计算值:461.2。1h nmr(400mhz,cdcl3)δ8.04-7.92(m,2h),7.45(p,j=3.9,3.2hz,3h),7.30(t,j=8.1hz,1h),7.08(t,j=2.2hz,1h),6.99(s,1h),6.95(dd,j=7.9,2.0hz,1h),6.89(s,1h),6.72(dd,j=8.3,2.4hz,1h),3.84(s,3h),3.20(s,1h),2.99-2.88(m,1h),2.80(t,j=12.5hz,1h),2.26(d,j=12.5hz,1h),1.93-1.74(m,2h),1.75-1.51(m,3h),1.47(s,9h)。
[0186]
步骤4.n-(3-甲氧基苯基)-6-苯基-2-(3-哌啶基)嘧啶-4-胺(化合物11)的合成。
[0187][0188]
按照一般步骤反应e,使用中间体d.4(61mg,0.13mmol)获得标题化合物。最终正相纯化(dcm/dcm∶nh
3 1m meoh 4∶1,从85/15至60/40),得到纯标题化合物(39mg,产率82%)。rt=1.91min(分析方法1);ms(esi)m/z:361.6[m-h]
+
,[m-h]
+
计算值:361.2。1h nmr(400mhz,dmso-d6)δ9.89(s,1h),8.17-7.94(m,2h),7.67-7.44(m,4h),7.34-7.12(m,3h),6.61(dt,j=5.4,2.4hz,1h),3.79(s,3h),3.63(d,j=8.1hz,1h),3.27-3.18(m,3h),2.89(d,j=14.1hz,1h),2.26(d,j=11.7hz,1h),2.01-1.67(m,3h)。
[0189]
实施例5.n4,n4-二甲基-n1-[6-苯基-2-(4-哌啶基)嘧啶-4-基]苯-1,4-二胺(化合物12)
[0190][0191]
步骤1.叔丁基4-[4-[4-(二甲基氨基)苯胺基]-6-苯基-嘧啶-2-基]-3,6-二氢-2h-吡啶-1-羧酸酯(中间体c.5)的合成。
[0192][0193]
按照前述一般步骤反应c,使用中间体b.1(100mg,0.35mmol)和4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-3,6-二氢-2h-吡啶-1-羧酸叔丁酯(117.8mg,0.37mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至85/15)得到纯标题化合物(107.4mg,产率74%)。rt=2.58min(分析方法2);ms(esi)m/z 472.4[m-h]
+
,[m-h]
+
计算值:472.3。1h nmr(400mhz,dmso-d6)δ9.28(s,1h),8.12-7.96(m,2h),7.64-7.42(m,5h),7.15(s,1h),6.96(s,1h),6.86-6.69(m,2h),4.11(d,j=4.0hz,2h),3.55(t,j=5.7hz,2h),2.87(s,6h),2.67(d,j=7.0hz,2h),1.44(s,9h)。
[0194]
步骤2.n4,n4-二甲基-n1-[6-苯基-2-(1,2,3,6-四氢吡啶-4-基)嘧啶-4-基]苯-1,4-二胺(中间体d'.5)的合成。
[0195][0196]
按照一般步骤反应d'(84mg,产率99%),使用中间体c.5(106mg,0.22mmol)获得标题化合物。rt=0.72min(分析方法2);ms(esi)m/z:372.5[m-h]
+
,[m-h]
+
计算值:372.2。所得固体无需任何进一步纯化步即可用于下一步骤。
[0197]
步骤3.n4,n4-二甲基-n1-[6-苯基-2-(4-哌啶基)嘧啶-4-基]苯-1,4-二胺(化合物12)的合成。
[0198][0199]
按照先前描述的一般步骤反应e'方法1,使用中间体d'.5(84mg,0.22mmol)获得标题化合物。最终正相纯化(dcm/dcm∶nh
3 1m meoh4∶1,从70/30至50/50),得到纯标题化合物(54mg,产率64%)。rt=1.98min(分析方法1);ms(esi)m/z:374.2[m-h]
+
,[m-h]
+
计算值:374.2。1h nmr(400mhz,dmso-d6)。δ9.25(s,1h),8.17-7.82(m,2h),7.69-7.37(m,5h),6.93(s,1h),6.83-6.66(m,2h),3.08(dt,j=12.2,3.4hz,2h),2.87(s,6h),2.77(tt,j=11.5,3.8hz,1h),2.66(td,j=12.1,2.6hz,2h),1.93(dd,j=13.4,3.5hz,2h),1.77(qd,j=13.0,12.5,4.0hz,2h)。
[0200]
实施例6.n-(4-甲氧基苯基)-6-苯基-2-(4-哌啶基)嘧啶-4-胺(化合物13)
[0201][0202]
步骤1.叔丁基4-[4-(4-甲氧基苯胺基)-6-苯基-嘧啶-2-基]-3,6-二氢-2h-吡啶-1-羧酸酯(中间体c.6)的合成。
[0203][0204]
按照前述一般步骤反应c,使用中间体b.2(80mg,0.26mmol)和4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-3,6-二氢-2h-吡啶-1-羧酸叔丁酯(98.1mg,0.31mmol)获得标题化合物。最终正相纯化(环己烷/acoet从95/5至75/25)得到纯标题化合物(104.7mg,产率89%)。rt=2.24min(分析方法2);ms(esi)m/z 459.3[m-h]
+
,[m-h]
+
计算值:459.2。1h nmr(400mhz,dmso-d6)δ9.44(s,1h),8.12-8.02(m,2h),7.68-7.60(m,2h),7.58-7.46(m,3h),7.17(s,1h),7.01(s,1h),6.99-6.92(m,2h),4.12(s,2h),3.75(s,3h),3.56(t,j=5.7hz,2h),2.68(q,j=4.0,3.4hz,2h),1.44(s,9h)。
[0205]
步骤2.n-(4-甲氧基苯基)-6-苯基-2-(1,2,3,6-四氢吡啶-4-基)嘧啶-4-胺(中间体d'.6)的合成。
[0206][0207]
按照一般步骤反应d'(80mg,产率99%),使用中间体c.6(102mg,0.22mmol)获得标题化合物。rt=0.60min(分析方法2);ms(esi)m/z:359.2[m-h]
+
,[m-h]
+
计算值:359.2。所得固体无需任何进一步纯化步骤即可用于下一步骤。
[0208]
步骤3.n-(4-甲氧基苯基)-6-苯基-2-(4-哌啶基)嘧啶-4-胺(化合物13)的合成。
[0209][0210]
按照先前描述的一般步骤反应e'方法1,使用中间体d'.6(80mg,0.22mmol)获得标题化合物。最终正相纯化(dcm/dcm∶nh
3 1m meoh4∶1,从85/15至50/50),得到纯标题化合物(52.5mg,产率64%)。rt=1.87min(分析方法1);ms(esi)m/z:361.3[m-h]
+
,[m-h]
+
计算值:361.2。1h nmr(400mhz,dmso-d6)。δ9.44(s,1h),8.14-7.89(m,2h),7.64(d,j=8.9hz,2h),7.58-7.38(m,3h),6.99(s,1h),6.96-6.91(m,2h),3.75(s,3h),3.13(d,j=12.4hz,2h),2.83(tt,j=11.4,3.8hz,1h),2.73(td,j=12.2,2.7hz,2h),1.97(dd,j=12.8,3.4hz,2h),1.81(qd,j=12.2,4.0hz,2h)。
[0211]
实施例7.n3,n3-二甲基-n1-[6-苯基-2-(4-哌啶基)嘧啶-4-基]苯-1,3-二胺(化合物14)
[0212][0213]
步骤1.叔丁基4-[4-[3-(二甲基氨基)苯胺基]-6-苯基-嘧啶-2-基]-3,6-二氢-2h-吡啶-1-羧酸酯(中间体c.7)的合成。
[0214][0215]
按照前述一般步骤反应c,使用中间体b.3(120mg,0.37mmol)和4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-3,6-二氢-2h-吡啶-1-羧酸叔丁酯(129.5mg,0.41mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至80/20)得到标题化合物(155.1mg,产率89%)。rt=2.48min(分析方法2);ms(esi)m/z 472.3[m-h]
+
,[m-h]
+
计算值:472.3。1h nmr(400mhz,dmso-d6)δ9.44(s,1h),8.17-7.95(m,2h),7.67-7.41(m,3h),7.31(s,1h),7.21(s,1h),7.14(t,j=8.1hz,1h),7.11(s,1h),7.03-6.93(m,1h),6.42(ddd,j=8.3,2.7,0.8hz,1h),4.11(s,2h),3.56(t,j=5.6hz,2h),2.93(s,6h),2.81-2.62(m,2h),1.44(s,9h)。
[0216]
步骤2.叔丁基4-[4-[3-(二甲基氨基)苯胺基]-6-苯基-嘧啶-2-基]哌啶-1-羧酸酯(中间体d.7)的合成。
[0217][0218]
按照前述一般步骤反应d方法1,使用中间体c.7(150mg,0.32mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至80/20)得到纯标题化合物(149mg,产率99%)。rt=2.30min(分析方法2);ms(esi)m/z:474.4[m-h]
+
,[m-h]
+
计算值:474.3。1h nmr(400mhz,dmso-d6)δ9.43(s,1h),8.08-7.94(m,2h),7.58-7.44(m,3h),7.40(s,1h),7.11(t,j=8.1hz,1h),7.06(s,1h),6.88(ddd,j=7.9,2.1,0.8hz,1h),6.41(ddd,j=8.4,2.5,0.8hz,1h),4.05(d,j=13.1hz,2h),1.98(dd,j=13.6,3.5hz,2h),2.95-2.87(m,9h),1.73(qd,j=12.5,4.2hz,2h),1.42(s,9h)。
[0219]
步骤3.n3,n3-二甲基-n1-[6-苯基-2-(4-哌啶基)嘧啶-4-基]苯-1,3-二胺(化合物14)的合成。
[0220][0221]
按照前述一般步骤反应e,使用中间体d.7(80mg,0.22mmol)获得标题化合物。最终正相纯化(dcm/dcm∶nh
3 1m meoh 4∶1,从95/5至60/40),得到纯标题化合物(39.6mg,产率
34%)。rt=1.97min(分析方法1);ms(esi)m/z:374.6[m-h]
+
,[m-h]
+
计算值:374.2。1h nmr(400mhz,dmso-d6)。δ9.42(s,1h),8.01(d,j=7.0hz,2h),7.51(d,j=7.0hz,3h),7.40(s,1h),7.12(t,j=8.1hz,1h),7.07(s,1h),6.94(d,j=8.0hz,1h),6.51-6.33(m,1h),3.03(d,j=11.9hz,2h),2.93(s,6h),2.85-2.70(m,1h),2.61(t,j=11.9hz,2h),2.00-1.85(m,2h),1.75(qd,j=12.3,4.3hz,2h)。
[0222]
实施例8.n-(3-甲氧基苯基)-6-苯基-2-(4-哌啶基)嘧啶-4-胺(化合物15)
[0223][0224]
步骤1.4-[4-(3-甲氧基苯胺基)-6-苯基-嘧啶-2-基]-3,6-二氢-2h-吡啶-1-羧酸叔丁酯(中间体c.8)的合成。
[0225][0226]
按照前述一般步骤反应c,使用中间体b.4(180mg,0.58mmol)和4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-3,6-二氢-2h-吡啶-1-羧酸叔丁酯(202.4mg,0.64mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至85/15)得到标题化合物(241.2mg,产率91%)。rt=2.31min(分析方法2);ms(esi)m/z 459.3[m-h]
+
,[m-h]
+
计算值:459.2。1h nmr(400mhz,dmso-d6)δ9.63(s,1h),8.19-8.03(m,2h),7.62-7.46(m,4h),7.33-7.22(m,2h),7.20(s,1h),7.11(s,1h),6.67-6.54(m,1h),4.13(d,j=3.3hz,2h),3.79(s,3h),3.57(t,j=5.7hz,2h),2.71(s,2h),1.44(s,9h)。
[0227]
步骤2.4-[4-(3-甲氧基苯胺基)-6-苯基-嘧啶-2-基]哌啶-1-羧酸叔丁酯(中间体d.8)的合成。
[0228][0229]
按照前述一般步骤反应d方法1,使用中间体c.8(240mg,0.52mmol)获得标题化合物。最终正相纯化(环己烷/acoet从100/0至80/20)得到纯标题化合物(120mg,产率50%)。rt=2.11min(分析方法2);ms(esi)m/z:461.4[m-h]
+
,[m-h]
+
计算值:461.2。1h nmr(400mhz,dmso-d6)δ9.61(s,1h),8.07-7.94(m,2h),7.63(t,j=2.2hz,1h),7.57-7.45(m,
3h),7.22(t,j=8.0hz,1h),7.17(dt,j=8.3,1.4hz,1h),7.08(s,1h),6.59(ddd,j=8.0,2.5,1.1hz,1h),4.12-3.96(m,2h),3.77(s,3h),2.93(tt,j=11.4,3.7hz,3h),2.06-1.95(m,2h),1.72(qd,j=12.4,4.2hz,2h),1.42(s,9h)。
[0230]
步骤3.n-(3-甲氧基苯基)-6-苯基-2-(4-哌啶基)嘧啶-4-胺(化合物15)的合成。
[0231][0232]
按照前述一般步骤反应e,使用中间体d.8(115mg,0.25mmol)获得标题化合物。最终正相纯化(dcm/dcm∶nh
3 1m meoh 4∶1,从95/5至50/50),得到纯标题化合物(80.1mg,产率89%)。rt=1.85min(分析方法1);ms(esi)m/z:361.6[m-h]
+
,[m-h]
+
计算值:361.2。1h nmr(400mhz,dmso-d6)。δ9.58(s,1h),8.13-7.92(m,2h),7.65(t,j=2.0hz,1h),7.59-7.39(m,3h),7.33-7.15(m,2h),7.07(s,1h),6.58(dt,j=7.2,2.3hz,1h),3.78(s,3h),3.04(dt,j=12.2,3.3hz,2h),2.80(tt,j=11.6,3.8hz,1h),2.61(td,j=12.1,2.5hz,2h),2.03-1.85(m,2h),1.74(qd,j=12.2,4.0hz,2h)。
[0233]
实施例9.n1,n1-二甲基-n4-(6-苯基-2-四氢吡喃-4-基-嘧啶-4-基)苯-1,4-二胺(化合物16)
[0234][0235]
步骤1.n1-[2-(3,6-二氢-2h-吡喃-4-基)-6-苯基-嘧啶-4-基]-n4,n4-二甲基-苯-1,4-二胺(中间体c.9)。
[0236][0237]
按照前述一般步骤反应c,使用中间体b.1(115mg,0.35mmol)和3,6-二氢-2h-吡喃-4-硼酸频哪醇酯(91.1mg,0.42mmol)获得标题化合物。最终正相纯化(环己烷/acoet从90/10至70/30)得到标题化合物(37.1mg,产率28%)。rt=1.70min(分析方法2);ms(esi)m/z 373.5[m-h]
+
,[m-h]
+
计算值:373.2。1h nmr(400mhz,dmso-d6)δ9.29(s,1h),8.03(dd,j=7.7,1.9hz,2h),7.58-7.43(m,5h),7.25-7.12(m,1h),6.96(s,1h),6.81-6.71(m,2h),4.32
(q,j=2.7hz,2h),3.83(t,j=5.4hz,2h),2.87(s,6h),2.71-2.58(m,2h)。
[0238]
步骤2.n4,n4-二甲基-n1-(6-苯基-2-四氢吡喃-4-基-嘧啶-4-基)苯-1,4-二胺(化合物16)。
[0239][0240]
按照前述一般步骤反应d方法2,使用中间体c.9(35mg,0.09mmol)获得标题化合物。最终正相纯化(环己烷/acoet从95/5至75/25)得到纯标题化合物(27mg,产率77%)。rt=1.48min(分析方法2);ms(esi)m/z:375.5[m-h]
+
,[m-h]
+
计算值:375.2。1h nmr(400mhz,dmso-d6)δ9.27(s,1h),8.05-7.91(m,2h),7.63-7.40(m,4h),6.93(s,1h),6.83-6.68(m,2h),3.96(dt,j=11.4,2.6hz,2h),3.48(td,j=11.1,3.5hz,2h),2.93(dq,j=10.7,5.8,5.3hz,1h),2.88(s,5h),1.96-1.77(m,4h)。
[0241]
实施例10.n-(4-甲氧基苯基)-6-苯基-2-四氢吡喃-4-基-嘧啶-4-胺(化合物17)
[0242][0243]
步骤1.2-(3,6-二氢-2h-吡喃-4-基)-n-(4-甲氧基苯基)-6-苯基-嘧啶-4-胺(中间体c.10)。
[0244][0245]
按照前述一般步骤c,使用中间体b.2(90mg,0.29mmol)和3,6-二氢-2h-吡喃-4-硼酸频哪醇酯(74.3mg,0.35mmol)获得标题化合物。最终正相纯化(环己烷/tbme从100/0至80/20)得到标题化合物(44.2mg,产率43%)。rt=1.54min(分析方法2);ms(esi)m/z 360.5[m-h]
+
,[m-h]
+
计算值:360.2。1h nmr(400mhz,dmso-d6)δ9.45(s,1h),8.12-8.01(m,2h),7.65(d,j=8.9hz,2h),7.57-7.45(m,5h),7.01(s,1h),6.98-6.92(m,1h),4.33(d,j=2.9hz,2h),3.76-3.72(m,5h),2.71-2.61(m,2h)。
[0246]
步骤2.n-(4-甲氧基苯基)-6-苯基-2-四氢吡喃-4-基-嘧啶-4-胺(化合物17)。
[0247]
按照前述一般步骤反应d方法2,使用中间体c.10(42mg,0.12mmol)
[0248][0249]
获得标题化合物。最终正相纯化(环己烷/tbme从90/10至70/30)得到纯标题化合物(16mg,产率38%)。rt=1.31min(分析方法2);ms(esi)m/z:362.5[m-h]
+
,[m-h]
+
计算值:362.2。1h nmr(400mhz,dmso-d6)δ9.43(s,1h),8.11-7.88(m,2h),7.63(d,j=8.5hz,2h),7.55-7.45(m,3h),6.98(s,1h),6.96-6.90(m,2h),3.96(ddd,j=11.3,4.2,2.3hz,2h),3.75(s,3h),3.47(td,j=11.3,3.0hz,2h),3.03-2.88(m,1h),1.98-1.77(m,4h)。
[0250]
细胞生存力测定
[0251]
将细胞以10,000细胞/孔接种在96孔板中并在37℃下用5%co2温育24小时。温育过夜后,单独用抑制剂(1.25-50μm)或用20μm的顺铂处理细胞24小时。根据制造商的说明书,使用cell titer-glo发光法细胞活力检测试剂盒(promega,madison,wi)测定细胞生存力(cell ciability)。使用dtx 800微板读数器(库尔特(coulter))测量发光。使用graphpad prism软件计算半最大抑制浓度(ic50)值。通过进行3个独立的实验进行测定。
[0252]
结果如表1所示
[0253]
表1
[0254]
[0255]
[0256]
[0257]
[0258]
[0259][0260]
流式细胞术分析细胞凋亡
[0261]
用抑制剂处理约1
×
106个黑色素瘤细胞24小时,然后用胰蛋白酶消化并用pbs洗涤,根据制造商的方案用alexa fluor-膜联蛋白(annexin)v和碘化丙啶(pi)(v13245;invitrogen)温育单细胞悬浮液;并进行流式细胞术分析。在所有情况下,基于前向散射和侧向散射分析来门控细胞碎片。使用flowjo(俄勒冈州亚什兰(ashland,or))分析数据。结果如图1所示,其中wm3248黑色素瘤细胞用指定剂量的化合物1(arn12405)处理,使用膜联蛋白(annexin)v和pi通过流式细胞术测量细胞凋亡。
[0262]
cdc42活性测定
[0263]
根据制造商的方案(cell biolabs,san diego,ca))进行cdc42活化测定。简言之,将用抑制剂处理的细胞裂解并加载gdp或gtpγs。只有当gtp结合时,与pak1 pbd结构域缀合的琼脂糖珠向下拉cdc42、rac或rhoj。然后用指示的abs免疫印迹裂解物。结果如图2所示。特别地,使用cdc42活化测定来确定抑制剂是否阻断rhoi与pak偶联珠相互作用的能力。简言之,用化合物1(arn12405)处理细胞,制备细胞裂解物,并与pak偶联的珠温育。将免疫沉淀的蛋白质进行sds page并用(a)rhoj抗体,(b)cdc42抗体,(c)rac1抗体,(d)细胞免疫印迹,该细胞用浓度为10μm或50μm的rhoj相互作用抑制剂组之一处理细胞(参见图2,a-d组)。制备裂解物,与pak偶联的珠温育,用rhoj抗体免疫印迹免疫沉淀的蛋白质。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



