启动子pNtab3450及其表达载体和应用的制作方法
 2021-02-01 23:02:38|
2021-02-01 23:02:38| 405|
405| 起点商标网
起点商标网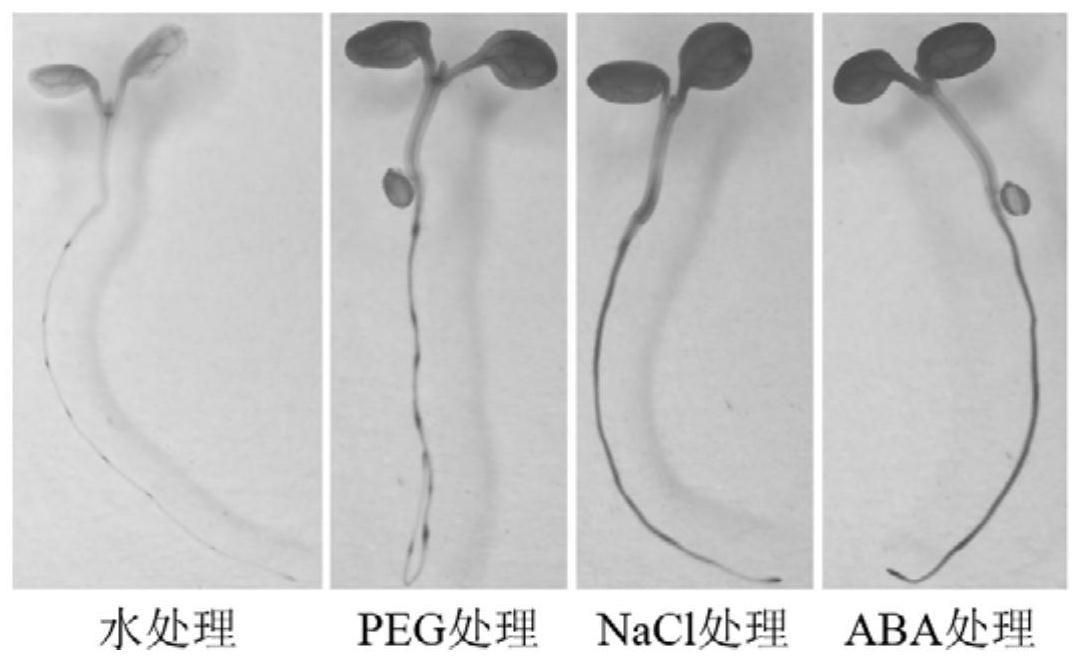
启动子pntab3450及其表达载体和应用
技术领域
[0001]
本发明属于基因工程领域,尤其涉及一种启动子pntab3450及其表达载体和应用,尤其是在培育抗干旱和/或耐高盐的转基因植物中的应用。
背景技术:
[0002]
启动子通过与一种或多种转录因子结合而调控基因的表达,其可分为组成型和诱导型两类。根据诱导因素的差别,启动子又可分为生物诱导型和非生物诱导型两类,其中,非生物启动子又可分为干旱、盐、低温、高温和化学试剂诱导型等多种类型,这些启动子通常在受到相关理化因素作用时才会启动或增强下游基因转录。因此,利用启动子可以实现在特定组织、发育阶段或特殊环境条件下表达目的基因的目的,具有巨大的应用前景。
[0003]
近年来,对水稻、玉米、小麦等主要农作物启动子的报道逐渐增加,体现了人们对越来越严重的环境胁迫的重视。随着启动子研究的深入,启动子中一些响应环境胁迫的顺式作用元件也陆续被鉴定出来。如响应干旱的元件dre(a/gccgac)元件和响应低温的cbf(ccgac)元件、受干旱和盐胁迫显著诱导的abre(acgtgg/t)元件等,为启动子的鉴定提供了理论基础。
[0004]
烟草是我国主要的经济作物之一。随着现代农业栽培技术的发展,一些经济作物如花卉、蔬菜、水果的种植面积逐年增加,烟草作为比较经济效益相对低下的作物渐渐向丘陵与山区等干旱地区集中,有限的耕地和季节性干旱严重制约了烟草的种植和发展。然而,当前主栽烟草品种由于持续种植和不良的栽培措施,抗逆性不断下降。因此,从烟草中鉴定受干旱诱导的启动子可为培育耐旱烟草品种提供思路和策略,具有重要的应用前景。
技术实现要素:
[0005]
本发明提供了一种启动子pntab3450及其表达载体和应用,该启动子pntab3450可有效增强抗逆基因在干旱和/或高盐处理条件下的表达水平,使得在烟草基因工程育种中具有重要的应用价值。
[0006]
为了达到上述目的,本发明提供了一种启动子pntab3450,所述启动子pntab3450由1500个核苷酸组成,其序列任选自如下(a)、(b)或(c)所述的序列之一:
[0007]
(a)序列表seq id no:1所示的核苷酸序列;
[0008]
(b)与序列表seq id no:1具有75%以上一致性,且具有启动子功能的核苷酸序列;
[0009]
(c)在高严谨条件下与(a)或(b)所述的核苷酸序列杂交且具有启动子功能的核苷酸序列。
[0010]
作为优选,所述(b)为与序列表seq id no:1具有95%以上同源性,且具有启动子功能的核苷酸序列。
[0011]
作为优选,所述的诱导为干旱、高盐和/或aba的诱导。
[0012]
本发明还提供了一种表达载体,它是在植物表达载体中插入了如权利要求1所述
的如seq id no:1所示的核苷酸序列。
[0013]
作为优选,所述的植物表达载体为pbi101。
[0014]
本发明还提供了一种如上述技术方案所述的启动子pntab3450在以干旱和/或高盐为选择压力的选择标记方面的应用。
[0015]
本发明还提供了一种如上述技术方案所述的启动子pntab3450在培育抗干旱和/或耐高盐的转基因植物的应用,所述的植物为烟草。
[0016]
本发明还提供了一种提取、扩增如上述技术方案所述的启动子pntab3450的pcr方法,包括以下步骤:
[0017]
1)提取烟草品种的基因组dna;
[0018]
2)以烟草品种的基因组dna为模板,使用引物,利用高保真酶fastpfu fly dna,扩增启动子pntab3450;
[0019]
其中:pcr反应体系为:模板基因组dna2μl,正向引物1μl,反向引物1μl,5
×
fly buffer 10μl,dntp mix 10μl,pfu fly 2μl,ddh2o 24μl,总体积50μl。
[0020]
作为优选,扩增程序为:95℃3min;95℃15s,55℃15s,72℃2min,35个pcr循环,72℃10min。
[0021]
作为优选,所述引物对为:
[0022]
正向引物:5
’-
tctagacatttctgtgatttgttt-3
’
;
[0023]
反向引物:5
’-
tctagatttgttacttattgattgta-3
’
。
[0024]
与现有技术相比,本发明的优点和积极效果在于:
[0025]
在当前抗逆育种中缺少理想的启动子的背景下,本发明为烟草基因功能研究和基因工程育种提供了有效的诱导型强启动子,并可以将其用于培育抗逆的植物品种中,实现了明显增强抗逆基因在干旱、高盐和/或aba的处理条件下的表达水平的目的,在烟草基因工程育种中具有重要的应用价值和很好的开发前景。
附图说明
[0026]
图1为启动子pntab3450 pcr扩增产物的电泳图,其中:m为分子量marker,另一泳道为启动子pntab3450 dna;
[0027]
图2为启动子pntab3450与gus报告基因连接示意图;
[0028]
图3为启动子-gus转基因拟南芥在聚乙二醇/peg(代表干旱)、nacl(代表高盐)和aba处理前后叶片中gus酶活的染色对比图;
[0029]
图4为启动子-gus转基因拟南芥在聚乙二醇/peg、nacl和aba处理前后叶片中gus酶活性的定量测定;
[0030]
图5为启动子顺式作用元件的分布示意图;
[0031]
图6为烟草启动子驱动膨胀素基因表达促进植株生长发育的示意图;
[0032]
图7为烟草启动子驱动膨胀素基因表达提高植物抗旱性和耐盐性的示意图;
[0033]
图8为烟草启动子驱动膨胀素基因表达下盐胁迫/干旱胁迫后种子发芽率/存活率示意图。
具体实施方式
[0034]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0035]
实施例1烟草启动子pntab3450的获得
[0036]
烟草启动子pntab3450的克隆,包括以下步骤:
[0037]
1)提取普通烟草品种k326基因组的dna(提取方法为本领域所公知,此处不再赘述);
[0038]
2)利用全式金生物公司生产的fastpfu fly dna高保真酶,并设计用于后续pcr扩增的引物,该引物为:
[0039]
正向引物(seq id no:2):5
’-
tctagacatttctgtgatttgttt-3
’
;
[0040]
反向引物(seq id no:3):5
’-
tctagatttgttacttattgattgta-3
’
;
[0041]
其中,便于后续的启动子克隆,上述正向引物5
’
末端添加tctaga,反向引物5
’
末端添加tctaga;
[0042]
3)以1)项下提取的dna为模板进行pcr扩增,反应体系如下所示:
[0043]
pcr反应体系:模板基因组dna2μl,正向引物1μl,反向引物1μl,5
×
fly buffer 10μl,dntp mix 10μl,pfu fly 2μl,ddh2o 24μl,总体积50μl。
[0044]
pcr反应程序:95℃3min;95℃15s,55℃15s,72℃2min,35个pcr循环,72℃10min。pcr反应结束后,对扩增产物进行琼脂糖凝胶电泳。
[0045]
4)电泳结束后,利用全式金公司生产的dna片段回收试剂盒(pcr purification kit)回收目的条带,凝胶回收具体步骤参见其说明书。
[0046]
5)将回收的目的条带通过酶切连接的方法连接到双元载体pbi101载体,连接产物转化大肠杆菌感受态细胞dh5α。采用热击转化的方法,将构建好的载体5μl加入到50μl感受态细胞中,冰置30min,42℃热击30s,冰置5min后加入500μl液体lb培养基活化菌体,最后均匀涂布于含有50mg/l卡那霉素的固体lb培养基上,置37℃培养8-10h。待长出单菌落后,采用pcr及测序的方法鉴定阳性克隆,以确保启动子的正确性。
[0047]
如图1所示,所获得的启动子由1500个核苷酸组成,其序列如seq id no:1所示。
[0048]
实施例2烟草启动子pntab3450的表达载体构建和农杆菌转化
[0049]
目的是获得启动子pntab3450驱动葡萄糖苷酸酶报告基因(gus)表达的载体,同时获得含有该载体的农杆菌,为后续的转化做准备,如图2所示。
[0050]
1)将获得的pcr纯化产物及载体利用xbai限制性内切酶进行酶切处理。酶切反应体系为:dna20μl,5
×
buffer 10μl,xbai 5μl,ddh2o 15μl,总体积50μl。酶切反应条件为:37℃30min,85℃5s。酶切完成后,利用全式金公司生产的dna片段回收试剂盒(pcr purification kit)回收dna片段,凝胶回收具体步骤参见其说明书。
[0051]
2)将获得的酶切后的启动子片段与载体进行连接(使用thermo fisher scientific公司的t4 dna连接酶,连接体系参照公司说明书)。将连接反应体系轻轻混匀,16℃反应8-10h,随后将连接产物直接用于转化大肠杆菌。
[0052]
3)大肠杆菌的转化。采用热击转化的方法,将构建好的载体5μl加入到50μl感受态细胞中,冰置30min,42℃热击30s,冰置5min后加入500μl液体lb培养基并于37℃活化菌体1h,最后均匀涂布于含有50mg/l卡那霉素的固体lb培养基上,置37℃培养8-10h。待长出单菌落后,采用pcr及测序的方法鉴定阳性克隆,确认大肠杆菌中含有构建正确的启动子-gus表达载体。
[0053]
4)农杆菌的转化。农杆菌gv3101具有侵染植物和转移基因的能力,故需要将构建的启动子-gus表达载体转入农杆菌。将测序正确的载体采用冻融的方法转化农杆菌感受态gv3101。将5μl载体加入到50μl感受态细胞中,混匀后冰置5min。液氮中处理5min,再冰置5min后加入500μl液体lb培养基,28℃培养2h后均匀涂布于含有50mg/l卡那霉素和潮霉素的固体lb培养基上,放置28℃培养2-3d。待长出单菌落后,采用pcr及测序的方法鉴定阳性克隆,以确定启动子-gus表达载体转入了农杆菌gv3101。
[0054]
实施例3启动子pntab3450转化拟南芥验证其受干旱、高盐和aba的强烈诱导
[0055]
目的是将启动子-gus表达载体转入拟南芥哥伦比亚生态型,获得阳性转基因植物,用于验证启动子是否能够被逆境环境条件诱导。
[0056]
1)利用沾花方法,菌液准备方法:将转化好的gv3101过夜培养至od600=1.0,5000rpm离心10min并用5%蔗糖溶液冲悬浮。将拟南芥盛开的花充分浸入菌液中,放置黑暗24h,置于正常光周期中让其结实。利用75%的酒精对种子进行消毒后均匀铺在含有50mg/ml卡那霉素的1/2ms固体培养基上,于22℃培养14d,筛选阳性苗。筛选标准:苗生长发育正常,叶色持绿不黄化、根系发达。最后利用pcr的方法确定启动子-gus表达片段转入了拟南芥。
[0057]
2)为了分析启动子pntab3450对逆境胁迫的响应情况,对启动子-gus转基因拟南芥进行了多种多样的胁迫处理。具体做法是:将转基因的拟南芥种子平铺在1/2ms培养基上,4℃培养3d后转移至光照培养箱。发芽后第7天,取幼苗分成4组,分别进行处理,每组设置3个生物学重复。其中,对照组加h2o处理3h;干旱处理利用peg模拟,将幼苗用15%peg6000处理3h;盐胁迫处理采用75mm nacl处理3h;激素处理采用50μm aba处理3h。
[0058]
胁迫处理条件设置为:在1/2ms培养基中分别添加h2o、15%peg6000、75mm nacl和50μm aba处理幼苗3h,处理结束后随即分别取材进行gus染色。
[0059]
3)gus染色的具体做法是:将植物材料放入离心管中,倒入冰预冷的90%丙酮没过植物材料,插到冰上放置30min。用现配的gus染色缓冲液(公知的配方)清洗材料,置于冰上20分钟,倒掉缓冲液再加入新的缓冲液重复洗一次,再倒掉染色缓冲液。倒入配好的染色液(染色缓冲液中加入终浓度为2mm的x-gluc),保证植物材料完全没入其中。根据染色情况在37℃温箱中染色6-12h。75%乙醇清洗材料,去除染色液,倒入无水乙醇浸泡材料直至完全脱色。实体解剖显微镜下观察并拍照。
[0060]
4)gus酶活性的荧光定量分析:取新鲜染色的植物组织100mg左右,用液氮将生物材料急速冷冻,然后采用液氮研磨的方式在研钵里磨碎组织。将研磨破碎的组织转到ep管里,并立即加入1ml gus提取缓冲液,充分混匀后12000rpm,4℃离心5min。将上清转至另一洁净的ep管,冰上放置待用。采用bradford法测定蛋白浓度。标准曲线制作:取7个ep管,分别加入0μl、2μl、4μl、8μl、12μl、16μl、20μl的bsa标准液,用水补至相同体积20μl。加入980μl考马斯亮蓝g250溶液,充分混匀,冰上静置5min,用紫外分光光度计测定595nm处的吸收
值,以蛋白浓度(mg/ml)对吸收值a595做标准曲线。将测蛋白样品10μl,加入10μl h2o,加入980μl考马斯亮蓝g250溶液,充分混匀,冰上静置5min。用紫外分光光度计测定595nm处的吸收值,代入公式计算样品蛋白浓度。gus表达水平的定量测定:取100μl蛋白上清,加入400μl 37℃预热的gus提取缓冲液里,再加入500μl mug底物,37℃温浴。在0min、15min、30min、45min和60min分别取混合反应物200ul加入到800ul反应终止液,用荧光分光光度计在激发波长365nm、发射波长455nm下,狭缝10nm时测定不同时间点的荧光强度值。以荧光强度值对反应时间作曲线,求出单位时间的荧光强度变化。最后用单位时间的荧光强度变化除以参加反应的蛋白量,计算单位质量的蛋白单位时间的荧光强度变化。
[0061]
上述gus染色和gus酶活性测定结果表明(如图3和图4所示),启动子pntab3450是一个受高盐、干旱以及aba强烈诱导的启动子,且对胁迫极为敏感。在图3中,启动子收到诱导后表达越高,gus染色后组织着色越深,在图3中表现深黑色,而对照是浅灰色。相应的,图4中gus活性测定结果显示,诱导后gus活性较对照显著提高(p<0.05,t检验)。
[0062]
实施例4启动子的顺式作用元件分析
[0063]
利用plantcare在线软件对实施例1项下得到的启动子序列进行顺式作用元件分析,发现其含有多个应答干旱、高盐和水淹等环境胁迫及响应植物激素的元件(如图5所示)。包括响应干旱的myc、myb和abre元件、响应高盐的gt-1元件、响应aba的abre元件和响应水杨酸的sare元件等。可以理解的是,该启动子序列中以myc、myb、abre、gt-1、abre、sare为诱导型顺式元件,每个元件串联重复约2次,两元件中间以30-100个碱基的随机序列间隔,命名为pntab3450。
[0064]
实施例5启动子驱动膨胀素基因表达提高转基因植株的生长势和抗逆性
[0065]
在构建好的pbi101载体的启动子后、gus基因前插入烟草膨胀素基因(如seq id no:4所示),以让该启动子驱动膨胀素基因表达。方法如下:烟草膨胀素基因序列在普通烟草品种k326基因组dna扩增获得。将前面所述的启动子-gus载体和pcr扩增得到的烟草膨胀素基因序列利用bamhi限制酶切,利用全式金公司生产的dna片段回收试剂盒(pcr purification kit)回收目的条带,凝胶回收具体步骤参见其说明书。将获得的酶切后的基因片段与线性化的载体进行连接(使用thermo fisher scientific公司的t4 dna连接酶,连接体系参照公司说明书)。随后采用热击转化的方法将连接产物直接用于转化大肠杆菌,并在含有50mg/l卡那霉素的固体lb培养基上筛选阳性克隆。待长出单菌落后,采用pcr及测序的方法确认大肠杆菌中含有构建正确的启动子-基因表达载体。农杆菌lba4404具有侵染烟草和转移基因的能力,故需要将构建的启动子-基因表达载体转入农杆菌。采用冻融的方法将构建好的启动子-基因表达载体转化农杆菌感受态细胞,利用农杆菌菌株lba4404介导的叶盘转化法将该启动子-基因表达载体转入烟草品种k326,通过筛选标记获得了26株转基因阳性植株。与野生型的k326相比,转基因植株生长势加强(图6)。
[0066]
再分别利用干旱和高盐胁迫处理转基因植株幼苗或成株,其中干旱处理方法:将土壤种植的1月大小的烟草幼苗一次性交足水后干旱处理30d,复水1周后统计存活的幼苗的数量;高盐胁迫处理的方法:将烟草种子播撒在分别含有h2o、100mm nacl、150mm nacl的1/2ms培养基上,培养10d后统计种子发芽率。结果表明,在该启动子的驱动下,膨胀素基因受逆境诱导表达后,能显著提高转基因植株的发芽率和存活率(图7)。在100mm nacl胁迫下,转基因植株种子发芽率较对照提高了15%-25%;在150mm nacl胁迫下,转基因植株种
子发芽率较对照提高了约50%;在干旱胁迫条件下,2个转基因株系幼苗的存活率较对照品种k326分别提高了约40%和28%(图8)。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



