一种制备细菌纳米抗原的方法及其应用与流程
 2021-02-01 23:02:23|
2021-02-01 23:02:23| 410|
410| 起点商标网
起点商标网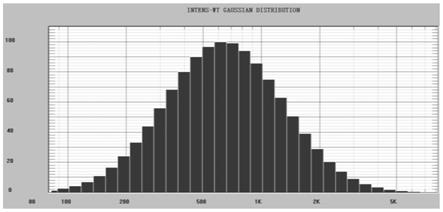
[0001]
本发明涉及到生物制品领域,具体涉及一种制备细菌纳米抗原的方法及其应用。
背景技术:
[0002]
现有技术中制备纳米抗原需要用到昂贵的仪器,比如高压匀浆机,成本较高。
[0003]
目前,世界范围内控制细菌性奶牛乳腺炎的手段仍然是抗生素治疗,不仅加速了细菌耐药性的产生,也给食品安全造成威胁。奶牛乳腺炎是奶牛最常发病,治疗费用最高的疾病。世界奶牛协会统计,全世界约有1/3奶牛患有乳腺炎,导致牛奶产量和质量下降,造成巨大经济损失。在我国,每年由于奶牛乳腺炎造成的直接经济损失达30亿人民币。
[0004]
随着绿色养殖方式的推进,抗生素的使用正逐步减少。疫苗免疫重新成为防控细菌性奶牛乳腺炎的首选措施。但是,现有细菌灭活疫苗仅能触发体液免疫,且抗体滴度低、持续期短,不能提供有效的免疫保护。
技术实现要素:
[0005]
本发明的主要目的是提供一种制备细菌纳米抗原的方法,该方法能够大量制备细菌纳米抗原,抗原粒径显著缩小,且成本较低。
[0006]
本发明的另一目的是提供一种疫苗,含有所述方法制备的细菌纳米抗原。
[0007]
本发明的再一目的是提供一种金黄色葡萄球菌疫苗,该疫苗免疫后,显著提高了小鼠血清抗体水平和攻毒后小鼠的存活率。
[0008]
本发明的目的采用如下技术方案实现:一种制备细菌纳米抗原的方法,包括将所述细菌和金刚砂同时进行超声破碎的步骤。
[0009]
优选的技术方案中,所述细菌为金黄色葡萄球菌atcc29213。
[0010]
优选的技术方案中,所述金刚砂为500-700目。
[0011]
优选的技术方案中,所述超声破碎的次数为2-4次,每次超声破碎的条件为:工作功率为600-700w,超声3s,间歇7s,工作20分钟。
[0012]
优选的技术方案中,所述超声破碎使用的超声破碎仪的功率是900-1000w。
[0013]
优选的技术方案中,所述细菌采用超声破碎后收获沉淀再和金刚砂同时进行超声破碎。
[0014]
优选的技术方案中,通过沉淀或低速离心分离去除金刚砂。
[0015]
本发明还提供一种细菌疫苗,含有所述细菌纳米抗原。
[0016]
本发明还提供金黄色葡萄球菌疫苗,含有所述金黄色葡萄球菌atcc29213纳米抗原。
[0017]
与现有技术相比, 本发明细菌纳米抗原的制备方法,所用仪器要求较低,仅采用超声破碎方法即可大量制备纳米抗原,显著降低了抗原制备成本,易于大规模生产和推广。采用本发明方法制备的金黄色葡萄球菌疫苗,显著提高了小鼠血清抗体水平和攻毒后小鼠的存活率。
附图说明
[0018]
图1是纳米粒度仪pss nicomp z3000检测抗原a粒子粒径高斯分布图,横坐标代表粒子直径,单位为nm,纵坐标代表相对体积,单位是%。
[0019]
图2是纳米粒度仪pss nicomp z3000检测抗原b粒子粒径高斯分布图,横坐标代表粒子直径,单位为nm,纵坐标代表相对体积,单位是%。
[0020]
图3是纳米粒度仪pss nicomp z3000检测抗原c粒子粒径高斯分布图,横坐标代表粒子直径,单位为nm,纵坐标代表相对体积,单位是%。
[0021]
图4是纳米粒度仪pss nicomp z3000检测抗原d粒子粒径高斯分布图,横坐标代表粒子直径,单位为nm,纵坐标代表相对体积,单位是%。
[0022]
图5是纳米粒度仪pss nicomp z3000检测抗原a、b、c、d粒径平均值柱状图,横坐标代表四组抗原,纵坐标代表粒径平均值。
[0023]
图6显示了各组小鼠采用金黄色葡萄球菌atcc29213攻毒后小鼠存活率,横坐标代表攻毒后观察天数,纵坐标代表小鼠存活率。
[0024]
图7显示了各组小鼠血清按照稀释度为1:6400稀释后elisa检测所得
△
od值平均值,横坐标为第一次免疫后小鼠眼眶采血时间,纵坐标为
△
od平均值,代表血清中抗体效价。
具体实施方式
[0025]
实施案例1制备金黄色葡萄球菌抗原采用如下方法制备金黄色葡萄球菌纳米抗原:(1)将致奶牛乳腺炎的金黄色葡萄球菌atcc29213(购自美国菌种保藏中心)采用种子液(购买自美国模式培养物集存库atcc)发酵培养16h,发酵结束后,应用平板计数法,对发酵液中金黄色葡萄球菌atcc29213进行计数。将发酵液通过5000
×
g离心30min左右,收集菌体。
[0026]
(2)取步骤(1)收集到的菌体,用无菌pbs缓冲液洗涤3次,每次洗涤的方法如下:将菌体重悬于其质量50倍的无菌pbs缓冲液(是含有8mm na2hpo4、0.136m nacl、2mm kh2po4和2.6mm kcl的水溶液)中,利用斡旋仪使菌体均匀分散在pbs缓冲液中然后在5000
×
g离心30min,收集菌体。
[0027]
(3)将步骤(2)所得洗涤后的菌体采用超声破碎,得到菌体裂解液。具体方法如下:将菌体重悬于菌体质量50倍的无菌pbs缓冲液(是含有8mm na2hpo4、0.136m nacl、2mm kh2po4和 2.6mm kcl的水溶液)中,然后置于超声破碎仪(宁波新芝超声波细胞粉碎机,jy92-iidn,φ15mm变幅杆,最大功率为950w,工作功率可为最大功率的1%-99%)中进行破碎,设置破碎仪参数:工作功率为最大功率的70%,超声3s,间歇7s,工作20分钟。
[0028]
(4)将步骤(3)所得菌体裂解液在8000
×
g离心30min,收集沉淀,用无菌pbs缓冲液洗涤1次,洗涤方法如(2)。
[0029]
(5)在步骤(4)所得洗涤后的沉淀中,加入破碎前菌体质量5%的600目金刚砂,并根据步骤(1)中计数所得金黄色葡萄球菌atcc29213活菌浓度,加入pbs缓冲液(是含有8mm na2hpo4, 0.136m nacl, 2mm kh2po4和 2.6mm kcl的水溶液)调整浓度至2
×
10
11
cfu/ml,充分振荡混匀。
[0030]
(6)将步骤(5)所得混合物采用超声破碎仪(宁波新芝超声波细胞粉碎机,jy92-iidn,φ15mm变幅杆,最大功率为950w,工作功率可为最大功率的1%-99%)破碎3次,得到菌体裂解液。相邻两次破碎之间间隔5min,每次破碎后将溶液置于冰浴中降温。每次超声破碎仪破碎的操作参数如下:工作功率为最大功率的70%,超声3s,间歇7s,工作15分钟。
[0031]
(7)将步骤(6)所得菌体裂解液在4℃静置16h,以沉淀金刚砂,然后取上清液到无菌离心管中,100
×
g离心60min,弃掉沉淀,收集上清,得到金黄色葡萄球菌纳米抗原,添加终浓度(体积百分浓度)为0.3%的甲醛灭活,记为抗原c。
[0032]
分别制备对照抗原,包括抗原a、b和d。
[0033]
抗原a采用如下方法制备:按照抗原c制备过程中的步骤(1),从发酵液中收集菌体,然后将收集到的菌体采用pbs缓冲液重悬,添加终浓度(体积百分浓度)为0.3%的甲醛灭活细菌,得到抗原a。
[0034]
抗原b采用如下方法制备:按照抗原c制备过程中的步骤(1)-(4)进行操作,将得到的洗涤后的沉淀采用pbs缓冲液(是含有8mm na2hpo4, 0.136m nacl, 2mm kh2po4和 2.6mm kcl的水溶液)重悬,添加终浓度(体积百分浓度)为0.3%的甲醛灭活,获得抗原b。
[0035]
抗原d的制备方法如下:按照抗原c制备方法制备抗原d,不同之处仅在于省略其中的步骤(5),即第二次超声破碎时,不加入金刚砂。
[0036]
应用纳米粒度电位仪pss nicomp z3000检测上述所得抗原a、b、c和d的粒径。结果如图1-5。抗原a平均粒径820nm,抗原b平均粒径660nm,抗原c平均粒径347nm,抗原d平均粒径599nm。抗原d在没有金刚砂辅助时进行二次破碎抗原粒径大小有所减小,但不显著。
[0037]
实施案例2金黄色葡萄球菌纳米抗原疫苗制备及其保护效果1、疫苗制备将实施例1制备的抗原a、b、c和d分别与白油佐剂(购自河南通商进出口有限公司)按照1:3体积比混合,在搅拌转速为3000r/min条件下,搅拌10min,分别得到疫苗a、b、c和d。抗原编号与疫苗编号一致,且各疫苗中抗原浓度均为5
×
109cfu/ml,4℃保存。按照《中国兽药典》方法(附录:无菌检验)进行质检,质检合格后进行动物实验。
[0038]
2、分组和免疫将100只4周龄spf雌性小鼠,随机分为5组(第一至第五组),20只/组。第一组免疫疫苗a,第二组免疫疫苗b。第三组免疫疫苗c,第四组免疫疫苗d,第五组免疫pbs缓冲液。具体见表1。
[0039]
表1 小鼠分组及接种疫苗各疫苗的免疫方法均如下:免疫前,各小鼠眼底静脉采血100ul,收集阴性血清。各组小鼠均免疫三次,相邻两次免疫之间间隔两周。每次免疫方法均如下:每只小鼠经背部皮下免
疫200ul疫苗,即免疫剂量为1
×
109cfu/ml/只。第三次免疫后两周,用金黄色葡萄球菌atcc29213进行攻毒,攻毒剂量为107cfu/只。观察小鼠精神、被毛、死亡等症状,连续观察10天。
[0040]
3.结果结果如图6。攻毒后10天,第一组小鼠存活率为10%,第二组小鼠存活率为35%,第三组小鼠存活率为90%,第四组小鼠存活率为35%,第五组小鼠全部死亡。
[0041]
实施例3实施例2中的小鼠初次免疫后,每隔7天通过眼底静脉采血,收集静脉血并置于37℃培养箱中静置1h,再置于4℃放置12h析出血清,然后在4℃、800
×
g条件下,低速离心10min,收集血清。采用如下方法检测血清抗体效价:(1)在营养肉汤琼脂平板上挑取过夜培养的金黄色葡萄球菌atcc29213的单菌落,置于营养肉汤液体培养基中,在37℃、180rpm摇床中培养6h,然后按照接种量为1%转接到50ml的lb培养基中,在37℃、180rpm摇床中培养12h。
[0042]
(2)收集菌液,在10000rpm离心5min,取沉淀用 无菌pbs缓冲液洗涤3次,最后用ddh2o重悬,加入终浓度(体积百分浓度)为0.3%的甲醛在37℃灭活24-48h,灭活后涂lb平板检测灭活效率。
[0043]
(3)将灭活的菌体离心去甲醛,ddh2o洗涤3次,取沉淀,用包被液(0.05m碳酸盐缓冲液,ph=9.6)重悬菌体调整其终浓度1
×
108cfu/ml,得到标准抗原液。
[0044]
(4)将标准抗原液按照100 ul/孔,加入96孔聚苯乙烯酶标板,4℃包被过夜。
[0045]
(5)将酶标板甩干,pbst(是含有8mm na2hpo4、0.136m nacl、2mm kh2po4、2.6mm kcl和0.05%(体积百分浓度)吐温-20的水溶液)洗涤3次,干燥后得到elisa包被板。每次洗涤方法如下:每孔加入250 ul的pbst,洗涤3分钟,甩干。elisa包被板在4℃保存备用。
[0046]
(6)在elisa包被板上,每孔加入1%(质量百分浓度)牛血清白蛋白(bsa)水溶液100 ul,37℃封闭2h(或者4℃过夜),甩干后pbst洗涤3次,方法同前。
[0047]
(7)用pbs缓冲液(是含有8mm na2hpo4、0.136m nacl、 2mm kh2po4和 2.6mm kcl的水溶液)对小鼠血清按照二倍倍比稀释至稀释度为1:12800,每孔分别加入100 ul血清稀释液,37℃作用2h,甩干后pbst洗涤3次。
[0048]
(8)采用ph7.6的pbs缓冲液按照稀释度为1:10000稀释辣根过氧化物酶标记的羊抗鼠igg二抗(购自jackson,产品编号115-035-003 ),然后每孔加入100ul辣根过氧化物酶标记的羊抗鼠igg二抗稀释液,37℃作用2h,甩干后pbst洗涤3次;每孔加入100 ul的tmb显色液(索莱宝pr1200)避光显色30min;最后加入终止液(1m的h2so4水溶液),100 ul/孔,通过酶标仪测定各孔中样品在450纳米下的吸光值od
450
,同时检测各孔样品在650纳米下的吸光值od
650
作为背景值,各组样品
△
od= od
450-od
650,
代表血清中抗体效价。
[0049]
结果如图7所示。第三组小鼠在第三次免疫疫苗c后,抗体效价显著升高,血清按照稀释度为1:6400稀释后,elisa检测所得od值最高达到1.9;疫苗d中抗原在经过二次超声破碎后,其刺激机体产生的抗体效价没有明显的增加,初次免疫后35天和42天血清,按照稀释度为1:6400稀释后,elisa检测所得od值分别为1.18和1.28。没有经过破碎的抗原a,免疫后小鼠血清按照稀释度为1:6400稀释后,elisa检测所得od值仅为0.62。因此,抗原c制备的疫苗在二次免疫后(尤其三免后)可以刺激机体产生更高的抗体效价,说明抗原粒径减小后更
有利于激活机体体液免疫反应。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



