用于生产光学纯1,3-丁二醇的重组菌及其应用的制作方法
 2021-02-01 23:02:07|
2021-02-01 23:02:07| 301|
301| 起点商标网
起点商标网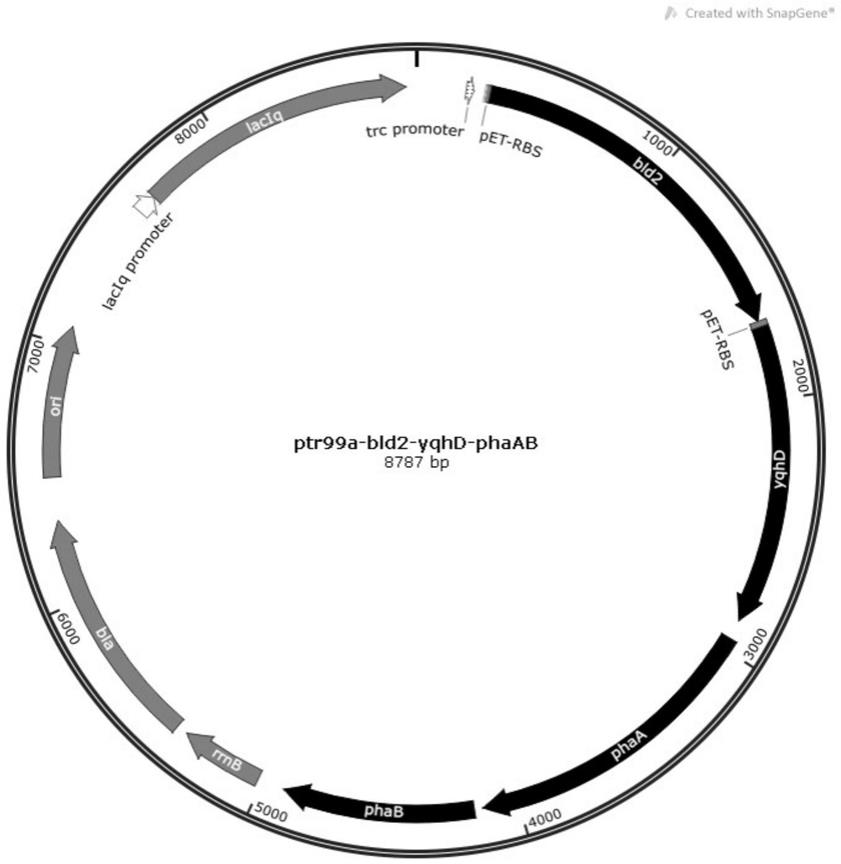
[0001]
本发明属于生物化工技术领域,具体地说,涉及一种用于生产光学纯1,3-丁二醇的重组菌及其应用。
背景技术:
[0002]
1,3-丁二醇是一种具有重要工业应用价值的二元醇,其可以被用作化妆品的溶剂,同时可以用作单体来合成聚酯、聚氨酯及生物增塑剂。同时光学纯的1,3-丁二醇可以用作医药中间体来合成许多药物。但是化学法合成的1,3-丁二醇都是外消旋体,无法直接用作医药中间体。因此,利用生物法生产光学纯1,3-丁二醇具有重要应用价值。
[0003]
cn201610481598.x和cn201080029715.x分别公开了两种1,3-丁二醇的生产方法,其主要是在厌氧条件下表达至少一种编码以足够的量表达的1,3-bdo通路酶的外源性核酸,以生产1,3-丁二醇。但该过程的生产效率低,1,3-丁二醇的最高产量低于2mm,不具有工业可行性。
技术实现要素:
[0004]
本发明的目的是提供一种用于生产光学纯1,3-丁二醇的重组菌及其应用。
[0005]
本发明构思如下:提供一种重组大肠杆菌,其是通过上调大肠杆菌的pntab基因并同时下调stha基因从而极大提高细胞内的nadph基因以满足1,3-丁二醇合成途径所需要的还原力nadph,从而提高1,3-丁二醇的产量。本发明同时通过酶的设计构建了clostridium saccharoperbutylacetonicum的丁醛脱氢酶突变体,其是将丁醛脱氢酶第273位亮氨酸突变为苏氨酸而成,在大肠杆菌中表达该突变体可以极大提高1,3-丁二醇的产量。本发明同时通过敲除adhe基因,ldha基因,pta基因,acka基因提高了乙酰-coa流向1,3-丁二醇合成途径的代谢通量,进一步提高了1,3-丁二醇的产量。
[0006]
为了实现本发明目的,第一方面,本发明提供一种用于生产光学纯1,3-丁二醇的重组菌,所述重组菌是将phaa、phab、bld和yqhd基因通过质粒导入微生物中或通过基因工程手段整合到微生物染色体上而成。
[0007]
其中,所述phaa基因为乙酰coa酰基转移酶基因,来源于cupriavidus necator,其为编码如下蛋白质(a)或(b)的基因:
[0008]
(a)由seq id no:3所示的氨基酸序列组成的蛋白质;
[0009]
(b)seq id no:3所示序列经取代、缺失或添加一个或几个氨基酸且具有同等功能的由(a)衍生的蛋白质。
[0010]
所述phab基因为3-氧酰基-(酰基载体蛋白)还原酶基因,来源于cupriavidus necator,其为编码如下蛋白质(c)或(d)的基因:
[0011]
(c)由seq id no:4所示的氨基酸序列组成的蛋白质;
[0012]
(d)seq id no:4所示序列经取代、缺失或添加一个或几个氨基酸且具有同等功能的由(c)衍生的蛋白质。
[0013]
所述bld基因来源于clostridium saccharoperbutylacetonicum,其编码蛋白的氨基酸序列如seq id no:1或2所示。
[0014]
所述yqhd基因为醇脱氢酶基因,来源于大肠杆菌(escherichia coli),其为编码如下蛋白质(e)或(f)的基因:
[0015]
(e)由seq id no:6所示的氨基酸序列组成的蛋白质;
[0016]
(f)seq id no:6所示序列经取代、缺失或添加一个或几个氨基酸且具有同等功能的由(e)衍生的蛋白质。
[0017]
所述微生物选自埃希氏菌属(escherichia)、克雷伯氏菌属(klebsiella)、棒杆菌属(corynebacterium)、短杆菌属(brevibacterium)等中的菌种;优选大肠杆菌。
[0018]
所述重组菌可按如下方法构建得到:phaa、phab基因经密码子优化后,与bld、yqhd基因一起构建到表达载体上,用重组载体转化大肠杆菌,筛选阳性转化子。
[0019]
优选地,密码子优化的phaa-phab操纵子的序列如seq id no:5所示。
[0020]
更优选地,所述重组菌的构建如下:将phaab-bld2-yqhd串联基因表达盒构建到ptrc99a质粒上,用重组质粒转化大肠杆菌(如w3110),筛选阳性转化子。
[0021]
其中,bld-yqhd-phaab串联基因表达盒的序列如seq id no:9和10所示。
[0022]
第二方面,本发明提供一种用于生产光学纯1,3-丁二醇的重组大肠杆菌,所述重组大肠杆菌是以上述重组菌作为出发菌株,利用基因工程手段对出发菌株进行改造,得到的细胞内nadph供给增强的工程菌。包括如下方案:
[0023]
方案i:通过增强出发菌株中与nadph生物合成途径相关的基因,来提高细胞内nadph的供给。
[0024]
优选地,所述与nadph生物合成途径相关的基因为pntab基因,核苷酸序列如下:
[0025]
i)seq id no:7所示的核苷酸序列;
[0026]
ii)seq id no:7所示的核苷酸序列经取代、缺失和/或增加一个或多个核苷酸且表达相同功能蛋白质的核苷酸序列;
[0027]
iii)在严格条件下与seq id no:7所示序列杂交且表达相同功能蛋白质的核苷酸序列,所述严格条件为在含0.1%sds的0.1
×
sspe或含0.1%sds的0.1
×
ssc溶液中,在65℃下杂交,并用该溶液洗膜;或
[0028]
iv)与i)、ii)或iii)的核苷酸序列具有90%以上同源性且表达相同功能蛋白质的核苷酸序列。
[0029]
本发明中,所述增强的途径选自以下1)~6),或任选的组合:
[0030]
1)通过导入具有所述基因的质粒而增强;
[0031]
2)通过增加染色体上所述基因的拷贝数而增强;
[0032]
3)通过改变染色体上所述基因的启动子序列而增强;
[0033]
4)通过将强启动子与所述基因可操作地连接而增强;
[0034]
5)通过导入增强子而增强;
[0035]
6)通过使用具有编码高活性的相应酶或蛋白质的基因或等位基因而增强。
[0036]
方案ii:弱化出发菌株中stha基因,来提高细胞内nadph的供给;
[0037]
stha基因的核苷酸序列如下:
[0038]
i)seq id no:8所示的核苷酸序列;
[0039]
ii)seq id no:8所示的核苷酸序列经取代、缺失和/或增加一个或多个核苷酸且表达相同功能蛋白质的核苷酸序列;
[0040]
iii)在严格条件下与seq id no:8所示序列杂交且表达相同功能蛋白质的核苷酸序列,所述严格条件为在含0.1%sds的0.1
×
sspe或含0.1%sds的0.1
×
ssc溶液中,在65℃下杂交,并用该溶液洗膜;或
[0041]
iv)与i)、ii)或iii)的核苷酸序列具有90%以上同源性且表达相同功能蛋白质的核苷酸序列。
[0042]
本发明中,所述弱化包括敲除或降低基因的表达。
[0043]
方案iii:通过增强出发菌株(大肠杆菌)中pntab基因,并弱化stha基因,来提高细胞内nadph的供给。
[0044]
第三方面,本发明提供一种高产1,3-丁二醇的工程菌,所述工程菌是以上述重组菌,或者上述重组大肠杆菌作为原始菌株,利用基因工程手段对原始菌株做进一步改造,得到的细胞内乙酰coa流向1,3-丁二醇合成途径的代谢通量增强的工程菌。
[0045]
优选地,弱化原始菌株中adhe、ldha、pta、acka基因中的至少一种基因,来提高细胞内乙酰coa流向1,3-丁二醇合成途径的代谢通量;所述弱化包括敲除或降低基因的表达。
[0046]
adhe、ldha、pta、acka基因编码蛋白的氨基酸序列分别如seq id no:11-14所示。
[0047]
优选地,弱化原始菌株(大肠杆菌)中adhe、ldha、pta和acka基因,来提高细胞内乙酰coa流向1,3-丁二醇合成途径的代谢通量。
[0048]
第四方面,本发明提供一种丁醛脱氢酶突变体,其是将丁醛脱氢酶(seq id no:1)第273位亮氨酸突变为苏氨酸而成,所述突变体的氨基酸序列如seq id no:2所示。
[0049]
第五方面,本发明提供含有上述丁醛脱氢酶突变体编码基因的生物材料,所述生物材料包括重组dna、表达盒、转座子、质粒载体、噬菌体载体、病毒载体或工程菌。
[0050]
第六方面,本发明提供上述生物材料在微生物发酵生产1,3-丁二醇中的应用。
[0051]
第七方面,本发明提供上述重组菌,或上述重组大肠杆菌,或者上述工程菌在发酵生产1,3-丁二醇中的应用。
[0052]
第八方面,本发明提供一种生产光学纯1,3-丁二醇的方法,包括在发酵培养基中对上述重组菌,或上述重组大肠杆菌,或者上述工程菌进行培养以生产1,3-丁二醇。
[0053]
可选地,所述发酵培养基为m9y:葡萄糖20g/l,na2hpo
4 6g/l,kh2po
4 3g/l,nacl 0.5g/l,nh4cl 1g/l,mgso
4 0.5g/l,cacl
2 15mg/l,酵母粉2g/l,氨苄青霉素100mg/l,以水配制。
[0054]
培养条件为:30℃,200rpm,控制溶氧低于10%的饱和溶氧值。
[0055]
利用本发明的大肠杆菌工程菌在微氧条件下发酵廉价有机碳源如葡萄糖、蔗糖或甘油等,1,3-丁二醇相对于底物的得率可以达到0.4g/g以上,且r型1,3-丁二醇纯度达到99%以上,具有重要的工业应用潜力。
附图说明
[0056]
图1为本发明质粒ptrc99a-bld2-yqhd-phaab图谱。
[0057]
图2为本发明质粒ptrc99a-bld-yqhd-phaab图谱。
[0058]
图3为本发明质粒ptrc99a-pdup-yqhd-phaab图谱。
yqhd-phaab,e.coli/ptrc99a-eute-yqhd-phaab。将这四株菌分别在500ml的不带挡板摇瓶中进行培养,装液量为200ml,培养基为m9y(葡萄糖20g/l,na2hpo
4 6g/l,kh2po
4 3g/l,nacl 0.5g/l,nh4cl 1g/l,mgso
4 0.5g/l,cacl
2 15mg/l,酵母粉2g/l,氨苄青霉素100mg/l),培养温度为30℃,转速200rpm,待菌液od
600
=0.6时,加入1mm iptg进行诱导,发酵72h时取样,利用高效液相色谱检测四株菌生产1,3-丁二醇的情况。结果显示,仅有大肠杆菌e.coli/ptrc99a-bld-yqhd-phaab生产了0.3g/l的1,3-丁二醇,而其他三株菌株并不能产生1,3-丁二醇。说明1,3-丁二醇途径中关键酶的筛选对于1,3-丁二醇的合成至关重要。
[0071]
进一步地,本发明发现醛脱氢酶是影响1,3-丁二醇合成的关键制约因素。为此,本发明进行了大量的蛋白质工程改造,最终发现以ptrc99a-bld-yqhd-phaab为模板,利用biorad的基因突变试剂盒将bld基因的273位氨基酸由亮氨酸突变为苏氨酸(seq id no:2),获得质粒ptrc99a-bld(l273t)-yqhd-phaab(质粒图谱如图5所示)。将该质粒转化到大肠杆菌w3110中,获得的重组菌命名为e.coli/ptrc99a-bld(l273t)-yqhd-phaab。将该菌株在m9y培养基中进行培养,培养条件同上,72h时取样,利用高效液相色谱检测1,3-丁二醇的产量。结果显示,e.coli/ptrc99a-bld(l273t)-yqhd-phaab的1,3-丁二醇的产量达到2.2g/l。
[0072]
因此,本发明发现1,3-丁二醇合成途径酶的选择对1,3-丁二醇的生产至关重要,通过系统的优化1,3-丁二醇的途径,极大提高了1,3-丁二醇的产量。
[0073]
实施例2通过强化nadph的合成提高1,3-丁二醇的产量
[0074]
1,3-丁二醇合成途径需要消耗大量的nadph,本发明创造性地发现,过表达pntab基因及敲除大肠杆菌stha基因可以显著提高细胞的1,3-丁二醇产量。
[0075]
将ptrc99a-bld(l273t)-yqhd-phaab用sbfi进行双酶切,利用gibson组装试剂盒将大肠杆菌的pntab基因(seq id no:7)插入到ptrc99a-bld(l273t)-yqhd-phaab质粒骨架上,获得的质粒命名为ptrc99a-bld(l273t)-yqhd-phaab-pntab(质粒图谱如图6所示)。将该质粒转化到大肠杆菌w3110中,获得的重组菌命名为e.coli/ptrc99a-bld(l273t)-yqhd-phaab-pntab。将该菌株在m9y培养基中进行培养,发酵条件同上所述,72h时取样,利用高效液相色谱检测1,3-丁二醇的产量。结果显示,e.coli/ptrc99a-bld(l273t)-yqhd-phaab-pntab的1,3-丁二醇的产量达到4.8g/l。检测该菌株胞内的nadph含量显示,该菌株的nadph含量较e.coli/ptrc99a-bld(l273t)-yqhd-phaab提高了1.8倍。
[0076]
进一步地,通过基因敲除大肠杆菌w3110的stha基因(seq id no:8)以强化nadph的供给并提高1,3-丁二醇的产量。具体方法是以大肠杆菌mg1655δstha::kan(购自耶鲁大学cgsc大肠杆菌突变库,参见baba et al.,construction of escherichia coli k-12in-frame,single-gene knockout mutants:the keio collection,mol syst biol.2006,2:2006.0008.)制备p1噬菌体溶菌产物,将溶菌产物与新鲜的大肠杆菌w3110培养物混合30分钟,加入1ml含有0.2m柠檬酸钠的lb培养基在37℃培养1h后涂布在包含50mg/l卡纳霉素抗性的lb平板上,筛选带抗性的重组菌株。进一步将带flp酶的质粒pcp20(购自耶鲁大学cgsc大肠杆菌突变库,参见datsenko&wanner,one-step inactivation of chromosomal genes in escherichia coli k-12 using pcr products,proc natl acad sci usa.2000,97(12):6640
–
6645.)转入该菌株,获得除去卡纳抗性标记的菌株命名为e.coli δstha。将质粒ptrc99a-bld(l273t)-yqhd-phaab-pntab转化到大肠杆菌w3110中,获得的重组菌命名为
e.coli δstha/ptrc99a-bld(l273t)-yqhd-phaab-pntab。将该菌株在m9y培养基中进行培养,发酵条件同上所述,72h时取样,利用高效液相色谱检测1,3-丁二醇的产量。结果显示,e.coli δstha/ptrc99a-bld(l273t)-yqhd-phaab-pntab的1,3-丁二醇的产量达到5.8g/l。检测该菌株胞内的nadph含量显示,该菌株的nadph含量相比e.coli/ptrc99a-bld(l273t)-yqhd-phaab提高了2.3倍。
[0077]
因此,本发明发现大肠杆菌中nadph的含量对1,3-丁二醇合成至关重要,通过系统的强化nadph的含量,极大提高了1,3-丁二醇的产量。
[0078]
实施例3强化乙酰辅酶a的供给提高1,3-丁二醇的产量
[0079]
1,3-丁二醇合成途径的代谢前体是乙酰辅酶a,本发明发现通过减少乙酰辅酶a流向其他代谢支路可以进一步提高1,3-丁二醇的产量。利用p1噬菌体溶菌产物转染的方法,进一步敲除e.coli δstha的乙醇合成基因adhe,乳酸合成基因ldha,乙酸合成基因pta、acka。其中,adhe、ldha、pta、acka基因编码蛋白的氨基酸序列分别如seq id no:11-14所示。获得的菌株分别命名为e.coli δsthaδadhe,e.coli δsthaδldha,e.coli δsthaδpta-acka。同时利用p1噬菌体溶菌产物转染的方法,构建了同时包含这三个基因突变的菌株,命名为e.coli δsthaδadheδldhaδpta-acka。将质粒ptrc99a-bld(l273t)-yqhd-phaab-pntab分别转化到这四株菌种,获得的菌株分别命名为e.coli δsthaδadhe/ptrc99a-bld(l273t)-yqhd-phaab-pntab,e.coli δsthaδldha/ptrc99a-bld(l273t)-yqhd-phaab-pntab,e.coli δsthaδpta-acka/ptrc99a-bld(l273t)-yqhd-phaab-pntab,e.coli δsthaδadheδldhaδpta-acka/ptrc99a-bld(l273t)-yqhd-phaab-pntab。将该菌株在m9y培养基中进行培养,发酵条件同上所述,72h时取样,利用高效液相色谱检测1,3-丁二醇的产量。结果显示,e.coli δsthaδadhe/ptrc99a-bld(l273t)-yqhd-phaab-pntab,e.coli δsthaδldha/ptrc99a-bld(l273t)-yqhd-phaab-pntab,e.coli δsthaδpta-acka/ptrc99a-bld(l273t)-yqhd-phaab-pntab,e.coli δsthaδadheδldhaδpta-acka/ptrc99a-bld(l273t)-yqhd-phaab-pntab的1,3-丁二醇的产量分别达到6.1g/l,6.2g/l,6.8g/l,8.1g/l。
[0080]
利用光学色谱检测,上述菌株生产的1,3-丁二醇均为r构型,纯度达到99%以上。
[0081]
因此本发明通过系统地改造,获得1,3-丁二醇的高产菌株,1,3-丁二醇对底物的得率可以达到0.4g/g以上,且r型1,3-丁二醇纯度达到99%以上,具有重要的工业应用潜力。
[0082]
实施例4重组大肠杆菌利用其它碳源生产1,3-丁二醇
[0083]
进一步测试了重组菌株e.coli δsthaδadheδldhaδpta-acka/ptrc99a-bld(l273t)-yqhd-phaab-pntab利用其它碳源生产1,3-丁二醇的情况。以甘油为碳源,利用发酵培养基m9y-g(甘油20g/l,na2hpo
4 6g/l,kh2po
4 3g/l,nacl 0.5g/l,nh4cl 1g/l,mgso
4 0.5g/l,cacl
2 15mg/l,酵母粉2g/l,氨苄青霉素100mg/l)进行培养,培养温度为30℃,转速200rpm,待菌液od
600
=0.6时,加入1mm iptg进行诱导,发酵72h时取样,利用高效液相色谱检测该菌生产1,3-丁二醇的情况,其1,3-丁二醇产量达到8.3g/l,说明本发明构建的重组菌株同样能高效利用甘油高产1,3-丁二醇。
[0084]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因
此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



