一种手性α-多取代-α-含氟高烯丙胺类化合物、其制备方法及应用与流程
 2021-02-01 23:02:08|
2021-02-01 23:02:08| 368|
368| 起点商标网
起点商标网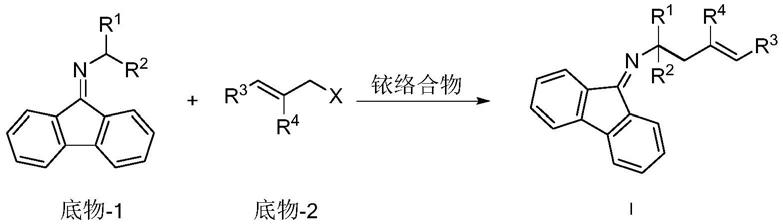
一种手性
α-多取代-α-含氟高烯丙胺类化合物、其制备方法及应用
技术领域
[0001]
本发明属于化学医药领域,具体涉及一种手性α-多取代-α-含氟高烯丙胺类化合物、其制备方法及应用。
背景技术:
[0002]
手性α-多取代-α-含氟高烯丙胺结构单元广泛存在于具有重要生物活性的化合物(如上市药物)中。因此高效,普适,容易使用的手性α-多取代-α-含氟高烯丙胺合成方法一直是合成化学中的热点研究领域。其中手性α-四取代-α-含氟高烯丙胺因其含有季碳手性中心而合成困难,目前鲜有高效催化不对称合成的报道。含氟芴亚胺,具有易得稳定等特点,是非常好的合成子。然而到目前为止,没有报道使用不对称催化烯丙基化的方法利用含氟芴亚胺合成手性α-多取代-α-含氟高烯丙胺。
技术实现要素:
[0003]
本发明目的之一在于提供一种手性α-多取代-α-含氟高烯丙胺类化合物,其结构为该手性α-多取代-α-含氟高烯丙胺类化合物可用于合成手性α-多取代-α-含氟高烯丙胺类化合物ii以及制备具有手性四氢吡咯结构的衍生物,具有手性胺结构单元的抗抑郁类药物、抗肿瘤类药物和天然产物。
[0004]
本发明目的之二在于提供一种手性α-多取代-α-含氟高烯丙胺类化合物的制备方法,本发明方法合成简单,成本低,产率高,所得反应目标化合物对应选择性好,产率50-95%,对应选择性过量>90%。
[0005]
本发明目的之三在于提供一种手性α-多取代-α-含氟高烯丙胺类化合物在制备手性α-多取代-α-含氟高烯丙胺类化合物ii以及制备具有手性四氢吡咯结构的衍生物中的应用。
[0006]
本发明实现目的之一采用以下技术方案:
[0007]
一种手性α-多取代-α-含氟高烯丙胺类化合物,其结构如下式i所示,
[0008]
[0009]
其中,
[0010]
r1为取代或未取代的芳基、氢中的任一种,所述取代芳基中的取代基为烷基或卤素;
[0011]
r2为一氟甲基、二氟甲基、三氟甲基、c
2-5
的全氟烷基中的任一种;
[0012]
r3为氢、取代或未取代的芳基、取代或未取代的不饱和杂环基、c
1-c6链式或环状烷烃中的任一种,所述取代或未取代的不饱和杂环基中含有的杂原子为n、o、s中的任一种,所述取代芳基中的取代基为烷基、烷氧基、卤素、链烯基中任一种;
[0013]
r4为氢、取代或未取代的芳基、烷烃中的任一种。
[0014]
本发明实现目的之二采用以下技术方案:
[0015]
一种手性α-多取代-α-含氟高烯丙胺类化合物的制备方法,主要包括以下步骤,
[0016]
以铱络合物作为催化剂,底物-1与底物-2进行催化反应,得到式i所示的手性α-多取代-α-含氟高烯丙胺类化合物;
[0017][0018]
其中,
[0019]
r1为取代或未取代的芳基、氢中的任一种,所述取代芳基中的取代基为烷基或卤素;
[0020]
r2为一氟甲基、二氟甲基、三氟甲基、c
2-5
的全氟烷基中的任一种;
[0021]
r3为氢、取代或未取代的芳基、取代或未取代的不饱和杂环基、c
1-c6链式或环状烷烃中的任一种,所述取代或未取代的不饱和杂环基中含有的杂原子为n、o、s中的任一种,所述取代芳基中的取代基为烷基、烷氧基、卤素、链烯基中任一种;
[0022]
r4为氢、取代或未取代的芳基、烷烃中的任一种。
[0023]
进一步地,上述手性α-多取代-α-含氟高烯丙胺类化合物的制备方法具体步骤如下:
[0024]
在惰性气体保护下,将底物-1(烯丙基碳酸酯)、底物-2(含氟芴亚胺)、铱络合物和1~10当量的有机碱溶于有机溶剂中,在0~110℃充分反应,经柱层析即得到式i所述的手性α-多取代-α-含氟高烯丙胺类化合物;
[0025]
其中,所述底物-1浓度为0.001~3.0m,所述底物-2浓度为0.001~3.0m,所述底物-1与底物-2的摩尔比为1:0.1~10;所述铱络合物的用量为底物-1或底物-2中浓度较低者的0.0001~10mol%;所述有机碱为三乙胺、四甲基乙二胺、1,5-二氮杂二环[4.3.0]壬-5-烯、1,8-二氮杂二环十一碳-7-烯、1,4-二氮杂二环[2.2.2]辛烷、吡啶、4-二甲氨基吡啶、n-甲基吗啉、三乙烯二胺、四甲基胍、2-叔丁基-1,1,3,3-四甲基胍中的任意一种;所述有机溶剂为甲醇、乙醇、异丙醇、叔丁醇、仲丁醇、乙酸乙酯、乙酸异丁酯、乙酸异丙酯、正己烷、环己烷、正庚烷、丙酮、丁酮、乙醚、甲基叔丁基醚、甲基环戊基醚、甲基四氢呋喃、四氢呋喃、乙腈、二氯甲烷、二甲亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、甲苯和二氧六环中的至少
一种。
[0026]
进一步地,所述铱络合物采用如下方法制备:
[0027]
50℃下,按金属铱盐和手性配体l1溶于有机溶剂中,加入有机碱经反应得到;
[0028]
其中,
[0029]
所述金属铱盐为[ir(cod)cl]2、[ir(dbcot)cl]2、[ir(cod)ome]2中的任一种;
[0030]
所述手性配体l1的结构式为如下任一种:
[0031][0032]
所述有机溶剂为甲醇、乙醇、异丙醇、叔丁醇、仲丁醇、乙酸乙酯、乙酸异丁酯、乙酸异丙酯、正己烷、环己烷、正庚烷、丙酮、丁酮、乙醚、甲基叔丁基醚、甲基环戊基醚、甲基四氢呋喃、四氢呋喃、乙腈、二氯甲烷、二甲亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、甲苯和二氧六环中的至少一种,优选的,所述有机溶剂为甲苯;
[0033]
所述有机碱为三乙胺、四甲基乙二胺、1,5-二氮杂二环[4.3.0]壬-5-烯、1,8-二氮杂二环十一碳-7-烯、1,4-二氮杂二环[2.2.2]辛烷、吡啶、4-二甲氨基吡啶、n-甲基吗啉、三乙烯二胺、四甲基胍、2-叔丁基-1,1,3,3-四甲基胍中的任意一种。
[0034]
本发明实现目的之三采用以下技术方案:
[0035]
一种上述手性α-多取代-α-含氟高烯丙胺类化合物的应用,所述手性α-多取代-α-含氟高烯丙胺类化合物应用于制备手性α-多取代-α-含氟高烯丙胺类化合物ii以及应用于制备具有手性四氢吡咯结构的衍生物;
[0036]
所述手性α-多取代-α-含氟高烯丙胺类化合物ii的结构式为所述具有手性四氢吡咯结构的衍生物的结构式为其中,r1为取代或未取代的芳基、氢中的任一种,所述取代芳基中的取代基为烷基或卤素,r2为一氟甲基、二氟甲基、三氟甲基、c
2-5
的全氟烷基中的任一种,r3为氢、取代或未取代的芳基、取代或未取代的不饱和杂环基、c
1-c6链式或环状烷烃中的任一种,所述取代或未取代的不饱和杂环基中含有的杂原子为n、o、s中的任一种,所述取代芳基中的取代基为烷基、烷氧基、卤素、链烯基中任一种,r4为氢、取代或未取代的芳基、烷烃中的任一种。
[0037]
进一步地,所述手性α-多取代-α-含氟高烯丙胺类化合物应用于制备手性α-多取代-α-含氟高烯丙胺类化合物ii的步骤如下:将式i所述的手性α-多取代-α-含氟高烯丙胺类化合物在酸中进行水解,得到如下式ii所述的手性α-多取代-α-含氟高烯丙胺类化合物ii:
[0038][0039]
其中,
[0040]
r1为取代或未取代的芳基、氢中的任一种,所述取代芳基中的取代基为烷基或卤素;
[0041]
r2为一氟甲基、二氟甲基、三氟甲基、c
2-5
的全氟烷基中的任一种;
[0042]
r3为氢、取代或未取代的芳基、取代或未取代的不饱和杂环基、c
1-c6链式或环状烷烃中的任一种,所述取代或未取代的不饱和杂环基中含有的杂原子为n、o、s中的任一种,所述取代芳基中的取代基为烷基、烷氧基、卤素、链烯基中任一种;
[0043]
r4为氢、取代或未取代的芳基、烷烃中的任一种。
[0044]
进一步地,所述手性α-多取代-α-含氟高烯丙胺类化合物应用于制备具有手性四氢吡咯结构的衍生物的步骤如下:
[0045]
(1)将式i所述的手性α-多取代-α-含氟高烯丙胺类化合物在酸中进行水解,得到如下式ii所述的手性α-多取代-α-含氟高烯丙胺类化合物ii:
[0046][0047]
(2)将上述步骤(1)得到的手性α-多取代-α-含氟高烯丙胺类化合物ii溶于有机溶剂中,加入1到10个当量碳酸盐或碳酸氢盐、1到5个当量碘单质,在(-40)~0℃下反应,反应达到平衡后加入硫代硫酸钠饱和溶液淬灭,再经柱层析得到目标产物,即所述的具有手性四氢吡咯结构的衍生物:
[0048][0049]
其中,
[0050]
r1为取代或未取代的芳基、氢中的任一种,所述取代芳基中的取代基为烷基或卤素;
[0051]
r2为一氟甲基、二氟甲基、三氟甲基、c
2-5
的全氟烷基中的任一种;
[0052]
r3为氢、取代或未取代的芳基、取代或未取代的不饱和杂环基、c
1-c6链式或环状烷烃中的任一种,所述取代或未取代的不饱和杂环基中含有的杂原子为n、o、s中的任一种,所述取代芳基中的取代基为烷基、烷氧基、卤素、链烯基中任一种;
[0053]
r4为氢、取代或未取代的芳基、烷烃中的任一种。
[0054]
更进一步地,所述水解温度为0~100℃,水解时间为0.5~24小时,所述酸为柠檬酸、盐酸、甲磺酸、对甲苯磺酸、乙酸、硫酸、盐酸羟胺、醋酸羟胺中的任意一种,所述酸的用量为底物-1或底物-2中浓度较低者的1~20倍。
[0055]
更进一步地,所述步骤(2)中,所述柱层析以硅胶为填充料,以石油醚和乙酸乙酯的混合溶剂为淋洗剂,并且石油醚和乙酸乙酯的体积比为3~20:1;所述有机溶剂为甲醇、乙醇、异丙醇、叔丁醇、仲丁醇、乙酸乙酯、乙酸异丁酯、乙酸异丙酯、正己烷、环己烷、正庚烷、丙酮、丁酮、乙醚、甲基叔丁基醚、甲基环戊基醚、甲基四氢呋喃、四氢呋喃、乙腈、二氯甲烷、二甲亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、甲苯和二氧六环中的至少一种。
[0056]
再进一步地,所述的手性α-多取代-α-含氟高烯丙胺类化合物ii可用于制备具有手性胺结构单元的抗抑郁类药物、抗肿瘤类药物和天然药物;所述的具有手性四氢吡咯结构的衍生物可用作有机催化剂。
[0057]
与现有技术相比,本发明具有以下有益效果:
[0058]
(1)本发明方法合成简单,成本低,产率高,所得反应目标化合物对应选择性好,产率50-95%,对应选择性过量>90%;
[0059]
(2)本发明方法采用铱络合物作为催化剂,在反应中表现出催化反应速度快和催化剂用量低的优点;
[0060]
(3)所制备的手性α-多取代-α-含氟高烯丙胺类化合物i可以用于合成手性α-多取代-α-含氟高烯丙胺类化合物ii,手性α-多取代-α-含氟高烯丙胺类化合物ii可用于制备具有手性胺结构单元的抗抑郁类药物、抗肿瘤类药物和天然药物;
[0061]
(4)所制备的手性α-含氟高烯丙胺类化合物ii可用于合成可作为有机催化剂的具有手性四氢吡咯结构的衍生物;
[0062]
(5)为手性α-多取代-α-含氟高烯丙胺类化合物i、手性α-多取代-α-含氟高烯丙胺类化合物ii及具有手性四氢吡咯结构的衍生物提供了一种极具前景的合成方法;对于含有手性α-多取代-α-含氟高烯丙胺结构单元的药物合成极具参考价值。
具体实施方式
[0063]
为了更好的理解本发明,下面结合实施例对本发明做进一步的说明。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
[0064]
下列实施例中采用的手性配体(s,s,s)-l1的结构式为下列实施例中采用的配体(r,r,r)-l1的结构式为下列实施例中采用
的配体(rac)-l1的结构式为下列实施例中采用的手性配体(s,s
a
)-l1的结构式为
[0065]
【实施例1】
[0066]
1)的制备
[0067]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0068]
2)的制备
[0069]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到白色固体,产率90%,熔点74-76℃,产物的对映选择性过量>99%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=248nm);t
r
=6.40and 9.21min.[α]
30d
=-35.8(c 0.26,ch2cl2);1h nmr(400mhz,cdcl3)δ7.40
–
7.35(m,2h),7.34
–
7.28(m,2h),7.25
–
7.20(m,1h),6.54(dt,j=16.0,1.2hz,1h),6.20(dt,j=16.0,7.2hz,1h),3.32(dqd,j=14.4,7.2,4.0hz,1h),2.65(dddd,j=14.4,7.2,4.0,1.6hz,1h),2.37(dddd,j=14.4,9.2,7.2,1.2hz,1h),1.51(s,2h).
13
c nmr(101mhz,cdcl3)δ136.7,134.0,128.6,127.6,126.4(q,j=28hz),126.2,124.1,53.5(q,j=28hz),33.7(q,j=2hz).
19
f nmr(376mhz,cdcl3)δ-78.18(d,j=8.1hz).;hrms(esi+)计算值c
11
h
13
f3n
+
([m+h]
+
):216.0995,测量值:216.0997。
[0070]
【实施例2】
[0071]
1)的制备
[0072]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol对甲基苯烯丙基碳酸甲酯和0.20mmol1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0073]
2)的制备
[0074]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到白色固体,产率89%,熔点52-54℃,产物的对映选择性过量99%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=264nm);t
r
=6.41and 9.73min.[α]
30d
=-46.36(c 0.11,ch2cl2);1h nmr(400mhz,cdcl3)δ7.26(d,j=8.0hz,2h),7.12(d,j=7.6hz,2h),6.50(d,j=15.6hz,1h),6.13(dt,j=16.0,7.2hz,1h),3.31(dqd,j=12.0,7.6,4.0hz,1h),2.63(dddd,j=14.8,7.2,4.0,1.2hz,1h),2.33(s,3h),1.50(s,2h).
13
c nmr(101mhz,cdcl3)δ137.4,134.0,133.9,129.2,126.4(q,j=279hz),126.1,123.0,53.5(q,j=28hz),33.6(q,j=1hz),21.1.
19
f nmr(376mhz,cdcl3)δ-78.12(d,j=7.5hz).;hrms(esi+)计算值c
12
h
15
f3n
+
([m+h]
+
):230.1151,测量值:230.1149。
[0075]
【实施例3】
[0076]
1)的制备
[0077]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol间甲基苯烯丙基碳酸甲酯和0.20mmol1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0078]
2)的制备
[0079]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,2ml,
由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率81%,产物的对映选择性过量96%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=254nm);t
r
=6.14and 9.78min.[α]
30d
=-33.3(c 0.27,ch2cl2);1h nmr(400mhz,cdcl3)δ7.24
–
7.14(m,3h),7.06(d,j=7.2hz,1h),6.51(d,j=15.6hz,1h),6.18(dt,j=15.6,7.6hz,1h),3.42
–
3.21(m,1h),2.65(dddd,j=14.2,6.8,4.0,1.2hz,1h),2.40
–
2.29(m,1h),2.34(s,3h),1.50(s,2h).
13
c nmr(101mhz,cdcl3)δ138.1,136.7,134.1,128.5,128.4,126.9,126.4(q,j=280hz),123.9,123.4,53.5(q,j=28hz),33.7(q,j=3hz),21.4.
19
f nmr(376mhz,cdcl3)δ-78.14(d,j=6.9hz).;hrms(esi+)计算值c
12
h
15
f3n
+
([m+h]
+
):230.1151,测量值:230.1148。
[0080]
【实施例4】
[0081]
1)的制备
[0082]
在25ml反应管中加入0.015mmol[ir(cod)cl]2、0.030mmol(s,s
a
)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol间甲基苯烯丙基碳酸甲酯和0.20mmol1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0083]
2)的制备
[0084]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,2ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率63%,产物的对映选择性过量96%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=242nm);t
r
=5.09and 7.18min.[α]
28d
=16.00(c 0.40,ch2cl2);1h nmr(400mhz,cdcl3)δ7.46
–
7.40(m,1h),7.16(dt,j=6.5,3.4hz,3h),6.74(d,j=15.2,1.5hz,1h),6.07(dt,j=15.2,7.3hz,1h),3.40
–
3.28(m,1h),2.71
–
2.57(m,1h),2.45
–
2.38(m,1h),2.34(s,3h).
13
c nmr(101mhz,cdcl3)δ135.9,135.2,131.9,130.3,127.5,126.5(q,j=281.3hz),126.1,125.6,125.5,53.5(q,j=28.6hz),33.9,19.8.
19
f nmr(376mhz,cdcl3)δ-78.06(d,j=7.4hz).;hrms(esi+)计算值c
12
h
15
f3n
+
([m+h]
+
):230.1151,测量值:230.1145。
[0085]
【实施例5】
[0086]
1)的制备
[0087]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol对甲氧基苯烯丙基碳酸甲酯和0.20mmol1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0088]
2)的制备
[0089]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到淡黄色固体,产率90%,熔点70-72℃,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=260nm);t
r
=10.89and 14.34min.[α]
30d
=-36.5(c 0.54,ch2cl2);1h nmr(400mhz,cdcl3)δ7.34
–
7.27(m,2h),6.90
–
6.79(m,2h),6.47(d,j=15.6hz,1h),6.04(dt,j=15.6,7.2hz,1h),3.80(s,3h),3.31(dqd,j=9.2,7.2,4.0hz,1h),2.63(dddd,j=14.4,7.2,4.0,1.2hz,1h),2.34(dddd,j=14.4,9.2,7.2,1.2hz,1h),1.43(s,2h).
13
c nmr(101mhz,cdcl3)δ159.1,133.4,129.6,127.3,126.5(q,j=280hz),121.8,113.9,55.3,53.5(q,j=28hz),33.6(q,j=2hz).
19
f nmr(376mhz,cdcl3)δ-78.12(d,j=7.9hz).;hrms(esi+)计算值c
12
h
15
f3no
+
([m+h]
+
):246.1100,测量值:246.1098。
[0090]
【实施例6】
[0091]
1)的制备
[0092]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol对氯苯烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0093]
2)的制备
[0094]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,
由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到淡黄色固体,产率95%,熔点36-38℃,产物的对映选择性过量96%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=262nm);t
r
=7.14and 11.44min.[α]
30d
=-25.6(c 0.39,ch2cl2);1h nmr(400mhz,cdcl3)δ7.32
–
7.26(m,4h),6.49(dt,j=16.0,1.2hz,1h),6.19(dt,j=16.0,7.2hz,1h),3.32(dqd,j=14.4,7.2,4.0hz,1h),2.64(dddd,j=14.4,7.2,4.0,1.2hz,1h),2.36(dddd,j=14.4,8.8,7.2,1.2hz,1h),1.59(s,2h).
13
c nmr(101mhz,cdcl3)δ135.2,133.1,132.7,128.7,127.4,126.4(q,j=280hz),125.0,53.5(q,j=28hz),33.6(q,j=3hz).
19
f nmr(376mhz,cdcl3)δ-78.26(d,j=6.8hz).;hrms(esi+)计算值c
11
h
12
clf3n
+
([m+h]
+
):250.0605,测量值:250.0603。
[0095]
【实施例7】
[0096]
1)的制备
[0097]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol间氯苯烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0098]
2)的制备
[0099]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到淡黄色液体,产率89%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=252nm);t
r
=9.63and 16.99min.[α]
30d
=-30.4(c 1.11,ch2cl2);1h nmr(400mhz,cdcl3)δ7.38
–
7.33(m,1h),7.26
–
7.18(m,3h),6.47(dt,j=16.0,1.2hz,1h),6.22(dt,j=16.0,7.2hz,1h),3.32(dqd,j=9.2,7.2,4.0hz,1h),2.65(dddd,j=14.4,7.2,4.0,1.6hz,1h),2.36(dddd,j=14.4,9.2,7.6,1.2hz,1h),1.45(s,2h).
13
c nmr(101mhz,cdcl3)δ138.6,134.5,132.6,129.8,127.5,126.4(q,j=280hz),126.1,125.9,124.5,53.5(q,j=28hz),33.6(q,j=2hz).
19
f nmr(376mhz,cdcl3)δ-78.28(d,j=6.9hz).;hrms(esi+)计算值c
11
h
12
clf3n
+
([m+h]
+
):250.0605,测量值:250.0603。
[0100]
【实施例8】
[0101]
1)的制备
[0102]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol对氟苯烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0103]
2)的制备
[0104]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到淡黄色液体,产率95%,产物的对映选择性过量94%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=250nm);t
r
=6.82and 10.63min.[α]
30d
=-34.0(c 0.43,ch2cl2);1h nmr(400mhz,cdcl3)δ7.41
–
7.28(m,2h),7.00(t,j=8.8hz,2h),6.49(d,j=15.6hz,1h),6.11(dt,j=15.6,7.2hz,1h),3.32(dqd,j=14.4,7.2,4.0hz,1h),2.63(dddd,j=14.4,7.2,4.0,1.2hz,1h),2.35(dddd,j=14.4,9.2,7.2,1.2hz,1h),1.45(s,2h).
13
c nmr(101mhz,cdcl3)δ162.2(d,j=246hz),132.9(d,j=4hz),132.7,127.7(d,j=8hz),126.4(q,j=280hz),123.9(d,j=2hz),115.4(d,j=22hz),53.5(q,j=28hz),33.6(q,j=2hz).
19
f nmr(376mhz,cdcl3)δ-78.23(d,j=8.0hz),-114.49
–-
114.59(m).;hrms(esi+)计算值c
11
h
12
f4n
+
([m+h]
+
):234.0900,测量值:234.0901。
[0105]
【实施例9】
[0106]
1)的制备
[0107]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol 2-萘烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0108]
2)的制备
[0109]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到淡黄色固体,产率88%,熔点98-100℃,产物的对映选择性过量99%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=280nm);t
r
=6.31and 8.83min.[α]
30d
=-27.3(c 0.40,ch2cl2);1h nmr(400mhz,cdcl3)δ7.82
–
7.76(m,3h),7.73
–
7.70(m,1h),7.59(dd,j=8.8,1.6hz,1h),7.49
–
7.41(m,2h),6.70(dt,j=15.6,1.2hz,1h),6.33(dt,j=15.6,7.2hz,1h),3.37(dqd,j=14.4,7.2,4.0hz,1h),2.71(dddd,j=14.4,7.2,4.0,1.6hz,1h),2.42(dddd,j=14.4,9.2,7.6,1.2hz,1h),1.44(s,2h).
13
cnmr(101mhz,cdcl3)δ134.2,134.1,133.5,132.9,128.2,127.9,127.6,126.5(q,j=280hz),126.3,126.1,125.9,124.6,123.4,53.6(q,j=28hz),33.8(d,j=2hz).
19
f nmr(376mhz,cdcl3)δ-78.14(d,j=7.0hz).;hrms(esi+)计算值c
15
h
15
f3n
+
([m+h]
+
):266.1151,测量值:266.1150。
[0110]
【实施例10】
[0111]
1)的制备
[0112]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol 2-噻吩烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0113]
2)的制备
[0114]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色固体,产率80%,熔点35-37℃,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=280nm);t
r
=6.12and 8.34min.[α]
30d
=-64.7(c 0.62,ch2cl2);1h nmr(400mhz,cdcl3)δ7.14(dt,j=5.2,0.8hz,1h),6.99
–
6.90(m,2h),6.66(dt,j=15.6,0.8hz,1h),6.03(dt,j=15.6,7.2hz,1h),3.30(dqd,j=10.8,5.2,2.8hz,1h),2.62(dddd,j=14.4,7.2,4.0,1.6hz,1h),2.32(dddd,j=14.4,8.8,7.6,1.2hz,1h),1.45(s,2h).
13
c nmr(101mhz,cdcl3)δ141.8,127.1,126.4,125.4(q,j=280hz),,124.0,123.9,53.5(q,j=28.7hz),33.5(d,j=1.9hz).
19
f nmr(376mhz,cdcl3)δ-74.11(d,j=6.8hz).;hrms(esi+)计算值c9h
11
f3ns
+
([m+h]
+
):222.0559,测量值:222.0556。
[0115]
【实施例11】
[0116]
1)的制备
[0117]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol 2-呋喃烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0118]
2)的制备
[0119]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率75%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=10/90,flow rate 1.0ml/min,λ=276nm);t
r
=6.28and 8.45min.[α]
30d
=-56.9(c 0.16,ch2cl2);1h nmr(400mhz,cdcl3)δ7.44(d,j=2.0hz,1h),7.37(d,j=8.4hz,1h),7.18(dd,j=8.4,2.4hz,1h),6.43(dt,j=16.0,1.6hz,1h),6.22(dt,j=16.0,7.2hz,1h),3.32(dqd,j=14.4,7.2,4.0hz,1h),2.64(dddd,j=14.4,7.2,4.0,1.2hz,1h),2.36(dddd,j=14.4,8.8,7.2,1.2hz,1h),1.46(s,2h).
13
c nmr(101mhz,cdcl3)δ152.2,141.8,126.4(q,j=281.4hz),123.0,122.3,111.2,107.4,53.5(q,j=28.6hz),33.5(t,j=2.1hz).
19
f nmr(376mhz,cdcl3)δ-78.25(d,j=6.9hz).;hrms(esi+)计算值c9h
11
f3no
+
([m+h]
+
):206.0787,测量值:206.0792。
[0120]
【实施例12】
[0121]
的制备
[0122]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol 2-吡啶烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色固体,产率80%,熔点46-48℃,产物的对映选择性过量95%,hplc(chiralpak ad-h,i-propanol/hexane=4/94,flow rate 1.0ml/min,λ=254nm);t
r
=7.66and 11.12min.[α]
30d
=-56.4(c 0.36,ch2cl2);1h nmr(400mhz,cdcl3)δ8.48(ddd,j=4.8,1.6,0.8hz,1h),7.87(dt,j=7.6,0.8hz,1h),7.77(d,j=7.6hz,1h),7.65
–
7.57(m,1h),7.52(qd,j=5.2,4.8,1.6hz,2h),7.45
–
7.35(m,2h),7.29(td,j=7.6,1.2hz,1h),7.22(td,j=7.6,
1.2hz,1h),7.11(dd,j=8.0,1.2hz,1h),7.06(ddd,j=7.6,4.8,1.2hz,1h),6.73(dt,j=15.6,7.2hz,1h),6.61(d,j=15.6hz,1h),5.22
–
5.08(m,1h),3.16
–
3.03(m,1h),2.93
–
2.81(m,1h).
13
c nmr(101mhz,cdcl3)δ165.4,155.1,149.3,144.3,140.9,138.0,136.3,133.4,132.0,131.6,131.2,128.8,128.5,128.1,126.9,125.6(q,j=279hz),123.4,122.0,121.2,120.6,119.3,62.1(q,j=27hz),34.1.
19
f nmr(376mhz,cdcl3)δ-73.79(d,j=6.8hz).;hrms(esi+)理论值c
23
h
18
f3n
2+
([m+h]
+
):379.1417,测量值:379.1421。
[0123]
【实施例13】
[0124]
的制备
[0125]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol 3-吡啶烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色固体,产率67%,熔点37-39℃,产物的对映选择性过量91%,hplc(chiralpak ad-h,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=252nm);t
r
=11.73and 15.02min.[α]
30d
=-44.8(c 0.33,ch2cl2);1h nmr(400mhz,cdcl3)δ8.38(dt,j=3.2,1.6hz,2h),7.87(dt,j=7.6,1.2hz,1h),7.76(d,j=8.0hz,1h),7.61(dt,j=7.6,0.8hz,1h),7.53(dt,j=7.6,0.8hz,1h),7.48
–
7.36(m,3h),7.29(td,j=7.6,1.2hz,1h),7.21(td,j=7.6,1.2hz,1h),7.11(ddd,j=8.0,4.8,0.8hz,1h),6.46(d,j=16.0hz,1h),6.23(dt,j=16.0,7.6hz,1h),5.15(td,j=7.2,5.6hz,1h),3.04(dddd,j=14.4,7.2,5.6,1.2hz,1h),2.86(dddd,j=14.4,9.2,7.6,7.2,1.2hz,1h).
13
c nmr(101mhz,cdcl3)δ165.4,148.3,147.9,144.3,140.9,137.9,132.6,132.4,132.1,131.7,131.2,130.0,128.5,128.0,126.8,126.6,125.5(q,j=279hz),123.32,123.25,120.7,119.3,61.9(q,j=27hz),34.1(d,j=2.1hz).
19
f nmr(376mhz,cdcl3)δ-74.11(d,j=6.8hz).;hrms(esi+)计算值c
23
h
18
f3n
2+
([m+h]
+
):379.1417,测量值:379.1436。
[0126]
【实施例14】
[0127]
的制备
[0128]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol 6-喹啉烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化
得到黄色固体,产率80%,熔点74-76℃,产物的对映选择性过量97%,hplc(chiralpak ad-h,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=254nm);t
r
=21.67and 24.08min.[α]
25d
=-90.2(c 0.60,ch2cl2);1h nmr(400mhz,cdcl3)δ8.79(dd,j=4.3,1.7hz,1h),7.99
–
7.86(m,3h),7.79(d,j=7.8hz,1h),7.61
–
7.53(m,2h),7.53
–
7.48(m,1h),7.46
–
7.34(m,3h),7.33
–
7.26(m,2h),7.20(td,j=7.6,1.2hz,1h),6.63(d,j=15.7hz,1h),6.30(dt,j=15.3,7.4hz,1h),5.24
–
5.12(m,1h),3.09(dddd,j=14.5,7.2,5.7,1.3hz,1h),2.88(dddd,j=14.7,7.4,1.4hz,1h).
13
c nmr(101mhz,cdcl3)δ165.4,149.9,147.7,144.3,140.9,137.9,135.8,135.0,132.8,132.0,131.6,131.3,129.4,128.5,128.2,128.0,127.1,126.9,125.8,125.5(q,j=281.8hz,1h),125.3,123.3,121.3,120.6,119.3,62.1(q,j=27.5hz),34.2.
19
f nmr(376mhz,cdcl3)δ-74.02(d,j=6.7hz).;hrms(esi+)计算值c
27
h
20
f3n2([m+h]
+
):429.1573,测量值:429.1578。
[0129]
【实施例15】
[0130]
的制备
[0131]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟乙基芴酮亚胺、0.22mmol苯乙基烯丙基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率56%,产物的对映选择性过量92%,hplc(chiralpakod-h,i-propanol/hexane=3/97,flow rate 1.0ml/min,λ=252nm);t
r
=6.83and 10.98min.[α]
30d
=-12.1(c0.34,ch2cl2);1h nmr(400mhz,cdcl3)δ7.87(dt,j=7.6,0.8hz,1h),7.75(d,j=7.6hz,1h),7.66(dt,j=7.6,0.8hz,1h),7.56(dt,j=7.6,0.8hz,1h),7.44(dtd,j=8.8,7.6,1.2hz,2h),7.31(td,j=7.6,1.2hz,2h),7.26(td,j=7.6,1.2hz,3h),7.25
–
7.15(m,4h),7.17
–
7.08(m,1h),7.07
–
6.99(m,2h),5.58(dt,j=15.6,6.4hz,1h),5.47(dt,j=15.6,7.2hz,1h),5.08
–
4.93(m,1h),2.82(dt,j=14.0,6.4hz,1h),2.58(dt,j=14.4,7.2hz,1h),2.45(t,j=8.0hz,2h),2.24
–
2.13(m,2h).
13
c nmr(101mhz,cdcl3)δ164.9,144.3,141.7,140.9,138.1,134.0,131.9,131.6,131.5,128.5,128.3,128.2,127.9,127.2,125.7,124.6,123.4,120.6,119.3,62.4(q,j=27hz),35.4,34.2,33.6(q,j=1hz).
19
f nmr(376mhz,cdcl3)δ-74.28(d,j=6.8hz).;hrms(esi+)calcd.for c
26
h
22
f3nna
+
([m+na]
+
):428.1597,found:428.1600。
[0132]
【实施例16】
[0133]
1)的制备
[0134]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-(对氯苯基)乙基芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0135]
2)的制备
[0136]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率90%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=4.58and 4.89min.[α]
25d
=166.8(c 0.34,ch2cl2);1h nmr(400mhz,cdcl3)δ7.58
–
7.52(m,2h),7.39
–
7.33(m,2h),7.29
–
7.23(m,4h),7.23
–
7.17(m,1h),6.46(dt,j=15.8,1.4hz,1h),5.96
–
5.82(m,1h),3.00(ddd,j=14.3,7.0,1.4hz,1h),2.80(ddd,j=14.3,7.9,1.3hz,1h),1.78(s,2h).
13
c nmr(101mhz,cdcl3)δ136.6,136.2,135.3,134.3,128.6,128.5,128.4,127.6,126.8(q,j=285.8hz),126.2,122.0,61.2(q,j=26.0hz),40.2.
19
f nmr(376mhz,cdcl3)δ-77.58.;hrms(esi+)计算值c
17
h
16
clf3n([m+h]
+
):326.0918,理论值:326.0928。
[0137]
【实施例17】
[0138]
1)的制备
[0139]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-(间氯苯基)乙基芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0140]
2)的制备
[0141]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率85%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=4.29and 4.59min.[α]
25d
=137.1(c 0.93,ch2cl2);1h nmr(400mhz,cdcl3)δ7.67
–
7.62(m,1h),7.54
–
7.47(m,1h),7.33(dd,j=5.2,1.1hz,2h),7.29
–
7.24(m,4h),7.23
–
7.16(m,1h),6.48(dt,j=15.8,1.3hz,1h),5.88(dddd,j=15.8,7.9,7.0,0.9hz,1h),2.99(ddd,j=14.4,7.0,1.4hz,1h),2.82(ddd,j=14.3,7.9,1.3hz,1h),1.80(s,2h).
13
c nmr(101mhz,cdcl3)δ139.9,136.6,135.5,134.5,129.6,128.5,128.4,127.7,127.3,126.7(q,j=285.7hz),126.2,125.1,121.9,61.3(q,j=25.9hz),40.2.
19
f nmr(376mhz,cdcl3)δ-77.30.;hrms(esi+)计算值c
17
h
16
clf3n([m+h]
+
):326.0918,测量值:326.0925。
[0142]
【实施例18】
[0143]
1)的制备
[0144]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-(对三氟甲基苯基)乙基芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0145]
2)的制备
[0146]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率75%,产物的对映选择性过量98%,hplc(chiralpak id,i-propanol/hexane=2/98,flow rate 1.0ml/min,λ=260nm);t
r
=4.11and 4.47min.[α]
25d
=95.8(c 0.45,ch2cl2);1h nmr(400mhz,cdcl3)δ7.77(d,j=8.7hz,2h),7.66(d,j=8.5hz,2h),7.30
–
7.24(m,4h),7.23
–
7.18(m,1h),6.48(dt,j=15.7,1.3hz,1h),5.96
–
5.81(m,1h),3.02(ddd,j=14.4,7.1,1.4hz,1h),2.86(ddd,j=
14.4,7.7,1.2hz,1h),1.84(s,2h).
13
c nmr(101mhz,cdcl3)δ141.8,136.5,135.6,130.4(q,j=32.7hz),128.5,127.7,127.4,126.7(q,j=284.4hz),126.2,125.4(q,j=3.7hz),124.0(q,j=279.4hz),121.7,61.5(q,j=26.1hz),40.3.
19
f nmr(376mhz,cdcl3)δ-62.68,-77.20.;hrms(esi+)计算值c
18
h
16
f6n([m+h]
+
):360.1181,测量值:360.1198。
[0147]
【实施例19】
[0148]
1)的制备
[0149]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-(对甲基苯基)乙基芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0150]
2)的制备
[0151]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率80%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=254nm);t
r
=4.92and 5.41min.[α]
25d
=129.0(c 0.61,ch2cl2);1h nmr(400mhz,cdcl3)δ7.49(d,j=8.0hz,2h),7.25(d,j=4.4hz,4h),7.20(dd,j=8.3,4.1hz,3h),6.48(dt,j=15.8,1.4hz,1h),5.91(ddd,j=15.3,7.9,6.7hz,1h),3.05(ddd,j=14.3,6.7,1.5hz,1h),2.81(ddd,j=14.3,8.1,1.2hz,1h),2.36(s,3h),1.79(s,2h).
13
c nmr(101mhz,cdcl3)δ137.9,136.8,135.0,134.5,129.1,128.5,127.5,127.0(q,j=285.2hz),126.7,126.2,122.7,61.1(q,j=25.7hz),40.1,21.0.
19
f nmr(376mhz,cdcl3)δ-77.75.;hrms(esi+)计算值c
18
h
19
f3n([m+h]
+
):306.1464,测量值:306.1465。
[0152]
【实施例20】
[0153]
1)的制备
[0154]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧
thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-(对甲基苯基)乙基芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0155]
2)的制备
[0156]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率83%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=4.50and 4.95min.[α]
25d
=114.9(c 0.91,ch2cl2);1h nmr(400mhz,cdcl3)δ7.44
–
7.38(m,2h),7.32
–
7.23(m,5h),7.22
–
7.14(m,2h),6.49(dt,j=15.8,1.4hz,1h),5.99
–
5.84(m,1h),3.05(ddd,j=14.3,6.7,1.5hz,1h),2.82(ddd,j=14.3,8.1,1.2hz,1h),2.38(s,3h),1.80(s,2h).
13
c nmr(101mhz,cdcl3)δ138.0,137.5,136.7,135.1,128.9,128.5,128.2,127.5,127.4,127.0(q,j=285.8hz),126.2,123.9,122.7,61.2(q,j=25.6hz),40.2,21.6.
19
f nmr(376mhz,cdcl3)δ-77.45.;hrms(esi+)计算值c
18
h
19
f3n([m+h]
+
):306.1464,测量值:306.1466。
[0157]
【实施例21】
[0158]
1)的制备
[0159]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-(对叔丁基苯基)乙基芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0160]
2)的制备
[0161]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后
通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率72%,产物的对映选择性过量97%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=4.35and 4.82min.[α]
25d
=142.6(c 0.47,ch2cl2);1h nmr(400mhz,cdcl3)δ7.55
–
7.50(m,2h),7.43
–
7.38(m,2h),7.26(d,j=4.4hz,4h),7.22
–
7.16(m,1h),6.49(dt,j=15.8,1.4hz,1h),6.00
–
5.89(m,1h),3.04(ddd,j=14.4,6.8,1.6hz,1h),2.84(ddd,j=14.4,8.0,1.2hz,1h),1.80(s,2h),1.33(s,9h).
13
c nmr(101mhz,cdcl3)δ151.0,136.8,135.1,134.5,128.5,127.5,127.0(q,j=284.4hz),126.5,126.2,125.3,122.8,61.0(q,j=25.8hz),40.2,34.4,31.2.
19
f nmr(376mhz,cdcl3)δ-77.48.;hrms(esi+)计算值c
21
h
24
f3n([m+h]
+
):348.1934,测量值:348.1933。
[0162]
【实施例22】
[0163]
1)的制备
[0164]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-(2-萘乙基)芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0165]
2)的制备
[0166]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率84%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=5.23and 5.68min.[α]
25d
=156.3(c 0.19,ch2cl2);1h nmr(400mhz,cdcl3)δ8.11(d,j=1.9hz,1h),7.87(td,j=8.6,3.4hz,3h),7.72(dq,j=8.7,1.1hz,1h),7.56
–
7.45(m,2h),7.23
–
7.14(m,5h),6.51(dt,j=15.6,1.4hz,1h),5.91(dt,j=15.6,7.4hz,1h),3.19(ddd,j=14.3,6.6,1.5hz,1h),2.91(ddd,j=14.3,8.1,1.2hz,1h),1.95(s,2h).
13
c nmr(101mhz,cdcl3)δ136.6,135.2,135.0,132.9,132.8,128.4,128.1,127.5,127.4,127.0(d,j=285.4hz),126.6,126.5,126.3,126.2,124.3,122.4,61.5(q,j=25.7hz),40.2.
19
f nmr(376mhz,cdcl3)δ-77.23.;hrms(esi+)理论值c
21
h
24
f3n([m+h]
+
):342.1464,测量值:342.1469。
[0167]
【实施例23】
[0168]
1)的制备
[0169]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol对甲基苯丙烯碳酸甲酯和0.20mmol1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0170]
2)的制备
[0171]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率97%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=254nm);t
r
=4.81and 5.91min.[α]
25d
=156.3(c 0.19,ch2cl2);[]
25d
=84.7(c 0.60,ch2cl2);1h nmr(400mhz,cdcl3)δ7.66
–
7.59(m,2h),7.44
–
7.32(m,3h),7.14(t,j=7.5hz,1h),7.09
–
6.97(m,3h),6.45(dt,j=15.3,1.3hz,1h),5.90(dt,j=15.3,7.4hz,1h),3.05(ddd,j=14.3,6.9,1.4hz,1h),2.83(ddd,j=14.3,8.0,1.3hz,1h),2.29(s,3h),1.83(s,2h).
13
c nmr(101mhz,cdcl3)δ138.1,137.6,136.7,135.3,128.4,128.4,128.3,128.2,127.0(q,j=285.5hz),126.9,126.8,123.3,122.3,61.3(q,j=25.7hz),40.2.
19
f nmr(376mhz,cdcl3)δ-77.49.;hrms(esi+)计算值c
18
h
19
f3n([m+h]
+
):306.1464,测量值:306.1462。
[0172]
【实施例24】
[0173]
1)的制备
[0174]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol间甲基苯丙烯碳酸甲酯和0.20mmol1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0175]
2)的制备
[0176]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率94%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=254nm);t
r
=4.99and 5.66min.[α]
25d
=118.2(c 0.22,ch2cl2);1h nmr(400mhz,cdcl3)δ7.62(dd,j=7.5,1.8hz,2h),7.43
–
7.32(m,3h),7.14(d,j=8.2hz,2h),7.06(d,j=7.9hz,2h),6.45(d,j=15.6hz,1h),5.85(dt,j=15.6,7.4hz,1h),3.04(ddd,j=14.2,6.8,1.4hz,1h),2.82(ddd,j=14.2,8.0,1.2hz,1h),2.30(s,3h),1.83(s,2h).
113
c nmr(101mhz,cdcl3)δ137.7,137.4,135.0,133.9,129.2,128.4,128.2,127.0(d,j=285.5hz),126.8,126.1,121.4,40.2,21.1.
19
f nmr(376mhz,cdcl3)δ-77.45.;hrms(esi+)计算值c
18
h
19
f3n([m+h]
+
):306.1464,测量值:306.1466。
[0177]
【实施例25】
[0178]
1)的制备
[0179]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol对甲氧基苯丙烯碳酸甲酯和0.20mmol1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0180]
2)的制备
[0181]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率85%,产物的对映选择性过量97%,hplc(chiralpak id,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=6.35and 6.86min.[α]
25d
=105.0(c 0.16,ch2cl2);1h nmr(400mhz,cdcl3)δ7.66
–
7.58(m,2h),7.46
–
7.31(m,3h),7.23
–
7.14(m,2h),6.84
–
6.75(m,2h),6.65
–
6.29(m,1h),5.82
–
5.69(m,1h),3.78(s,3h),3.04(ddd,j=14.2,6.4,1.2hz,2h),2.82(ddd,j=14.2,8.0,1.2hz,1h),1.81(s,2h).
13
c nmr(101mhz,cdcl3)δ159.1,137.7,134.6,129.6,128.4,128.2,127.4,127.0(d,j=285.5hz),126.8,120.2,113.9,55.3,40.2.
19
f nmr(376mhz,
cdcl3)δ-77.45.;hrms(esi+)计算值c
18
h
19
f3no([m+h]
+
):322.1413,测量值:322.1412。
[0182]
【实施例26】
[0183]
1)的制备
[0184]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol对氯苯丙烯碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0185]
2)的制备
[0186]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率87%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=4.71and 6.46min.[α]
25d
=119.7(c 0.63,ch2cl2);1h nmr(400mhz,cdcl3)δ7.63
–
7.57(m,2h),7.43
–
7.33(m,3h),7.22
–
7.10(m,4h),6.41(dd,j=15.6,1.4hz,1h),5.88(dt,j=15.6,7.3hz,1h),3.04(ddd,j=14.3,6.8,1.5hz,1h),2.81(ddd,j=14.3,7.9,1.2hz,1h),1.82(s,2h).
13
c nmr(101mhz,cdcl3)δ137.4,135.2,133.7,133.1,128.6,128.4,128.2,127.4,126.9(q,j=285.3hz),126.7,123.4,61.3(q,j=25.7hz),40.1.
19
f nmr(376mhz,cdcl3)δ-77.57.;hrms(esi+)计算值c
17
h
16
clf3n([m+h]
+
):326.0918,测量值:326.0919。
[0187]
【实施例27】
[0188]
1)的制备
[0189]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol间氯苯丙烯碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0190]
2)的制备
[0191]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率94%,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=5.48and 6.88min.[α]
25d
=86.2(c 0.66,ch2cl2);1h nmr(400mhz,cdcl3)δ7.61(dd,j=7.5,1.8hz,2h),7.43
–
7.34(m,3h),7.21(q,j=1.4hz,1h),7.19
–
7.12(m,2h),7.09(ddd,j=6.1,3.1,1.7hz,1h),6.40(dt,j=15.6,1.4hz,1h),5.92(dt,j=15.6,7.5hz,1h),3.05(ddd,j=14.4,6.9,1.5hz,1h),2.82(ddd,j=14.4,7.9,1.3hz,1h),1.82(s,2h).
13
c nmr(101mhz,cdcl3)δ138.6,137.3,134.4,133.6,129.7,128.4,128.3,127.4,126.9(q,j=285.4hz),126.7,126.2,126.1,124.4,124.3,61.3(q,j=25.9hz),40.0.
19
f nmr(376mhz,cdcl3)δ-77.62.;hrms(esi+)计算值c
17
h
16
clf3n([m+h]
+
):326.0918,测量值:326.0923。
[0192]
【实施例28】
[0193]
1)的制备
[0194]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol对溴苯丙烯碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0195]
2)的制备
[0196]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率88%,产物的对映选择性过量96%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=5.63and 6.98min.[α]
25d
=116.0(c 0.42,ch2cl2);1h nmr(400mhz,cdcl3)δ7.61(d,j=7.3hz,2h),7.45
–
7.31(m,5h),7.14
–
7.05(m,2h),6.40(d,j=15.6hz,1h),5.90(dt,j=15.6,7.3hz,1h),3.04(ddd,j=14.3,6.8,1.5hz,1h),2.81(ddd,j=14.3,7.9,1.3hz,1h),1.82(s,2h).
13
c nmr(101mhz,cdcl3)δ137.4,135.6,133.8,131.5,128.4,128.3,127.7,126.9(q,j=285.4hz),126.7,123.5,121.2,61.3(q,j=25.9hz),40.1.
19
f nmr(376mhz,
cdcl3)δ-77.56.;hrms(esi+)计算值c
17
h
15
brf3n([m+h]
+
):370.0413,测量值:370.0416。
[0197]
【实施例29】
[0198]
1)的制备
[0199]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol 2-萘丙烯碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0200]
2)的制备
[0201]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到白色固体,产率85%,熔点80-82℃,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=260nm);t
r
=6.56and 7.86min.[α]
25d
=133.5(c 0.78,ch2cl2);1h nmr(400mhz,cdcl3)δ7.79
–
7.71(m,3h),7.71(d,j=8.6hz,1h),7.69
–
7.59(m,3h),7.48
–
7.33(m,6h),6.64(dd,j=15.8,1.4hz,1h),6.11
–
5.96(m,1h),3.12(ddd,j=14.4,6.8,1.5hz,1h),2.90(ddd,j=14.4,7.9,1.2hz,1h),1.86(s,2h).
13
c nmr(101mhz,cdcl3)δ137.6,135.2,134.2,133.4,132.9,128.4,128.2,128.1,127.9,127.6,127.0(q,j=284.4hz),126.8,126.3,126.0,125.8,123.4,123.0,61.4(q,j=25.4hz),40.3.
19
f nmr(376mhz,cdcl3)δ-77.47.;hrms(esi+)计算值c
21
h
19
f3n([m+h]
+
):342.1464,测量值:342.1467。
[0202]
【实施例30】
[0203]
1)的制备
[0204]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol 2-噻吩丙烯碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层
析纯化得到产物。
[0205]
2)的制备
[0206]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率76%,产物的对映选择性过量96%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=290nm);t
r
=5.59and 5.97min.[α]
25d
=94.8(c 0.27,ch2cl2);1h nmr(400mhz,cdcl3)δ7.61(ddd,j=8.1,1.8,1.0hz,2h),7.44
–
7.32(m,3h),7.08(dt,j=5.0,0.9hz,1h),6.90(dd,j=5.0,3.5hz,1h),6.88
–
6.83(m,1h),6.63
–
6.54(m,1h),5.74(dt,j=15.3,7.5hz,1h),3.05
–
2.96(m,1h),2.80(ddd,j=14.3,7.9,1.2hz,1h),1.82(s,2h).
13
c nmr(101mhz,cdcl3)δ141.8,137.5,128.4,128.2,128.1,127.2,126.9(q,j=285.4hz),126.7,125.3,124.0,122.2,61.3(q,j=25.7hz),40.1.
19
f nmr(376mhz,cdcl3)δ-77.45.;hrms(esi+)计算值c
15
h
15
f3ns([m+h]
+
):298.0872,测量值:298.0866。
[0207]
【实施例31】
[0208]
的制备
[0209]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol 3-吡啶丙烯碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率72%,产物的对映选择性过量97%,hplc(chiralpak ad-h,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=220nm);t
r
=8.82and 10.08min.[α]
25d
=168.4(c0.45,ch2cl2);1h nmr(400mhz,cdcl3)δ8.32(dd,j=4.8,1.6hz,1h),8.21(d,j=2.2hz,1h),7.95(d,j=7.4hz,1h),7.52(dd,j=11.8,7.1hz,4h),7.44
–
7.38(m,1h),7.37
–
7.29(m,5h),7.21(t,j=7.5hz,1h),7.04(ddd,j=7.9,4.8,0.8hz,1h),6.80
–
6.71(m,1h),6.25(d,j=7.9hz,1h),6.23
–
6.10(m,2h),3.67
–
3.54(m,2h).
13
c nmr(101mhz,cdcl3)δ165.1,148.1,147.9,144.9,140.7,139.0,137.6,132.6,132.5,131.5,131.4,129.7,128.7,128.6,128.5,127.9,127.3,127.0,126.8(d,j=285.2hz),123.4,123.1,120.0,119.0,70.6(q,j=25.1hz),36.9.
19
f nmr(376mhz,cdcl3)δ-77.25.;hrms(esi+)计算值c
29
h
22
f3n2([m+h]
+
):455.1730,测量值:455.1732。
[0210]
【实施例32】
[0211]
的制备
[0212]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基芴酮亚胺、0.22mmol巴豆基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色液体,产率50%,产物的对映选择性过量99%,hplc(chiralpak if-3,i-propanol/hexane=2/98,flow rate 1.0ml/min,λ=254nm);t
r
=7.07and 10.08min.[α]
25d
=71.1(c 0.94,ch2cl2);1h nmr(400mhz,cdcl3)δ7.96(d,j=7.4hz,1h),7.55
–
7.48(m,4h),7.42(d,j=7.4hz,1h),7.36
–
7.29(m,4h),7.21(t,j=7.5hz,1h),6.76(t,j=7.7hz,1h),6.24(d,j=7.9hz,1h),5.41(dt,j=14.8,7.3hz,1h),5.29
–
5.17(m,1h),3.35(t,j=6.5hz,2h),1.36(d,j=4.9hz,3h).
13
c nmr(101mhz,cdcl3)δ164.3,144.7,140.7,139.2,137.9,131.3,131.1,129.2,128.7,128.5,128.4,128.0,127.1,126.9(q,j=285.2hz),124.9,123.4,119.8,118.9,70.6(q,j=24.8hz),36.4,17.8.
19
f nmr(376mhz,cdcl3)δ-77.23.;hrms(esi+)计算值c
25
h
21
f3n([m+h]
+
):392.1621,测量值:392.1614。
[0213]
【实施例33】
[0214]
1)的制备
[0215]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.010mmol(s,s,s)-l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,加入2ml甲苯,依次加入0.20mmol n-2,2,2-三氟-1-苯基乙基芴酮亚胺、0.22mmol肉桂基碳酸甲酯和0.20mmol 1,8-二氮杂二环十一碳-7-烯,在50℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到产物。
[0216]
2)的制备
[0217]
将步骤1)得到的产物溶于1ml二氯乙烷中,加入醋酸羟胺的甲醇溶液(0.5m,1ml,由盐酸羟胺、氢氧化钠和醋酸在甲醇中制得),再在50℃下反应3小时。减压下除去溶剂之后通过硅胶(用三乙胺处理)柱层析纯化得到黄色固体,产率90%,熔点36-38℃,产物的对映选择性过量98%,hplc(chiralpak ie,i-propanol/hexane=5/95,flow rate 1.0ml/min,λ=254nm);t
r
=4.92and 5.62min.[α]
25d
=117.0(c 0.53,ch2cl2);1h nmr(400mhz,cdcl3)δ7.62(dd,j=7.6,1.7hz,2h),7.45
–
7.32(m,3h),7.24(d,j=3.6hz,4h),7.22
–
7.16(m,1h),6.48(dt,j=15.7,1.4hz,1h),5.96
–
5.84(m,1h),3.06(ddd,j=14.2,6.8,1.4hz,1h),2.83(ddd,j=14.2,8.0,1.2hz,1h),1.82(s,2h).
13
c nmr(101mhz,cdcl3)δ137.6,136.7,135.1,128.5,128.4,128.2,127.5,127.0(q,j=285.1hz),126.8,126.2,122.6,61.3(q,j=
25.8hz),40.2.
19
f nmr(376mhz,cdcl3)δ-77.51.;hrms(esi+)计算值c
17
h
17
f3n([m+h]
+
):292.1308,测量值:292.1304。
[0218]
3)的制备
[0219]
在25ml反应管中加入0.5mmol上述步骤2)制备的化合物1mmol nahco3和3ml乙腈并将反应管置于-20℃低温,加入1mmol i2反应12h后加入5ml二氯甲烷和2ml饱和硫代硫酸钠溶液淬灭反应。分液,水相使用二氯甲烷萃取后合并,蒸去溶剂,产物经硅胶柱层析(石油醚/乙酸乙酯5:1),得到淡黄色固体,产率95%,熔点62-64℃,产物的对映选择性过量97%,hplc(chiralpak od-h,i-propanol/hexane=3/97,flow rate 1.0ml/min,λ=260nm);t
r
=28.02and 32.50min.[α]
25d
=-3.4(c16.1,ch2cl2);1h nmr(400mhz,cdcl3)δ7.54(d,j=7.5hz,2h),7.41
–
7.36(m,2h),7.36
–
7.26(m,5h),4.56(dd,j=9.9,5.2hz,1h),3.66(td,j=10.4,8.0hz,1h),3.07
–
2.92(m,2h),2.53(d,j=5.4hz,1h).
13
c nmr(101mhz,cdcl3)δ139.2,138.7,128.6,128.4,128.3,127.5,127.2,127.0(d,j=297.9hz),72.1,68.5(q,j=27.2hz),47.0,25.1.
19
f nmr(376mhz,cdcl3)δ-77.02.;hrms(esi+)计算值c
17
h
16
f3in([m+h]
+
):418.0274,测量值:418.0264。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



