一种桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体及其制备方法与应用与流程
 2021-02-01 23:02:27|
2021-02-01 23:02:27| 252|
252| 起点商标网
起点商标网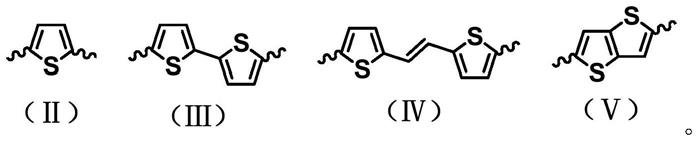
[0001]
本发明属于聚合物半导体材料领域,涉及一种桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体及其制备方法与应用。
背景技术:
[0002]
在过去的十年中,聚合物太阳电池(psc)在提高光电转换效率(pce)方面取得了显着进展,例如开发高性能聚合物给体单元,引入高效界面材料以及优化器件结构。尽管许多高性能的聚合物给体材料被报道,但是其中只有有限的几个是窄带隙(nbg,<1.60ev)聚合物。相比宽带隙和中带隙聚合物,窄带隙聚合物在近红外区域有强的和宽的吸收,这使得它们成为构建多组分和串联太阳能电池的重要组成部分。然而,大多数报道的窄带隙聚合物通常需要在器件制造过程中进行复杂的形貌工程和界面改性,这可能会限制它们的进一步应用。因此,设计合成新型的给体单元来开发新型高性能窄带隙聚合物是十分必要的。
[0003]
苯并二唑和吡啶二唑衍生物是一类富杂原子、电子亲和力强、共平面性好的电子受体单元,被广泛用于开发p-型有机小分子和聚合物半导体材料(j.am.chem.soc.,2013,135,2298;j.am.chem.soc.,2019,141,3566)。尽管苯并二唑和吡啶二唑衍生物材料在聚合物太阳能电池中取得了较高的光电转换效率,但该类衍生物材料中分子骨架只含有单一的苯并二唑和吡啶二唑衍生物受体单元。桥联不对称的苯并二唑类和/或吡啶二唑类双受体聚合物半导体材料未见报道。
技术实现要素:
[0004]
本发明的首要目的在于提供一种桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体,所述聚合物半导体材料光电转换效率和暗电流密度分别在7%以上和10-6
ma/cm2以下;
[0005]
本发明另一目的在于提供上述桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体的制备方法;
[0006]
本发明再一目的在于提供上述桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体在聚合物太阳电池和有机光探测器中的应用。
[0007]
本发明通过下述方案实现:
[0008]
一种桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体,具有如下所示式(i)结构:
[0009]
[0010]
所述式(i)中,n为10-300的整数,优选为50-150的整数,更优选为100。
[0011]
r为碳原子总数为6
–
16的直链烷基或碳原子总数为8
–
30的支链烷基中的一种;
[0012]
x为氧原子、硫原子、硒原子或碲原子中的一种;
[0013]
y为碳原子或氮原子中的一种;
[0014]
z为氟原子或氯原子中的一种;
[0015]
ar为以下式(ii)、式(iii)、式(iv)或式(
ⅴ
)所示结构中的一种,但不限于以下结构式;
[0016][0017]
优选的,所述r中,所述碳原子总数为6
–
16的直链烷基为正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基、正十三烷基、正十四烷基、正十五烷基或正十六烷基;所述碳原子总数为8
–
30的支链烷基为2-乙基己基,2-丁基己基、2-己基辛基、4-己基癸基、3-己基十一烷基、2-辛基癸基、2-辛基十二烷基、3-辛基十三烷基、2-癸基十二烷基、2-癸基十四烷基、3-癸基十五烷基、2-十二烷基十六烷基、4-辛基十四烷基、4-癸基十六烷基、4-辛基十二烷基、4-癸基十四烷基或4-十二烷基十六烷基;
[0018]
优选的,所述聚合物半导体为如下pbt-fbtt或pbt-ptt所示结构式中的一种:
[0019][0020]
所述pbt-fbtt和pbt-ptt中,n的定义与其在式(i)中的定义相同。
[0021]
一种制备上述桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体的方法,该方法包括如下步骤:
[0022]
(1)将2-三丁基锡基-4-烷基噻吩与二溴苯并二唑衍生物进行反应,得到中间体a,
[0023]
所述2-三丁基锡基-4-烷基噻吩的结构式为:
[0024][0025]
其中,r的定义与其在上述式(i)的定义相同;
[0026]
所述二溴苯并二唑衍生物结构式为:
[0027]
[0028]
其中,x为氧原子、硫原子、硒原子或碲原子;
[0029]
所述中间体a的结构式为:
[0030][0031]
其中,r的定义与其在上述式(i)的定义相同;
[0032]
(2)将2-三丁基锡基-4-烷基噻吩与二溴苯并二唑衍生物或二溴吡啶二唑衍生物进行反应,得到化合物b;
[0033]
所述2-三丁基锡基-4-烷基噻吩的结构式为:
[0034][0035]
其中,r的定义与其在上述式(i)的定义相同;
[0036]
所述二溴苯并二唑衍生物或二溴吡啶二唑衍生物结构式为:
[0037][0038]
其中,x、y和z的定义与其在上述式(i)的定义相同;
[0039]
当y为碳原子时结构式,为二溴苯并二唑衍生物;y为氮原子时,结构式为二溴吡啶二唑衍生物
[0040]
所述化合物b的结构式为:
[0041][0042]
其中,r、x、y和z的定义与其在上述式(i)的定义相同;
[0043]
(3)将化合物b与联硼酸频哪醇酯进行反应,得到化合物c;
[0044]
所述联硼酸频哪醇酯的结构式为:
[0045][0046]
所述中间体化合物c的结构式为:
[0047][0048]
其中,r、x、y和z的定义与其在上述式(i)的定义相同。
[0049]
(4)将中间体化合物a和中间体化合物c进行偶联反应,得到中间体化合物d,其结构式为:
[0050][0051]
其中,r、x、y和z的定义与其在上述式(i)的定义相同。
[0052]
(5)将间体化合物d和n-溴代丁二酰亚胺进行亲电反应,得到单体化合物m1,其结构式为:
[0053][0054]
(6)将单体化合物m1和双甲基锡基取代芳香杂环单体e置于溶剂中进行钯催化偶联反应,反应完毕得到聚合物半导体;
[0055]
其中双甲基锡基取代芳香杂环单体e的结构式为:
[0056][0057]
其中,ar的定义与其在式(i)的定义相同。
[0058]
优选地,上述一种桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体的制备方法,包括如下步骤:
[0059]
(1)将2-三丁基锡基-4-烷基噻吩、二溴苯并二唑衍生物、钯催化剂和溶剂混合均匀,然后回流搅拌反应1
–
10小时后,冷却至室温,反应液经纯化后得到中间体a;
[0060]
(2)将2-三丁基锡基-4-烷基噻吩、二溴苯并二唑衍生物或二溴吡啶二唑衍生物、钯催化剂和溶剂混合均匀,然后回流搅拌反应1
–
10小时后,冷却至室温,反应液经纯化后得到化合物b;
[0061]
(3)将化合物b、联硼酸频哪醇酯、钯催化剂和1,4-二氧六环溶剂混合均匀,然后回流搅拌反应1
–
10小时后,冷却至室温,反应液经纯化后得到化合物c。
[0062]
(4)将化合物a、化合物c、钯催化剂、碳酸钾水溶液和甲苯溶剂混合均匀,然后回流搅拌反应1
–
10小时后,冷却至室温,反应液经纯化后得到化合物d。
[0063]
(5)将三氯甲烷和化合物d混合均匀得到混合溶液,然后将其置于冰浴中,再将n-溴代丁二酰亚胺溶于n,n'-二甲基甲酰胺(dmf)后加入混合溶液,然后在室温搅拌反应5
–
24小时后,冷却至室温,反应液经纯化后得到单体化合物m1;
[0064]
(6)将单体化合物m1、双甲基锡基取代芳香杂环单体e、溶剂和钯催化剂混合均匀,然后在80~120℃回流搅拌反应10
–
72小时后,冷却至室温,反应液经纯化后得到最终产物。
[0065]
步骤(1)所述2-三丁基锡基-4-烷基噻吩优选为三丁基-[4-(2-癸基十四烷基)噻吩-2-基]烷锡;所述二溴苯并二唑衍生物为4,7-二溴-2,1,3-苯并噻二唑、4,7-二溴-5-氟-苯并噻二唑、4,7-二溴-5-氯-苯并噻二唑、4,7-二溴-5-氟-苯并硒二唑、4,7-二溴-5-氯-苯
并硒二唑、4,7-二溴-5-氟-苯并氮三唑和4,7-二溴-5-氯-苯并氮三唑中的一种。
[0066]
步骤(1)所述二溴苯并二唑衍生物:2-三丁基锡基-4-烷基噻吩:双(三苯基磷)二氯化钯的摩尔比为1:1-5:0.01-0.1,优选为1:1
–
2:0.01
–
0.1。
[0067]
步骤(2)所述二溴苯并二唑衍生物为4,7-二溴-5-氟-苯并噻二唑、4,7-二溴-5-氟-苯并噻二唑、4,7-二溴-5-氯-苯并噻二唑、4,7-二溴-5-氟-苯并硒二唑、4,7-二溴-5-氯-苯并硒二唑、4,7-二溴-5-氟-苯并氮三唑和4,7-二溴-5-氯-苯并氮三唑中的一种;所述二溴吡啶二唑衍生物为4,7-二溴-[1,2,5]噻二唑并[3,4-c]吡啶、4,7-二溴-[1,2,5]硒二唑并[3,4-c]吡啶和4,7-二溴-[1,2,5]氮三唑并[3,4-c]吡啶中的一种。
[0068]
步骤(2)所述二溴苯并二唑衍生物或二溴吡啶二唑衍生物:2-三丁基锡基-4-烷基噻吩:双(三苯基磷)二氯化钯的摩尔比为1:1-5:0.01-0.1,优选为1:1
–
2:0.01
–
0.1;
[0069]
步骤(1)和步骤(2)中所述溶剂独立地为甲苯、n,n'-二甲基甲酰胺和四氢呋喃中的至少一种。
[0070]
步骤(3)所述化合物b:联硼酸频哪醇酯:双(三苯基磷)二氯化钯的摩尔比为1:1-8:0.01-0.1,优选为1:2
–
3:0.01
–
0.1。
[0071]
步骤(4)所述中间体a:化合物c:双(三苯基磷)二氯化钯的摩尔比1:1-5:0.01-0.1,优选为1:1
–
1.2:0.01
–
0.1。
[0072]
步骤(5)所述化合物d:n-溴代丁二酰亚胺的摩尔比为1:1-8,优选为1:2.0
–
3.0。
[0073]
步骤(6)所述单体化合物m1、双甲基锡基取代芳香杂环单体e和钯催化剂的摩尔比为1:1-5:0.01-0.1,优选为1:1
–
1.2:0.01
–
0.1,更优选为1:1:0.05。
[0074]
步骤(6)所述溶剂选自甲苯、二甲苯、甲基萘、氯苯、二氯苯、二氯萘、三氯苯、氯萘和四氢呋喃中的至少一种,优选氯苯。
[0075]
优选的,步骤(6)所述回流搅拌反应温度为120℃,反应时间为48小时;
[0076]
步骤(1)~步骤(6)中,所述钯催化剂选自四(三苯基膦)钯、醋酸钯、二(三苯基膦)二氯化钯和三(二亚苄基丙酮)二钯中的至少一种,优选为双(三苯基磷)二氯化钯;
[0077]
步骤(1)~(5)中所述纯化为将反应液采用二氯甲烷萃取,然后将有机相用硫酸镁干燥,旋干溶剂得粗产品,然后采用硅胶色谱柱提纯,即可分别得到橘色油状液体中间体a,橘色油状液体中间体b,红色固体中间体c,红色固体中间体d和单体化合物m1。
[0078]
步骤(6)所述纯化为将反应液沉降于甲醇中,抽滤,收集蓝褐色固体,再采用索式抽提器提纯目标聚合物,旋干溶剂得金色光泽的黑色固体产物。
[0079]
本发明所述制备方法优选为在保护性气体下进行。
[0080]
上述桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体材料在制备聚合物太阳电池和有机光探测器中的应用。
[0081]
本发明的优点在于:
[0082]
1、合成方法具有合成方法普适性强、合成路线简短、合成产率高、反应原料易得等优点,可以推广应用工业中的放大合成与生产;
[0083]
2、该类聚合物分子主链具有杂原子的大π共轭骨架,可增强分子链间的π
–
π相互作用,提高载流子迁移率。
[0084]
3、在聚合物主链中双电子受体可增强聚合物重复单元的缺电密度,提高分子链的电子亲和力,赋予该类材料有理想的能级结构;
[0085]
4、本发明所构造的聚合物半导体材料可通过控制给体的给电子能力,进而调控聚合物分子链间的组装能力、光谱吸收、能级结构,这样有利于开发出综合性能优异的聚合物半导体材料;
[0086]
5、本发明所构造的聚合物半导体材料制备的器件性能优于桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物材料,充分展示了桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体材料的优点;
[0087]
6、本发明专利报道的一系列桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体材料在有机光伏、逻辑互补电路、有机光探测器、有机场效应晶体管、有机发光二极管等有机电子领域中具有广阔的商业前景。
[0088]
7、本发明所得桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体作为器件活性层,其聚合物太阳电池的能量转换效率在7%以上,有机光探测器的暗电流密度在10-6
ma/cm2以下,并且其性能优于桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物材料。
附图说明
[0089]
图1为实施例1制备所得桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物pbt-fbtt在氯仿溶液和石英片上固态薄膜的吸收光谱。
[0090]
图2为实施例2制备所得桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物pbt-ptt在氯仿溶液和石英片上固态薄膜的吸收光谱。
[0091]
图3为以实施例1和实施例2制备所得桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物pbt-fbtt和pbt-ptt为有机活性半导体层的聚合物太阳能电池器件和有机光探测器件的结构示意图。
[0092]
图4为以实施例1和实施例2制备所得桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物pbt-fbtt和pbt-ptt以及对比例1所得桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物pbptt为有机活性半导体层的聚合物太阳能电池的j
–
v曲线。
[0093]
图5为以实施例1和实施例2制备所得桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物pbt-fbtt和pbt-ptt以及对比例1所得桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物pbptt为有机活性半导体层的有机光探测器的j
–
v曲线。
[0094]
图6为对比例1所得桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物pbptt在氯仿溶液和石英片上固态薄膜的吸收光谱。
具体实施方式
[0095]
下面结合具体实施例和附图对本发明作进一步阐述,但本发明并不限于以下实施例。所述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径获得。下述实施例中所用的反应底物4,7-二溴-2,1,3-苯并噻二唑、4,7-二溴-5-氟-苯并噻二唑、4,7-二溴-[1,2,5]噻二唑并[3,4-c]吡啶和2,5-双(三甲基锡基)噻吩都可从商业途径得到,其余所用反应溶剂和催化剂均可从商业途径得到。
[0096]
实施例1
[0097]
一种化学结构为pbt-fbtt的聚合物半导体材料,其合成路线如下所示:
[0098][0099]
(1)化学结构式为a的中间体的合成:氮气保护下,向三口瓶中加入三丁基-[4-(2-癸基十四烷基)噻吩-2-基]烷锡(苏州纳凯科技有限公司购买)(5.8g,8.2mmol)、4,7-二溴-2,1,3-苯并噻二唑(2.0g,6.8mmol)、双(三苯基磷)二氯化钯(0.24g,0.34mmol)催化剂、70ml甲苯溶剂。回流4小时后,冷却至室温。采用二氯甲烷萃取,有机相用硫酸镁干燥,旋干溶剂得粗产品。然后采用硅胶色谱柱提纯得目标产物4-溴-7-(4-(2-癸基十四烷基)噻吩-2-基)-苯[c][1,2,5]噻唑,产率=85%。
[0100]
结构表征数据如下,
[0101]1h nmr(400mhz,cdcl3),δ(ppm):8.66(s,1h),8.53(s,1h),7.24(d,1h),7.22(d,1h),2.65
–
2.64(d,2h),1.70(br,1h),1.30
–
1.24(m,40h),0.89-0.85(m,6h);
[0102]
maldi-tof-ms:m/z=633.83(m
+
).
[0103]
由上可知,该化合物结构正确,为所示化合物4-溴-7-(4-(2-癸基十四烷基)噻吩-2-基)-苯[c][1,2,5]噻唑。
[0104]
(2)化学结构式为b的中间体的合成:氮气保护下,向三口瓶中加入三丁基-[4-(2-癸基十四烷基)噻吩-2-基]烷锡(5.6g,8.2mmol)、4,7-二溴-5-氟-苯并噻二唑(2.0g,6.8mmol)、双(三苯基磷)二氯化钯(0.24g,0.34mmol)催化剂、70ml甲苯溶剂。回流4小时后,冷却至室温。采用二氯甲烷萃取,有机相用硫酸镁干燥,旋干溶剂得粗产品。然后采用硅胶色谱柱提纯得目标产物4-溴-7-(4-(2-癸基十四烷基)噻吩-2-基)-5-氟苯[c][1,2,5]噻唑,产率=86%。
[0105]
结构表征数据如下,
[0106]1h nmr(400mhz,cdcl3),δ(ppm):8.68(s,1h),8.63(s,1h),7.22(d,1h),,2.65
–
2.64(d,2h),1.70(br,1h),1.30
–
1.24(m,40h),0.89-0.85(m,6h);
[0107]
maldi-tof-ms:m/z=651.83(m
+
).
[0108]
由上可知,该化合物结构正确,为所示化合物4-溴-7-(4-(2-癸基十四烷基)噻吩-2-基)-5-氟苯[c][1,2,5]噻唑。
[0109]
(3)化学结构式为c的中间体的合成:氮气保护下,向三口瓶中加入化合物b(5.6g,8.2mmol)、联硼酸频那醇酯(15g,16.8mmol)、双(三苯基磷)二氯化钯(0.24g,0.34mmol)催化剂、乙酸钾(12g,16.8mmol)、70ml的1,4-二氧六环溶剂。回流4小时后,冷却至室温。采用二氯甲烷萃取,有机相用硫酸镁干燥,旋干溶剂得粗产品。然后采用硅胶色谱柱提纯得目标产物7-(4-(2-癸基十四烷基)噻吩-2-基)-5-氟-4-(4,4,5,5-三甲基-1,3,2-二氧硼烷-2-基)苯[c][1,2,5]噻唑,产率=80%。
[0110]
结构表征数据如下,
[0111]1h nmr(400mhz,cdcl3),δ(ppm):8.66(s,1h),8.61(s,1h),7.27(d,1h),2.65
–
2.64(d,2h),1.70(br,1h),1.30
–
1.24(m,40h),0.89-0.85(m,18h);
[0112]
maldi-tof-ms:m/z=698.89(m
+
).
[0113]
由上可知,该化合物结构正确,为所示化合物7-(4-(2-癸基十四烷基)噻吩-2-基)-5-氟-4-(4,4,5,5-三甲基-1,3,2-二氧硼烷-2-基)苯[c][1,2,5]噻唑。
[0114]
(4)化学结构式为d的中间体的合成::往25ml的三口瓶中,依次加入化合物a(2g,3.1mmol)、化合物c(1.97g,3.2mmol)、双(三苯基磷)二氯化钯(4mg,0.006mmol)、2m的碳酸钾溶液2ml和30ml甲苯溶液。回流24小时后,冷却至室温。采用二氯甲烷萃取,有机相用无水硫酸镁干燥,旋干溶剂得粗产品。采用硅胶色谱柱提纯得目标产物7,7
’-
双(2-癸基十四烷基)噻吩-2-基)-5-氟-4,4
’-
苯[c][1,2,5]噻唑,产率=80%。
[0115]
结构表征数据如下,
[0116]1h nmr(400mhz,cdcl3),δ(ppm):9.44(s,1h),8.63(s,1h),8.25(s,1h),,7.25(s,2h),7.22(s,2h),2.69-2.67(d,4h),1.74(br,2h),1.33
–
1.25(m,80h),0.87-0.85(t,12h);
[0117]
maldi-tof-ms:m/z=1125.85(m
+
).
[0118]
由上可知,该化合物结构正确,为所示化合物7,7
’-
双(2-癸基十四烷基)噻吩-2-基)-5-氟-4,4
’-
苯[c][1,2,5]噻唑。
[0119]
(5)化学结构式为m1的单体的合成:氮气保护下,向三口瓶中加入20ml的三氯甲烷、10ml的乙酸溶剂和化合物d(0.35g,0.3mmol)。将其置于冰浴中,用注射器将溶有n-溴代丁二酰亚胺(nbs,0.14g,0.8mmol)的n,n'-二甲基甲酰胺(dmf)溶液4ml缓慢加入到反应中。滴加完后室温搅拌反应8小时后,采用二氯甲烷萃取,有机相用无水硫酸镁干燥,旋干溶剂得粗产品。采用硅胶色谱柱提纯得目标产物7,7
’-
双(5-溴-4-(2-癸基十四烷基)噻吩-2-基)-5-氟-4,4
’-
苯[c][1,2,5]噻唑,产率=90%。
[0120]
结构表征数据如下,
[0121]1h nmr(400mhz,cdcl3),δ(ppm):9.47(s,1h),8.66(s,1h),8.27(s,1h),,7.25(s,1h),7.24(s,1h),2.69-2.67(d,4h),1.74(br,2h),1.33
–
1.25(m,80h),0.87-0.85(t,12h);
[0122]
maldi-tof-ms:m/z=1283.64(m
+
).
[0123]
由上可知,该化合物结构正确,为实施例1所用式m1所示共聚单体化合物7,7
’-
双(5-溴-4-(2-癸基十四烷基)噻吩-2-基)-5-氟-4,4
’-
苯[c][1,2,5]噻唑。
[0124]
(6)化学结构式为式(i)所示聚合物pbt-fbtt的合成:往25ml的三口瓶中,依次加入式m1所示单体化合物7,7
’-
双(5-溴-4-(2-癸基十四烷基)噻吩-2-基)-5-氟-4,4
’-
苯[c]
2-基)-[1,2,5]噻唑[3,4-c]吡啶。
[0135]
(3)化学结构式为c的中间体的合成:氮气保护下,向三口瓶中加入化合物b(5.6g,8.2mmol)、联硼酸频那醇酯(15g,16.8mmol)、双(三苯基磷)二氯化钯(0.24g,0.34mmol)催化剂、乙酸钾(12.1g,16.8mmol)、70ml的1,4-二氧六环溶剂。回流4小时后,冷却至室温。采用二氯甲烷萃取,有机相用硫酸镁干燥,旋干溶剂得粗产品。然后采用硅胶色谱柱提纯得目标产物4-(4-(2-癸基十四烷基)噻吩-2-基)-7-(4,4,5,5-三甲基-1,3,2-二氧硼烷-2-基)-[1,2,5]噻唑[3,4-c]吡啶,产率=82%。
[0136]
结构表征数据如下,
[0137]1h nmr(400mhz,cdcl3),δ(ppm):8.69(s,1h),8.62(s,1h),7.23(d,1h),2.65
–
2.64(d,2h),1.70(br,1h),1.30
–
1.24(m,40h),0.89-0.85(m,18h);
[0138]
maldi-tof-ms:m/z=681.89(m
+
).
[0139]
由上可知,该化合物结构正确,为所示化合物4-(4-(2-癸基十四烷基)噻吩-2-基)-7-(4,4,5,5-三甲基-1,3,2-二氧硼烷-2-基)-[1,2,5]噻唑[3,4-c]吡啶。
[0140]
(4)化学结构式为d的中间体的合成::往25ml的三口瓶中,依次加入化合物a(2g,3.1mmol)、化合物c(2.6g,3.2mmol)、双(三苯基磷)二氯化钯(4mg,0.006mmol)、2m的碳酸钾溶液2ml和30ml甲苯溶液。回流24小时后,冷却至室温。采用二氯甲烷萃取,有机相用无水硫酸镁干燥,旋干溶剂得粗产品。采用硅胶色谱柱提纯得目标产物4-(4-(2-癸基十四烷基)噻吩-2-基)-7-(4-(2-癸基十四烷基)噻吩-2-基)苯[c][1,2,5]噻唑-4-基)-[1,2,5]噻唑[3,4-c]吡啶,产率=85%。
[0141]
结构表征数据如下,
[0142]1h nmr(400mhz,cdcl3),δ(ppm):9.67(s,1h),8.58(s,1h),8.21(s,1h),,7.28(s,2h),7.22(s,2h),2.69-2.67(d,4h),1.74(br,2h),1.33
–
1.25(m,80h),0.87-0.85(t,12h);
[0143]
maldi-tof-ms:m/z=1108.84(m
+
).
[0144]
由上可知,该化合物结构正确,为所示化合物4-(4-(2-癸基十四烷基)噻吩-2-基)-7-(4-(2-癸基十四烷基)噻吩-2-基)苯[c][1,2,5]噻唑-4-基)-[1,2,5]噻唑[3,4-c]吡啶。
[0145]
(5)化学结构式为m1的单体的合成:氮气保护下,向三口瓶中加入20ml的三氯甲烷、10ml的乙酸溶剂和化合物d(0.35g,0.3mmol)。将其置于冰浴中,用注射器将溶有n-溴代丁二酰亚胺(nbs,0.14g,0.8mmol)的n,n'-二甲基甲酰胺(dmf)溶液4ml缓慢加入到反应中。滴加完后室温搅拌反应8小时后,采用二氯甲烷萃取,有机相用无水硫酸镁干燥,旋干溶剂得粗产品。采用硅胶色谱柱提纯得目标产物4-(5-溴-4-(2-癸基十四烷基)噻吩-2-基)-7-(7-(5-溴-4-(2-癸基十四烷基)噻吩-2-基)苯[c][1,2,5]噻唑-4-基)-[1,2,5]噻唑[3,4-c]吡啶,产率=90%。
[0146]
结构表征数据如下,
[0147]1h nmr(400mhz,cdcl3),δ(ppm):9.42(s,1h),8.68(s,1h),8.24(s,1h),,7.22(s,1h),7.21(s,1h),2.69-2.67(d,4h),1.74(br,2h),1.33
–
1.25(m,80h),0.87-0.85(t,12h);
[0148]
maldi-tof-ms:m/z=1266.64(m
+
).
[0149]
由上可知,该化合物结构正确,为实施例1所用式m1所示共聚单体化合物4-(5-溴-4-(2-癸基十四烷基)噻吩-2-基)-7-(7-(5-溴-4-(2-癸基十四烷基)噻吩-2-基)苯[c][1,
2,5]噻唑-4-基)-[1,2,5]噻唑[3,4-c]吡啶。
[0150]
(6)化学结构式为式(i)所示聚合物pbt-fbtt的合成:往25ml的三口瓶中,依次加入式m1所示单体化合物7,7
’-
双(5-溴-4-(2-癸基十四烷基)噻吩-2-基)-5-氟-4,4
’-
苯[c][1,2,5]噻唑(256mg,0.2mmol),2,5-双(三甲基锡基)噻吩(82mg,0.2mmol)、双(三苯基磷)二氯化钯(7mg,0.01mmol)和氯苯(5ml)加入到反应瓶中,在氩气中进行三次冷冻-抽气-解冻循环除氧,然后将反应混合物加热到120℃反应48h。冷却后,加入200ml甲醇,室温下搅拌2h,过滤。得到的聚合物装入索氏提取器抽提。先用甲醇、丙酮、正己烷抽提至无色,除去小分子和催化剂,再用三氯甲烷提取得到最终产物,产率=90%。
[0151]
所得聚合物的分子量表征数据如下:重均分子量为48.2kda,数均分子量为23.1kda,聚合物分子量分布指数为2.10。
[0152]
上述实施例1和2制备所得聚合物pbt-fbtt和pbt-ptt的光谱性质以及聚合物太阳电池和有机光探测器性质的测定:
[0153]
(1)聚合物pbt-fbtt和pbt-ptt的吸收光谱性质
[0154]
图1为聚合物pbt-fbtt在氯苯溶液和石英片上薄膜的紫外
–
可见
–
近红外吸收光谱。由图1可知,聚合物pbt-fbtt溶液和薄膜均展现出宽的吸收范围,其薄膜吸收最大吸收边带值都为835nm左右,相应的光学带隙为1.49ev(光学带隙根据公式e
g
=1240/λ计算,其中e
g
为光学带隙,λ为薄膜吸收最大吸收边带值)。
[0155]
图2为聚合物pbt-ptt在氯苯溶液和石英片上薄膜的紫外
–
可见
–
近红外吸收光谱。由图2可知,聚合物pbt-ptt溶液和薄膜均展现出宽的吸收范围,其薄膜吸收最大吸收边带值都为850nm左右,相应的光学带隙为1.45ev(光学带隙根据公式e
g
=1240/λ计算,其中e
g
为光学带隙,λ为薄膜吸收最大吸收边带值)。
[0156]
(2)聚合物pbt-fbtt和pbt-ptt的聚合物太阳电池性能测定
[0157]
本发明采用本体异质结聚合物太阳电池结构研究聚合物薄膜的半导体特性,其器件结构如图3所示。其详细器件构造程序参照文献完成(adv.mater.,2017,7,1602127)。取预先做好的方块电阻为10ω的氧化铟锡(ito)玻璃,依次用丙酮、洗涤剂、去离子水和异丙醇超声清洗,等离子处理10分钟;在ito上旋涂参杂有聚苯乙烯磺酸(pss)的聚乙氧基噻吩(pedot)(pedot:pss=1:6,w/w)膜,将厚度为30nm pedot:pss膜在真空烘箱里80℃下干燥8小时;随后将polymer:pc
71
bm=1:1.5w/w(polymer为:pbt-fbtt或pbt-ptt,pc
71
bm为[6,6]-苯基c
71
丁酸甲酯)的氯苯溶液(2wt.%)旋涂在pedot:pss膜的表面,厚度为100nm,作为活性层;最后在活性层上依次蒸镀一层10nm厚的钙和100nm厚的金属al层,器件结构:ito/pedot:pss/polymer:pc
71
bm/ca/al。在500w氙灯与am 1.5的滤光片组合的模拟太阳光光源(光强为100mw/cm2)下,用keithley 2602数字源表进行j
–
v曲线测量,其曲线如图4所示。测试结果如图4所示:聚合物pbt-fbtt短路电流j
sc
为14.35ma/cm2,开路电压v
oc
为0.85v,填充因子ff为0.60,由此计算出电池的能量转换效率为7.3%;聚合物pbt-ptt短路电流j
sc
为14.78ma/cm2,开路电压v
oc
为0.93v,填充因子ff为0.70,由此计算出电池的能量转换效率为9.6%。
[0158]
(3)聚合物pbt-fbtt和pbt-ptt的有机光探测器性能测定
[0159]
本发明采用如图3所示器件结构研究聚合物薄膜在有机光探测器中的半导体特性。其器件制备方法与聚合物太阳电池一致,具体如下:取预先做好的方块电阻为10ω的氧
化铟锡(ito)玻璃,依次用丙酮、洗涤剂、去离子水和异丙醇超声清洗,等离子处理10分钟;在ito上旋涂参杂有聚苯乙烯磺酸的聚乙氧基噻吩(pedot:pss=1:6,w/w)膜,厚度为30nm pedot:pss膜在真空烘箱里80
°ꢀ
c下干燥8小时;随后将polymer:pc
71
bm=1:1.5w/w的氯苯溶液(2wt.%)旋涂在pedot:pss膜的表面,厚度为100nm,作为活性层;最后在活性层上依次蒸镀一层10nm厚的ca和100nm厚的金属al层,器件结构:ito/pedot:pss/polymer:pc
71
bm/ca/al。器件的电流电压数据有电流电压源(keithley 2602)在650nm的光照下得到,其曲线如图5所示。测试结果如图5所示:以聚合物pbt-fbtt为活性层的器件在-1v下的暗电流j
sc
为1.11
×
10-7
ma/cm2;以聚合物pbt-ptt为活性层的器件在-1v下的暗电流j
sc
为1.04
×
10-6
ma/cm2。
[0160]
对比例1
[0161]
选取桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物材料pbptt与其桥联不对称的苯并二唑类和/或吡啶二唑类双受体聚合物pbt-fbtt和pbt-ptt的性能进行对比。其中聚合物pbptt的合成路线如下所示,单体bpt-br的合成参照文献(j.am.chem.soc.,2017,139,17735-17738.)制备;
[0162][0163]
往25ml的三口瓶中,依次加入式bpt-br所示单体化合物4,4
’-
双(5-溴-4-(2-癸基十四烷基)噻吩-2-基)-7,7
’-
二[1,2,5]噻唑[3,4-c]吡啶(256mg,0.2mmol),2,5-双(三甲基锡基)噻吩(82mg,0.2mmol)、双(三苯基磷)二氯化钯(7mg,0.01mmol)和氯苯(5ml)加入到反应瓶中,在氩气中进行三次冷冻-抽气-解冻循环除氧,然后将反应混合物加热到120℃反应48h。冷却后,加入200ml甲醇,室温下搅拌2h,过滤后将得到的聚合物装入索氏提取器抽提。先用甲醇、丙酮、正己烷抽提至无色,除去小分子和催化剂,再用三氯甲烷提取得到最终产物pbptt,产率=94%。
[0164]
所得聚合物的分子量表征数据如下:重均分子量为46.2kda,数均分子量为21.1kda,聚合物分子量分布指数为2.19。
[0165]
(1)聚合物吸收光谱对比,
[0166]
图6为聚合物pbptt在氯苯溶液和石英片上薄膜的紫外
–
可见
–
近红外吸收光谱。由图6可知,聚合物pbptt溶液和薄膜均展现出宽的吸收范围,其薄膜吸收最大吸收边带值都为823nm左右,相应的光学带隙为1.50ev(光学带隙根据公式e
g
=1240/λ计算,其中e
g
为光学带隙,λ为薄膜吸收最大吸收边带值)。结果表明:桥联不对称的苯并二唑类和/或吡啶二唑类双受体聚合物半导体材料的光学带隙小于桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物材料。
[0167]
(2)聚合物太阳电池性能对比,
[0168]
聚合物pbptt的器件构造和测试方法与上述聚合物pbt-fbtt和pbt-ptt的方法相同。
[0169][0170]
测试结果如图4所示:聚合物pbptt短路电流j
sc
为12.51ma/cm2,开路电压v
oc
为0.83v,填充因子ff为0.50,由此计算出电池的能量转换效率为5.2%。结果表明:桥联不对称的苯并二唑类和/或吡啶二唑类双受体聚合物半导体材料在聚合物太阳电池中的性能优于桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物材料。
[0171]
(3)有机光探测器性能对比
[0172]
聚合物pbptt的器件构造和测试方法与上述聚合物pbt-fbtt和pbt-ptt的方法相同。
[0173]
测试结果如图5所示:以聚合物pbt-fbtt为活性层的器件在-1v下的暗电流j
sc
为3.97
×
10-6
ma/cm2。结果表明:桥联不对称的苯并二唑类和/或吡啶二唑类双受体聚合物半导体材料在有机光探测器中的性能优于桥联对称的双苯并二唑类或双吡啶二唑类双受体聚合物材料。
[0174]
此外,所得研究结果证实:本发明提供的式(i)所示一种桥联不对称的苯并二唑类和/或吡啶二唑类双受体聚合物半导体是一类综合性能优异的共轭聚合物;该类聚合物半导体材料具有大的共平面骨架、强的杂原子作用、等规的分子链骨架和良好溶液加工性能;并且该类材料在聚合物太阳电池和有机光探测器中的器件性能优于其桥联对称的苯并二唑类或吡啶二唑类双受体聚合物半导体材料的性能。本发明所提供的制备方法简单有效、原料易得以及推广性强等优势。通过改变不同的助溶烷基链、杂原子取代和共聚单元,可制备出系列的综合性能优异的桥联不对称的苯并二唑类和/或吡啶二唑类双受体的聚合物半导体材料,这对于研究聚合物半导体结构与性能之间的内在关联具有非常重要的意义,对今后开发高性能的桥联不对称的聚合物半导体材料具有指导意义。
[0175]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



