一种手性α-氟代酮化合物的制备方法与流程
 2021-02-01 22:02:17|
2021-02-01 22:02:17| 360|
360| 起点商标网
起点商标网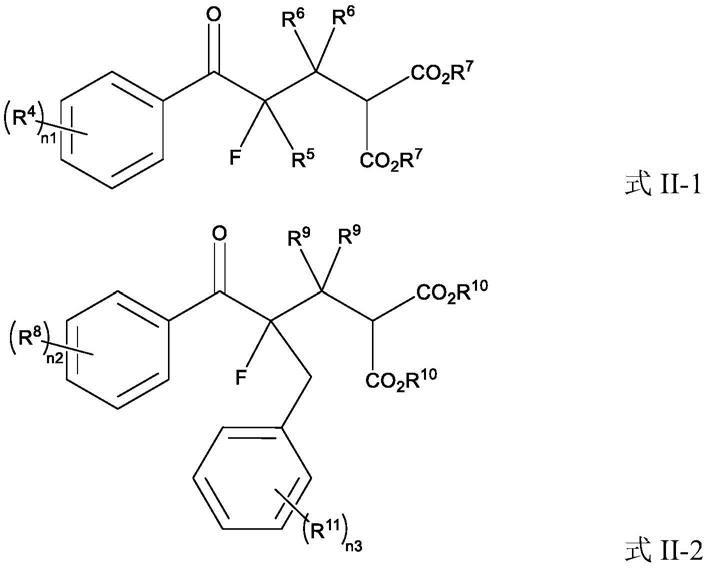
一种手性
α-氟代酮化合物的制备方法
技术领域
[0001]
本申请涉及一种手性α-氟代酮化合物的制备方法,属于有机合成领域。
背景技术:
[0002]
含氟药物的合成及研究是生命科学领域重要的研究方向。研究表明,由于氟原子独特的物理化学性质,在生物活性化合物的某一特定位置引入氟原子,其生理活性可以明显提高;氟在药物分子中的存在可以增强结合力、改变理化性质、提高代谢稳定性和反应选择性等;并且由于碳-氟键的键能大,手性α-氟代酮化合物是手性α-羟基酮的有效类似物,也是酶代谢和吲哚生物合成等多种生物学过程的理想探针。因此近年来,有机氟化合物的研究引起了化学家们的广泛关注。
[0003]
尽管化学家们发展了一系列方法来制备手性α-氟代酮,但是大多数方法只能制备三取代手性α-氟代酮、手性α-氟代环状酮或手性α-氟代-β-酮酸酯等,而对于四取代手性α-氟代链状酮的制备则鲜有报道。因此,开发一种直接且简便易行的方法来制备四取代手性α-氟代酮具有重要意义。然而到目前为止,这一领域的研究甚少。
技术实现要素:
[0004]
根据本申请的一个方面,提供了一种手性α-氟代酮化合物的制备方法,该方法以手性n-杂环卡宾(nhc)作为催化剂,以消旋α-氟代酮化合物、烯醛化合物作为起始原料,通过实现动力学拆分,制备得到手性α-氟代酮的核心骨架。
[0005]
所述手性α-氟代酮化合物i的制备方法,其特征在于,在催化剂的存在下,使消旋α-氟代酮化合物ii和烯醛化合物iii发生动力学拆分,制备所述手性α-氟代酮化合物i;
[0006]
所述催化剂选自手性n-杂环卡宾化合物中的至少一种;
[0007]
所述手性α-氟代酮化合物i选自含有式i所示结构单元的化合物中的至少一种:
[0008][0009]
所述消旋α-氟代酮化合物ii选自含有式ii所示结构单元的化合物中的至少一种:
[0010]
[0011]
所述烯醛化合物iii选自含有式iii所示结构单元的化合物中的至少一种:
[0012][0013]
其中,r1、r2和r3独立地选自氢、烃基、取代烃基、杂芳基、取代杂芳基和非烃类取代基i中的一种。
[0014]
优选地,r1、r2和r3独立地选自氢、c1~c
20
烃基、c1~c
20
取代烃基和非烃类取代基i中的一种。
[0015]
可选地,所述手性α-氟代酮化合物i选自含有式i-1所示结构单元的化合物中的至少一种:
[0016][0017]
其中,r1和r2独立地选自氢、烷基和烯基中的一种。
[0018]
可选地,所述消旋α-氟代酮化合物ii选自具有式ii-1所示结构式的化合物和具有式ii-2所示结构式的化合物中的至少一种:
[0019][0020]
其中,r5、r6、r7、r9和r
10
独立地选自氢、烃基、取代烃基、杂芳基、取代杂芳基和非烃类取代基i中的一种;
[0021]
r4、r8和r
11
独立地选自烃基中的一种;
[0022]
n1、n2和n3独立地选自0、1、2、3、4或5。
[0023]
优选地,r6和r9为氢;r4、r8和r
11
独立地选自c1~c
20
烷基。
[0024]
优选地,r5、r7和r
10
独立地选自氢、c1~c
20
烃基、c1~c
20
取代烃基和非烃类取代基i中的一种。
[0025]
进一步优选地,r5选自c1~c
10
烷基和c2~c
10
烯基;n1、n2和n3均为0。
[0026]
在一个优选的实施方案中,所述消旋α-氟代酮化合物ii为具有式ii-1所示结构式的化合物,其中r5选自c1~c2烷基或c2~c3烯基,r6为氢,r7为甲基,n1为0。
[0027]
在一个优选的实施方案中,所述消旋α-氟代酮化合物ii为具有式ii-2所示结构式的化合物,其中r9为氢,r
10
为甲基,n2和n3均为0。
[0028]
可选地,所述烯醛化合物iii选自具有式iii-1所示结构式的化合物和具有式iii-2所示结构式的化合物中的至少一种:
[0029][0030]
其中,r
12
和r
15
独立地选自烃基、取代烃基、杂芳基、取代杂芳基和非烃类取代基i中的一种;
[0031]
r
13
、r
14
、r
16
和r
17
独立地选自氢、烃基、取代烃基、杂芳基、取代杂芳基和非烃类取代基i中的一种;
[0032]
n4和n5独立地选自0、1、2、3、4或5。
[0033]
优选地,r
12
和r
15
独立地选自c1~c
20
烃基、c1~c
20
取代烃基和非烃类取代基i中的一种;
[0034]
r
13
、r
14
、r
16
和r
17
独立地选自氢、c1~c
20
烃基、c1~c
20
取代烃基和非烃类取代基i中的一种。
[0035]
优选地,r
12
和r
15
独立地选自c1~c
20
烷基;r
13
、r
14
、r
16
和r
17
独立地选自氢和c1~c
20
烷基中的一种。
[0036]
进一步优选地,r
12
和r
15
独立地选自c1~c
10
烷基;r
13
、r
14
、r
16
和r
17
独立地选自氢和c1~c
10
烷基中的一种;n4和n5均为0。
[0037]
在一个优选的实施方案中,所述烯醛化合物iii为具有式iii-1所示结构式的化合物,其中r
13
和r
14
为氢,n4为0。
[0038]
在一个优选的实施方案中,所述烯醛化合物iii为具有式iii-2所示结构式的化合物,其中r
16
和r
17
为氢,n5为0。
[0039]
可选地,所述非烃类取代基i选自卤素、具有式(1)所示结构式的基团、具有式(2)
所示结构式的基团、具有式(3)所示结构式的基团和具有式(4)所示结构式的基团中的至少一种:
[0040][0041]
其中,m
11
、m
21
、m
31
和m
41
独立地选自氢、c1~c
10
烷基。
[0042]
可选地,所述取代烃基和所述取代杂芳基中的取代基为非烃类取代基ii。
[0043]
优选地,所述非烃类取代基ii选自氧、所述非烃类取代基i。
[0044]
可选地,所述手性n-杂环卡宾化合物选自具有如下所示结构式的化合物中的至少一种:
[0045][0046]
可选地,所述动力学拆分的反应体系中还包含碱和氧化剂。
[0047]
在本申请中,对于所述氧化剂的种类没有特别限制,本领域技术人员可根据实际需要选择合适的氧化剂。
[0048]
可选地,所述氧化剂选自基于联苯醌的化合物中的至少一种。
[0049]
优选地,所述氧化剂选自4,4'-联苯醌、3,3',5,5'-四叔丁基-4,4'-联苯醌、3,5-二甲基-3',5'-二叔丁基-4,4'-联苯醌、3,3'-二甲基-5,5'-二叔丁基联苯醌和3,3'5,5'-四甲基-4,4'-联苯醌中的至少一种。
[0050]
进一步优选地,所述氧化剂为3,3',5,5'-四叔丁基-4,4'-联苯醌。
[0051]
在本申请中,对于所述碱的种类没有特别限制,本领域技术人员可根据实际需要选择合适的碱。
[0052]
可选地,所述碱选自有机胺和无机碱中的至少一种。
[0053]
优选地,所述碱选自异丙胺、叔丁胺、二甲胺、二乙胺、二异丙胺、二异丙基乙基胺、三甲胺、三乙胺、1,8-二氮杂双环[5,4,0]十一-7-烯、1,4-二氮杂二环[2,2,2]辛烷、1-(3-氨基丙基)氮杂环庚烷-2-酮、氢氧化钠、碳酸钠、碳酸氢钠、叔丁醇钠、氢氧化钾、碳酸钾、碳酸氢钾、叔丁醇钾、氢氧化铯和碳酸铯中的至少一种。
[0054]
进一步优选地,所述碱为1,8-二氮杂双环[5,4,0]十一-7-烯和1-(3-氨基丙基)氮
杂环庚烷-2-酮。
[0055]
在本申请中,对于所述动力学拆分的原料组分配比没有特别限制,本领域技术人员可根据实际需要选择反应中各原料组分的比例。
[0056]
可选地,所述消旋α-氟代酮化合物ii、烯醛化合物iii、氧化剂、碱与催化剂的摩尔比为:
[0057]
消旋α-氟代酮化合物ii:烯醛化合物iii:氧化剂:碱:催化剂=1:0.5~2:0.5~2:0.1~2:0.05~0.2。
[0058]
优选地,所述消旋α-氟代酮化合物ii、烯醛化合物iii、氧化剂、碱与催化剂的摩尔比为:
[0059]
消旋α-氟代酮化合物ii:烯醛化合物iii:氧化剂:碱:催化剂=1:1.2~1.5:0.8~1.2:1.1~1.5:0.08~0.12。
[0060]
可选地,所述动力学拆分的反应温度为0℃~50℃;反应时间为4h~12h。
[0061]
可选地,所述动力学拆分的反应温度的上限选自50℃、45℃、40℃、35℃、30℃、25℃、20℃、15℃、10℃、5℃,下限选自0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃。
[0062]
可选地,所述动力学拆分的反应时间的上限选自12h、11h、10h、9h、8h、7h、6h、5h,下限选自4h、5h、6h、7h、8h、9h、10h、11h。
[0063]
优选地,所述动力学拆分的反应温度为15℃~35℃;反应时间为6h~10h。
[0064]
可选地,所述动力学拆分的反应体系中还包含添加剂。
[0065]
可选地,所述添加剂选自无机金属盐和有机金属化合物中的至少一种。
[0066]
优选地,所述添加剂选自氯化锂、氯化镁、氯化钪、氯化锌、四氯化钛、三氟甲磺酸锂、三氟甲磺酸镁、三氟甲磺酸钪、三氟甲磺酸锌和钛酸异丙酯中的至少一种。
[0067]
进一步优选地,所述添加剂为氯化锂。
[0068]
可选地,所述消旋α-氟代酮化合物ii与所述添加剂的摩尔比为:
[0069]
消旋α-氟代酮化合物ii:添加剂=1:0.2~0.7。
[0070]
优选地,所述消旋α-氟代酮化合物ii与所述添加剂的摩尔比为:
[0071]
消旋α-氟代酮化合物ii:添加剂=1:0.4~0.6。
[0072]
可选地,所述动力学拆分的反应体系中还包含有机溶剂。
[0073]
可选地,所述有机溶剂选自醚类溶剂,例如乙醚、环戊基甲基醚、叔丁基甲基醚、四氢呋喃、二氧六环和二甲基四氢呋喃。
[0074]
优选地,所述有机溶剂为二氧六环。
[0075]
可选地,所述有机溶剂的体积与所述消旋α-氟代酮化合物ii的摩尔数的比值为2ml/mmol~10ml/mmol。
[0076]
优选地,所述有机溶剂的体积与所述消旋α-氟代酮化合物ii的摩尔数的比值为4ml/mmol~8ml/mmol。
[0077]
在一个实施方案中,将所述消旋α-氟代酮化合物ii溶解在所述有机溶剂中,并将由此得到的溶液加入所述动力学拆分的反应体系中。
[0078]
可选地,所述动力学拆分的反应体系中还包含分子筛。
[0079]
可选地,所述分子筛选自分子筛、分子筛和分子筛的至少一种。
[0080]
优选地,所述分子筛为分子筛。
[0081]
可选地,所述动力学拆分在搅拌下进行。
[0082]
可选地,所述动力学拆分在惰性气体气氛下进行。
[0083]
可选地,所述方法至少包括以下步骤:
[0084]
a)将包含所述消旋α-氟代酮化合物ii、烯醛化合物iii和催化剂的混合物置于反应容器中,于0℃~50℃下搅拌4h~12h;
[0085]
b)对所得物进行分离,得到所述手性α-氟代酮化合物i。
[0086]
在本申请中,对于所述分离的方法没有特别限制,其包括但不限于通过减压浓缩除去溶剂,以及通过硅胶柱层析进行纯化等。
[0087]
在一个实施方案中,所述方法包括以下步骤:
[0088]
a1)将包含消旋α-氟代酮化合物ii、烯醛化合物iii、氧化剂、碱、催化剂和添加剂的混合物置于反应容器中,于0℃~50℃下搅拌4h~12h;
[0089]
b1)减压浓缩除去溶剂,然后经硅胶柱层析,得到所述手性α-氟代酮化合物i。
[0090]
在本申请中,c1~c
10
、c1~c
20
等均是指基团中所包含的碳原子数。
[0091]
在本申请中,术语“烃基”是指由烃类化合物分子上失去任意一个氢原子所形成的基团;所述烃类化合物包括烷烃化合物、烯烃化合物、炔烃化合物和芳烃化合物,例如甲苯失去苯环上甲基对位的氢原子所形成的对甲苯基,或甲苯失去甲基上任意一个氢原子所形成的苄基等。
[0092]
在本申请中,术语“烷基”是指由烷烃化合物分子上失去任意一个氢原子所形成的基团。
[0093]
在本申请中,术语“芳基”是指由芳香族化合物分子上失去芳环上的一个氢原子所形成的基团;例如甲苯失去苯环上甲基对位的氢原子所形成的对甲苯基。
[0094]
在本申请中,术语“杂芳基”是指芳香环中含有o、n、s杂原子的芳香族化合物(简称杂芳化合物)分子上失去芳香环上任意一个氢原子所形成的基团;例如呋喃环上失去任意一个氢原子形成的呋喃基。
[0095]
在本申请中,术语“卤素”是指氟、氯、溴、碘中的至少一种。
[0096]
在本申请中,术语“非烃类取代基”是指含有除h和c以外的其他元素(例如卤素、s、o、p、n等)的化合物失去任意一个氢原子所形成的基团。
[0097]
在本申请中,对术语“取代烃基”和“取代杂芳基”中碳原子的限定,是指相应的烃基和杂芳基本身所包含的碳原子数,而非取代后的碳原子数。如c1~c
10
取代烃基,其是指碳原子数为1~10的烃基上至少一个氢原子被取代基取代,例如金刚烷基上的一个氢被c≡n取代形成的碳原子数为11的基团。
[0098]
在本申请中,当取代基为氧时,是指基团中任意一个c原子上的两个h原子被o替代,形成c=o键。
[0099]
在本申请中,所述手性α-氟代酮化合物还包含具有相同的化学结构通式但具有不同的立体结构和旋光性能的对映异构体。
[0100]
本申请能产生的有益效果包括:
[0101]
1)本申请所提供的手性α-氟代酮化合物的制备方法,其可实现消旋α-氟代酮的动力学拆分,由此得到手性α-氟代酮的核心骨架。
[0102]
2)本申请所提供的手性α-氟代酮化合物的制备方法,其具有催化剂廉价、反应条件温和、操作简单、反应高效等优点。
具体实施方式
[0103]
如前所述,本申请涉及一种化合物i的制备方法,在催化剂、碱、氧化剂和添加剂存在的条件下,由消旋的α-氟代酮类化合物ii和烯醛类化合物iii的发生动力学拆分得到;该方法以手性nhc作为催化剂,以消旋α-氟代酮和烯醛作为起始原料,实现动力学拆分,制备得到手性α-氟代酮的核心骨架。
[0104]
下面结合实施例详述本申请,但本申请并不局限于这些实施例。
[0105]
如无特别说明,本申请的实施例中的原料和试剂均通过商业途径购买。
[0106]
以下实施例中使用了缩写,其含义如下:me为甲基;et为乙基;bn为苄基;ph为苯基;mes为均三甲苯基;m.s.为分子筛;dioxane为二氧六环;dq为3,3',5,5'-四叔丁基-4,4'-联苯醌;aap为1-(3-氨基丙基)氮杂环庚烷-2-酮;dbu为1,8-二氮杂双环[5,4,0]十一-7-烯;nmr为核磁共振;手性hplc为装有手性色谱柱的高效液相色谱;ee值为对映异构体过量值;rt为室温。
[0107]
以下实施例中,核磁共振氢谱1h-nmr在布鲁克公司(bruker)的400avance iii型分光仪上测定,400mhz或600mhz,cdcl3;碳谱
13
c-nmr,101mhz或151mhz,cdcl3。高效液相色谱hplc在岛津公司(shimadzu)lc-20ad工作站上测定。高分辨率质谱hrms采用安捷伦qtof 6540仪器。红外光谱ir采用布鲁克vertex 70仪器。
[0108]
手性α-氟代酮化合物i的产率,以消旋α-氟代酮化合物ii的量为准,通过以下公式计算得到:
[0109]
产率%=(目标产物实际所得质量
÷
目标产物理论应得质量)
×
100%
[0110]
实施例1
[0111][0112]
在氩气氛围下,将nhc催化剂(如上式中所示,8.4mg,0.02mmol)、氧化剂dq(98.1mg,0.24mmol)、licl(4.2mg,0.1mmol)和分子筛(400mg)加入到10ml schlenk管中,然后将消旋α-氟代酮1-1(59.3mg,0.2mmol)的1,4-二氧六环(1ml)溶液加入到反应体系中,最后将苯基烯醛1-2(38μl,0.3mmol)、dbu(9μl,0.06mmol)和aap(27μl,0.2mmol)混合均匀后加入到上述混合液中。使反应体系在室温下搅拌8h后减压浓缩脱除溶剂。将所得到的粗产品经硅胶柱层析(石油醚/乙酸乙酯=90:10,v/v)分离提纯,所得产物样品分别记为1-3和1-4,其中产物样品1-3共23.9mg,产率为40%;产物样品1-4共42.4mg,产率为50%。
[0113]
产物样品1-3的检测数据如下:
[0114]
无色油状液体;1h nmr(600mhz,cdcl3)δ8.09
–
7.98(m,2h),7.62
–
7.54(m,1h),
7.49
–
7.43(m,2h),3.72(s,3h),3.69(s,3h),3.59(dd,j=7.5,6.4hz,1h),2.90(ddd,j=25.7,15.0,6.4hz,1h),2.60(ddd,j=17.0,15.0,7.5hz,1h),1.71(d,j=21.7hz,3h);
13
c nmr(151mhz,cdcl3)δ199.97(d,j=25.9hz),169.52,169.28,134.30(d,j=4.0hz),133.56,130.11(d,j=8.3hz),128.53,101.03(d,j=186.4hz),52.94,52.90,47.24(d,j=2.3hz),37.12(d,j=21.4hz),24.75(d,j=24.1hz);[α]
d28
:+16.1(c 3.56,chcl3);hplc analysis:99%ee(chiralcel ic,10:90
i
proh/hexane,1ml/min),r
t
(major)=8.3min,r
t
(minor)=9.2min;hrms(esi,m/z):calcd.for c
15
h
17
fo5na
+
319.0952,found 319.0964;ir(kbr thin film,cm-1
):ν2358,2323,1757,1739,1559,1507,1215.
[0115]
产物样品1-4的检测数据如下:
[0116]
白色固体,熔点:140~142℃;1h nmr(400mhz,cdcl3)δ7.60(d,j=8.1hz,2h),7.51(d,j=6.9hz,2h),7.47
–
7.36(m,3h),7.35
–
7.26(m,3h),4.46(d,j=9.1hz,1h),3.66(s,3h),3.52(d,j=9.1hz,1h),3.45(s,3h),2.86(dd,j=15.5,12.6hz,1h),2.67(dd,j=40.5,15.5hz,1h),1.51(d,j=21.8hz,3h);
13
c nmr(101mhz,cdcl3)δ170.6,170.0,169.8,137.4(d,j=2.0hz),137.2,130.1,128.5,128.4,128.1,128.0,128.0,91.8(d,j=173.0hz),80.1(d,j=31.5hz),60.6,57.3,52.7,52.5,49.2,42.7(d,j=21.7hz),21.0(d,j=23.3hz);[α]
d28
:+18.8(c 4.48,chcl3);hplc analysis:73%ee(chiralcel ad-h,5:95
i
proh/hexane,1ml/min),r
t
(major)=5.0min,r
t
(minor)=5.8min;hrms(esi,m/z):calcd.for c
24
h
23
fo6na
+
449.1371,found 449.1380;ir(kbr thin film,cm-1
):ν2921,2850,1843,1734,1653,1589,1506,1275,1261,703.
[0117]
实施例2
[0118][0119]
在氩气氛围下,将nhc催化剂(如上式中所示,8.4mg,0.02mmol)、氧化剂dq(98.1mg,0.24mmol)、licl(4.2mg,0.1mmol)和分子筛(400mg)加入到10ml schlenk管中,然后将消旋α-氟代酮2-1(62.1mg,0.2mmol)的1,4-二氧六环(1ml)溶液加入到反应体系中,最后将苯基烯醛2-2(30μl,0.24mmol)、dbu(9μl,0.06mmol)和aap(27μl,0.2mmol)混合均匀后加入到上述混合液中。使反应体系在室温下搅拌8h后减压浓缩脱除溶剂。将所得到的粗产品经硅胶柱层析(石油醚/乙酸乙酯=90:10,v/v)分离提纯,所得产物样品分别记为2-3和2-4,其中产物样品2-3共28.4mg,产率为46%;产物样品2-4共43.0mg,产率为49%。
[0120]
产物样品2-3的检测数据如下:
[0121]
无色油状液体;1h nmr(400mhz,cdcl3)δ8.07
–
7.95(m,2h),7.61
–
7.52(m,1h),7.51
–
7.40(m,2h),3.69(s,3h),3.67(s,3h),3.55(dd,j=7.9,5.9hz,1h),2.84(ddd,j=28.7,14.9,5.9hz,1h),2.61(ddd,j=14.1,14.1,7.9hz,1h),2.27
–
2.06(m,1h),2.03
–
1.87(m,1h),0.96(t,j=7.5hz,3h);
13
c nmr(101mhz,cdcl3)δ200.5(d,j=26.2hz),169.5,
h,10:90
i
proh/hexane,1ml/min),r
t
(major)=11.0min,r
t
(minor)=8.1min;hrms(esi,m/z):calcd.for c
17
h
19
fo5na
+
345.1109,found 345.1115;ir(kbr thin film,cm-1
):ν1734,1684,1653,1559,1507,1275,1261.
[0129]
产物样品3-4的检测数据如下:
[0130]
白色固体,熔点:158~159℃;1h nmr(600mhz,cdcl3)δ7.61(d,j=8.0hz,2h),7.50(d,j=7.3hz,2h),7.46
–
7.41(m,2h),7.39
–
7.36(m,1h),7.34
–
7.22(m,3h),5.78
–
5.66(m,1h),5.26
–
5.10(m,2h),4.47(d,j=9.2hz,1h),3.66(s,3h),3.53(d,j=9.2hz,1h),3.44(s,3h),2.91(dd,j=15.6,12.4hz,1h),2.72
–
2.45(m,3h);
13
c nmr(151mhz,cdcl3)δ170.7,169.8(d,j=3.9hz),137.4,137.1,130.2(d,j=3.8hz),130.1,128.6,128.5,128.4,128.2,128.0,120.8,92.8(d,j=177.6hz),80.2(d,j=30.6hz),61.3,57.1,52.7,52.5,49.0,39.9(d,j=21.7hz),37.9(d,j=21.3hz);[α]
d28
:+33.8(c3.49,chcl3);hplc analysis:91%ee(chiralcel ia,20:80
i
proh/hexane,1ml/min),r
t
(major)=2.6min,r
t
(minor)=4.0min;hrms(esi,m/z):calcd.for c
26
h
25
fo6na
+
475.1527,found 475.1539;ir(kbr thin film,cm-1
):ν2322,1844,1734,1653,1539,1507,1276,1261,703.
[0131]
实施例4
[0132][0133]
在氩气氛围下,将nhc催化剂(如上式中所示,8.4mg,0.02mmol)、氧化剂dq(65.4mg,0.16mmol)、licl(4.2mg,0.1mmol)和分子筛(400mg)加入到10ml schlenk管中,然后将消旋α-氟代酮4-1(74.5mg,0.2mmol)的1,4-二氧六环(1ml)溶液加入反应体系中,最后将呋喃烯醛4-2(36.6mg,0.3mmol)、dbu(9μl,0.06mmol)和aap(27μl,0.2mmol)混合均匀后加入到上述混合液中。使反应体系在室温下搅拌8h后减压浓缩脱除溶剂。将所得到的粗产品经硅胶柱层析(石油醚/乙酸乙酯=90:10,v/v)分离提纯,所得产物样品分别记为4-3和4-4,其中产物样品4-3共32.6mg,产率为44%;产物样品4-4共46.4mg,产率为47%。
[0134]
产物样品4-3的检测数据如下:
[0135]
无色油状液体;1h nmr(600mhz,cdcl3)δ7.68
–
7.62(m,2h),7.48
–
7.41(m,1h),7.33
–
7.27(m,2h),7.23
–
7.12(m,5h),3.68(s,3h),3.62(s,3h),3.53(dd,j=8.1,5.8hz,1h),3.40(dd,j=29.4,14.2hz,1h),3.19(dd,j=17.6,14.2hz,1h),2.89(ddd,j=29.4,14.9,5.8hz,1h),2.64(ddd,j=14.9,12.9,8.1hz,1h);
13
c nmr(151mhz,cdcl3)δ201.2(d,j=26.6hz),169.3,169.0,135.7(d,j=3.7hz),133.8,133.0,130.7,129.6(d,j=8.4hz),128.4,128.1,127.4,103.5(d,j=193.7hz),52.8,52.7,47.2(d,j=2.2hz),44.5(d,j=21.4hz),36.6(d,j=21.2hz);[α]
d28
:+11.0(c 4.07,chcl3);hplc analysis:92%ee(chiralcel ad-h,5:95
i
proh/hexane,0.5ml/min),r
t
(major)=17.1min,r
t
(minor)=18.3min;hrms(esi,m/z):calcd.for c
21
h
21
fo5na
+
395.1265,found 395.1271;ir(kbr thin film,cm-1
):ν1954,2920,2849,2360,1734,1684,1558,1275,701.
[0136]
产物样品4-4的检测数据如下:
[0137]
黄色油状液体;1h nmr(400mhz,cdcl3)δ7.55(d,j=7.7hz,2h),7.47
–
7.37(m,3h),7.32(s,1h),7.29
–
7.23(m,3h),7.12(d,j=7.5hz,2h),6.41(d,j=3.3hz,1h),6.37
–
6.27(m,1h),4.37(d,j=7.7hz,1h),3.97(d,j=7.7hz,1h),3.63(s,3h),3.57(s,3h),3.24
–
2.90(m,2h),2.65
–
2.28(m,2h);
13
c nmr(101mhz,cdcl3)δ170.6,169.3,169.1,151.5,142.0,137.1,133.9,130.9,128.6,128.5,128.1,128.0,127.3,111.0,109.4,92.9(d,j=180.8hz),79.9(d,j=31.1hz),60.0,55.4,53.4,52.6,40.4,39.0(d,j=20.8hz),37.1(d,j=22.6hz);[α]
d28
:+1.9(c 2.90,chcl3);hplc analysis:84%ee(chiralcel as-h,10:90
i
proh/hexane,1ml/min),r
t
(major)=8.9min,r
t
(minor)=4.7min;hrms(esi,m/z):calcd.for c
28
h
25
fo7na
+
515.1477,found 515.1473;ir(kbr thin film,cm-1
):ν2353,2319,1737,1642,702,514.
[0138]
以上所述,仅是本申请的几个实施例,并非对本申请做任何形式的限制,虽然本申请以较佳实施例揭示如上,然而并非用以限制本申请,任何熟悉本专业的技术人员,在不脱离本申请技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



