(+)-大麻素类的合成及其治疗作用的制作方法
 2021-02-01 22:02:11|
2021-02-01 22:02:11| 288|
288| 起点商标网
起点商标网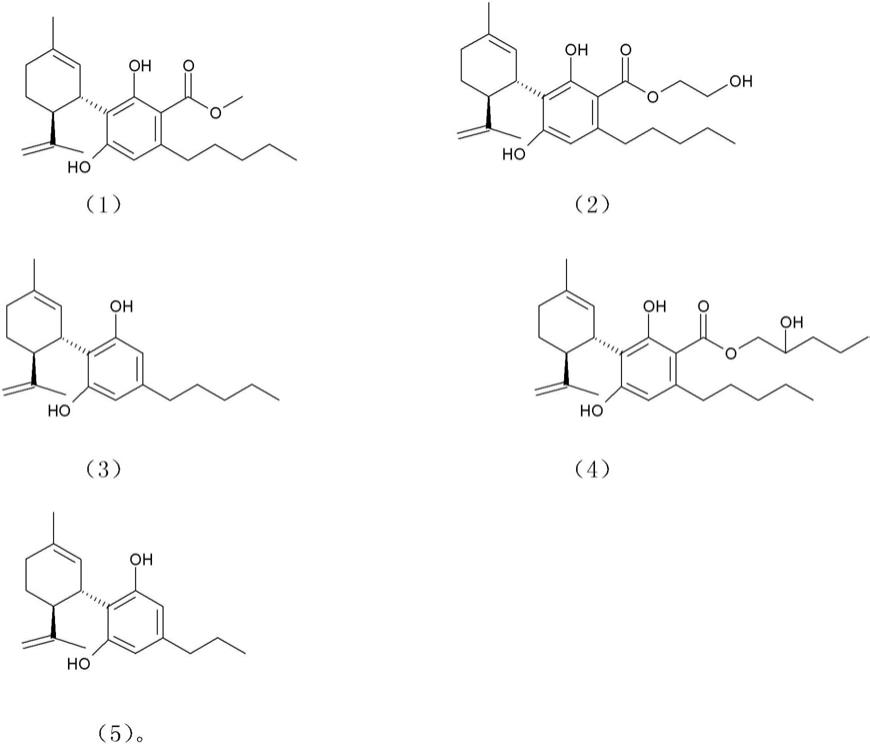
[0001]
本发明涉及一种生产式(i)化合物
[0002][0003]
或式(i)化合物的盐的方法。下文解释了x和n的含义,并在下面的公开中确定了优选化合物。本发明还涉及式(i)化合物或式(i)化合物的盐,其用于实现一种或多种治疗作用的治疗方法,以及用于治疗和/或预防某些疾病。此外,本发明提供了一种药物组合物,其包含一种或多种式(i)化合物或一种或多种式(i)化合物的盐。
背景技术:
[0004]
大麻中最常见的大麻素,大麻二酚(cbd),由于其广泛的生物活性谱,其在医学上的应用越来越受到人们的关注。cbd作为一种有效的药物成分与屈大麻酚联合用于ms 治疗,并作为单一药物用于治疗像dravet综合征这样的癫痫疾病。在各种临床试验中,研究了结构相关的化合物次大麻二酚(cbdv)的抗癫痫治疗作用。
[0005]
自然产生的cbd和cbdv具有绝对立体构型(-)-反式。顺式异构体或(+)-对映体不是在植物中产生的,因此迄今为止没有药物影响。对映体(+)-反式-cbd的首次生物学研究显示出惊人的生物学效应(morales等人,“大麻二酚的合成和天然衍生物的药物化学概述(an overview on medicinal chemistry of synthetic and naturalderivatives of cannabidiol)”,药理学前沿(frontiers in pharmacology),2017, vol.8,article 422,doi:10.3389/fphar.2017.00422)。然而,现有的生物数据是不成熟的。
[0006]
在大麻素类作为医药产品合法化的过程中,对cbd的需求不断增加,这导致了对大麻植物种植替代品的开发。除了目前仍处于开发阶段的各种生物合成路线外,大麻素类的化学合成是最有前途的选择。化学合成可以产生一种监管安全的、有效的药物成分。然而,像ced这样的手性分子的每一个合成过程都必须证明产物是手性纯的。顺式构型可由于化学过程(如ep2842933b1中的cbd过程)而被排除。为证明产物是对映体纯的,在cbd的情况下,这将包括(-)-构型,该过程需要已证实的对映体纯的初级产物或确定的手性分析方法。这些方法可以是测定产物旋光度的方法,也可以是像hplc或gc这样的手性色谱法。然而,为了验证这些方法,两种对映体都是必要的。因此,(+)-大麻素类作为参考物质也具有很大的分析潜力。
[0007]
wo2017/011210a1涉及使用卤素和含卤素化合物(溴化物、二氯甲烷)并且需要巨大的仪器复杂性的(+)-大麻二酚的合成。us2017/0349517a1公开了(+)-次大麻二酚的合
成,其是在使用二氯甲烷作为溶剂并需要冷却至-10℃至-15℃的间歇过程中进行的。
[0008]
目前仍然需要有效的方法来生产对映体纯的(+)-大麻素类,并确定具有生物活性的化合物,其允许治疗性和/或预防性的医学应用。
技术实现要素:
[0009]
因此,本发明的一个目的是提供一种生产对映体纯的(+)-大麻素类的方法。特别地,该合成应该是高效的,并且允许连续的合成过程,而不需要巨大的仪器复杂性。此外,本发明的另一个目的是产物的纯化应是容易的,并且特别是不需要(手性)色谱步骤。此外,应当可以从非对映体纯离析物开始。
[0010]
本发明的再一个目的是提供对映体纯的(+)-大麻素类,其具有生物活性,可用于实现特定治疗作用并允许治疗和/或预防某些疾病。
[0011]
通过一种生产式(i)化合物
[0012][0013]
或式(i)化合物的盐的方法实现了上述目的,
[0014]
其中x=h或-cooy,
[0015]
其中y=饱和的或不饱和的、支链的或无支链的烷基基团、芳基基团或杂芳基基团,其分别具有1至12个碳原子,并且选择性地被一个或多个氨基基团、羟基基团和/或卤素取代,并且
[0016]
其中n=2或4,
[0017]
所述方法包括以下步骤:
[0018]
i)使4s-薄荷二烯醇与式(ii)化合物反应,
[0019][0020]
其中n=2或4,
[0021]
以获得式(iii)化合物,
[0022][0023]
其中n=2或4。
具体实施方式
[0024]
该过程的第一步是4s-薄荷二烯醇和取代的间苯二酚衍生物(橄榄醇甲酯或divarin 甲酯)在酸催化剂下的friedel craft加成反应。该步骤不需要冷却,因此优选在20℃至25℃之间进行。为确保各大麻素甲酯的(+)-构型,起始材料薄荷二烯醇必须具有 4s构型。由于在加成过程中1s/1r立体中心被破坏,它可以是1s,4s-薄荷二烯醇、1r,4s
-ꢀ
薄荷二烯醇,或者两种薄荷二烯醇的混合物。另一方面,4r-薄荷二烯醇杂质会导致各自的(-)-大麻素。为考察该过程的稳定性及其纯化,可以使用含有5%的4r-薄荷二烯醇作为杂质的4s-薄荷二烯醇起始材料。
[0025][0026]
方案1:4s-薄荷二烯醇与取代的间苯二酚衍生物的friedel craft加成反应
[0027]
根据一个实施方式,上述方法还包括一个或多个步骤:
[0028]
ii)所述式(iii)化合物的酯交换反应,和/或
[0029]
iii)所述式(iii)化合物的脱羧反应。
[0030]
在进行步骤ii)之前,不需要纯化初级产物,即所述式(iii)化合物。该过程的步骤ii)包括(+)-大麻素甲酯的酯交换反应以及随后的酸性脱羧反应生成所需的(+)
ꢀ-
大麻素。所述酯交换反应优选在真空中进行,优选在300mbar至700mbar之间,更优选在400mbar至600mbar之间,尤其优选在约500mbar进行,以允许立即蒸馏出低沸点乙醇。通过所述酯交换反应形成的中间酯通常不是孤立的。任何烷基醇都可以用作该酯交换反应中的反应参与物。以下给出了优选醇。所述产物不需要手性色谱纯化以达到>99%的手性纯度。
[0031]
根据优选的实施方式,在上述方法中,步骤i)作为一个批次进行,或者优选作为连续流动反应过程进行。
[0032]
第一步可以作为间歇反应进行,但如果采用流动细胞反应器作为连续流动反应进行,则可以获得更好的收率和纯度。
[0033]
表1:合成(+)-反式-大麻二酚甲酯(cbd-me)的间歇反应-连续流动反应的比较
[0034]
反应类型批量大小纯度初级cbd-me收率
ꢀꢀꢀꢀ
间歇反应50g57%46% 100g52%46%
ꢀꢀꢀꢀ
连续流动反应50g78%68% 100g79%71%
[0035]
在上述方法的另一个优选实施方式中,所述式(i)化合物选自由式(1)至(5) 的化合物或其盐组成的组
[0036][0037]
化合物(1):(+)-大麻二酚甲酯((+)-cbd-me)
[0038]
化合物(2):(+)-大麻二酚乙二醇酯((+)-cbd-ge)
[0039]
化合物(3):(+)-大麻二酚((+)-cbd)
[0040]
化合物(4):(+)-大麻二酚羟基戊酯((+)-cbd-hpe)
[0041]
化合物(5):(+)-次大麻二酚((+)-cbdv)
[0042]
化合物(1)至(5)已被证明具有生物活性,其允许如下更详细解释的治疗应用。
[0043]
对于本发明背景下的式(i)化合物和化合物(1)至(5)的盐,以下适用:在适当的情况下,一种或多种化合物的一个或多个羟基基团以去质子化的形式存在。除了一种或多种(去质子化)的化合物外,还存在相应数量的抗衡阳离子,其中这些阳离子优选地选自由以下各项组成的组:第一主族和第一族过渡元素的单正电荷阳离子、铵离子、三烷基铵离子、第二主族和第二族过渡元素的双正电荷阳离子以及第三主族和第三族过渡元素的三重正
电荷阳离子,以及它们的组合。
[0044]
化合物的酚羟基通常比脂肪族侧链中的羟基基团(如果存在)的酸性更强。
[0045]
相应数量的抗衡阳离子(取决于它们的电荷)来自于去质子化羟基基团的数量。例如,它产生于作为这种盐的基础的具有两个酚羟基基团的式(i)化合物,在这些酚羟基基团完全去质子化的情况下,存在一个带双负电荷的阴离子,可以导出必须由一种或多种抗衡阳离子提供的正电荷数(在这种情况下:两个)。最优选地,这些抗衡阳离子选自由na
+
、k
+
、nh
4+
、ca
2+
、mg
2+
、al
3+
和zn
2+
组成的组。
[0046]
进一步优选上述的方法,其中,在步骤i)中使用纯1s,4s-薄荷二烯醇或纯1s,4r
-ꢀ
薄荷二烯醇或1s,4s-薄荷二烯醇与1r,4s-薄荷二烯醇的混合物。
[0047]
令人惊讶的是,根据本发明的方法允许从非对映体纯起始材料,即1s,4s-薄荷二烯醇与1r,4s-薄荷二烯醇的混合物,合成对映体纯的(+)-大麻素类及其衍生物。最终产物可以被纯化而不必进行任何耗时、昂贵的手性纯化方法,并且仍然可以获得>99%的纯度以及>99%的对映体纯度。
[0048]
根据上述方法的优选实施方式,步骤i)在无卤素溶剂中进行,优选在甲苯中进行。其他可能的溶剂是苯、二甲苯、环己烷或甲基叔丁酯。
[0049]
有利地,根据本发明的方法可以在无卤素溶剂中进行,这避免了生态问题。优选地,步骤i)在甲苯中进行,这提供最佳效率和反应收率。
[0050]
根据上述方法的又一个优选实施方式,在步骤i)中提供路易斯酸催化剂的溶液并使其与式(ii)化合物和4s-薄荷二烯醇的溶液接触。
[0051]
为了确保所述催化剂始终存在于反应室中,将该催化剂的溶液装入反应室,然后将式(ii)化合物和4s-薄荷二烯醇的溶液装入反应室。在连续流动反应过程中,该过程中两种溶液均通过连续流动反应器泵送,该催化剂的溶液优选在式(ii)化合物和4s
-ꢀ
薄荷二烯醇的溶液之前开始并在其之后结束。
[0052]
在优选的实施方式中,所述路易斯催化剂是三氟化硼乙醚络合物。使用三氟化硼乙醚络合物作为催化剂已经显示出提供了具有良好收率的高效反应。
[0053]
如上所述,任何烯丙醇均可用作步骤ii)中所述酯交换反应的反应参与物。支链的或无支链的、饱和的或不饱和的烷基醇以及环状烷基醇可能是合适的。然而,当使用具有一个伯羟基基团的无支链的、饱和的烷基醇时获得了最佳收率和选择性。
[0054]
在另一个优选实施方式中,在步骤ii)中进行与乙二醇和/或1,2-戊二醇的酯交换反应。
[0055]
步骤ii)中化合物(1)与乙二醇和/或1,2-戊二醇的酯交换反应分别提供所述化合物(2)和/或化合物(4)。化合物(2)和化合物(4)已显示出具有生物活性,其允许如下更详细解释的治疗性应用。此外,它们很容易脱羧得到化合物(3)。
[0056][0057]
方案2:化合物(1)与乙二醇(顶部)和1,2-戊二醇(底部)的酯交换反应
[0058]
在另一个优选的实施方式中,在步骤ii)中使用酸。脱羧反应可以通过加入酸,诸如硫酸来进行。或者,可以使用盐酸,但优选使用硫酸。
[0059][0060]
方案3:与乙二醇的酯交换反应以及脱羧反应
[0061]
粗(+)-大麻素类可以通过快速色谱法或薄层蒸馏法进行纯化。纯化步骤之后可进行最终的结晶步骤,其分别产生纯度>99%的(+)-大麻素和绝对对映体纯度的(+)
-ꢀ
大麻素。
[0062]
根据另一个方面,本发明涉及上述的(+)-大麻素化合物用于治疗方法,尤其是用于治疗和/或预防医疗状况。(+)-大麻素化合物的治疗作用可归因于它们与大麻素受体 cb1和cb2的相互作用。
[0063]
哺乳动物组织中含有至少两种大麻素受体cb1和cb2,两者都与g蛋白偶联。cb1受体
主要由中枢和外周神经系统的神经元表达,而cb2受体则出现在某些非神经元组织的中央和外围,尤其是免疫细胞中(pertwee等人,2010)。大麻素受体的内源性配体的存在也被证实(pacher等人,2006)。这种“内大麻素系统”的发现促使了一系列新型大麻素受体激动剂和拮抗剂的开发,包括对cb1或cb2受体有显著选择性的几种。
[0064]
cb1受体位于中枢和外周神经系统中,并居于一个正构和几个变构结合位点,以进行潜在的配体结合(price等人,2005;adam等人,2007;horswill等人,2007;navarro 等人,2009)。由于其分布在整个神经系统中,cb1受体的激活影响各种认知过程(如注意、记忆、运动功能和疼痛感受)(pertwee等人,2008;elphick等人,2001)。通过 cb1拮抗剂抑制cb1受体提供了扩展的药物适用性,以靶向治疗例如肥胖症(dourish等人,2008)、类阿片药物滥用(sharma等人,2007)和帕金森氏病(concannon等人, 2015)。
[0065]
cb2受体主要位于免疫系统和胃肠系统的外周组织中,但也可以在大脑的神经元中发现(chen等人,2017)。因此,cb2受体可促进抗炎和免疫调节(免疫抑制、诱导凋亡、诱导细胞迁移)、治疗作用(basu等人,2011)。另外,cb2受体在神经退行性疾病,诸如阿尔茨海默病的治疗中具有潜在的治疗作用(benito等人,2003)。
[0066]
中枢和外周大麻素受体都是七螺旋区g蛋白偶联受体超家族的成员。已知大麻素受体通过百日咳毒素敏感的gi/o抑制腺苷酸环化酶来介导其作用(pacher等人,2006)。
[0067]
为用于医疗/药物制剂,有必要通过各物质与cb受体的选择性相互作用来靶向不同的作用。例如,9-thc是一种非选择性的cb1和cb2激动剂,因此其疗效并不明确。
[0068]
所有受试的(+)-大麻素类在纳摩尔范围内均表现出与cb1和cb2的特异性结合活性,这有助于这些化合物在治疗剂量下的潜在应用。
[0069]
令人惊讶的是,没有一种化合物显示cb1激动剂活性,但所有的化合物都显示出cb1拮抗活性。(+)-cbd显示出cb1拮抗活性,另外显示出cb2激动剂活性。(+)-cbd-hpe 对cb1和cb2表现出相同的亲和力,是一种具有边际cb2激动剂活性的非常有效的cb1拮抗剂。
[0070]
所述受试化合物具有不同但明确的活性谱,其中(+)-cbd是最活跃的。选择性活性谱能够使标题的大麻素类根据适应症用于不同的靶点。尤其令人惊讶的是,cb1拮抗作用提供了靶向治疗从肥胖症、阿片类药物滥用到神经退行性疾病,如帕金森氏病的各种适应症的机会。
[0071]
原代人单核细胞是存在人类血液中的一种白细胞,或白血球(pbmcs:外周血单核细胞),其代表约10%至30%的pbmcs。单核细胞及其巨噬细胞和树突状细胞后代在免疫系统、吞噬、抗原呈递和细胞因子产生中起着三个主要和关键的作用。作为脊椎动物固有免疫系统的一部分,单核细胞也影响适应性免疫的过程。已经显示出人类单核细胞表达cb2,这些受体在免疫功能和免疫调节中发挥重要作用(klein等人,2003)。对cb1受体及其在原代人单核细胞中作用的研究表明,该受体的激活可促进巨噬细胞的促炎反应。抑制cb1和选择性激活cb2可抑制巨噬细胞的促炎反应(han等人,2009)。
[0072]
原代人成纤维细胞是细胞外基质(ecm)蛋白的主要来源,除了为细胞提供支架外还在决定细胞表型和功能方面发挥着关键作用。成纤维细胞在起始阶段和分解阶段都有助于损伤反应。它们在许多免疫和炎症反应中也起辅助细胞的作用。成纤维细胞能够产生多种细胞因子或对其产生反应,这些介体允许成纤维细胞和白细胞在复杂过程,诸如伤口愈合中进行合作。成纤维细胞能够改变其细胞外基质成分的输出,以响应其他类型细胞释放
(1)至(5)或其盐组成的组,用于实现选自由以下各项组成的组的作用的治疗方法:
[0081]-消炎、
[0082]-免疫调节、
[0083]-免疫抑制、
[0084]-免疫刺激、
[0085]-止痛。
[0086]
所有受试的(+)-大麻素化合物都显示出抗炎作用,不过(+)-cbd、(+)-cbdv 和(+)-cbd-ge是最有效的,因此被优选用于实现抗炎作用的治疗方法。
[0087]
由于cb2受体激动剂促进免疫调节作用,即免疫抑制或免疫刺激,因此(+)-cbd 和(+)-cbd-hpe优选用于实现免疫调节作用,特别是免疫抑制或免疫刺激作用的治疗方法。由于(+)-cbd表现出最强的cb2激动作用,因此它特别优选用于实现免疫调节作用,特别是免疫抑制或免疫刺激作用的治疗方法。cb2受体激动剂也可用作止痛疗法。因此,(+)-cbd和(+)-cbd-hpe,特别是(+)-cbd,优选用于实现止痛作用的治疗方法。
[0088]
因此,本发明特别优选的实施方式是式(i)化合物用于上述的治疗方法,其中所述式(i)化合物是化合物(3)或化合物(3)的盐。
[0089]
cb2-激动剂是治疗各种疼痛性疾病(慢性、神经性、炎症性)的有前途的止痛疗法 (le boisselier等人,2017;likar等人,2017)。另外,cb2-激动剂有益于治疗神经炎症和神经退行性疾病,如多发性硬化症(pertwee,2007;dittel,2008)、亨廷顿氏病(sagredo等人,2012)、阿尔茨海默病(aso等人,2016)以及治疗脑中风(zhang 等人,2007)。
[0090]
cb2-激动剂也是治疗周围炎性疾病,如动脉硬化(mach等人,2008)或炎症性肠病(izzo等人,2008;wright等人,2008)、缺血(b
á
tkai等人,2007)、糖尿病肾病 (barutta等人,2011)和肝硬化(izzo等人,2008;mallat等人,2007;lotersztajn 等人,2008)的有效方法。
[0091]
流行病学和临床前数据表明,激活cb2受体对骨质疏松症有有益的治疗作用(ofek 等人,2006)。此外,有临床数据表明,cb2激动剂对某些癌症类型是有效的(izzo等人, 2008;wright等人,2008;guzman,2003)。
[0092]
cb1拮抗剂是治疗肥胖症进而治疗糖尿病的有前途的疗法(dourish等人,2008; badal等人,2017;wagner等人,2012),因此被认为对减肥模式很重要。另外,它们在药物停止和药物戒断(酒精、烟草、麻醉品)的治疗中显示出有益的效果(ravan等人,2014;chandler等人,2009;koob等人,2014)。
[0093]
cb1拮抗剂还可通过阻断脂肪肝代谢来治疗非酒精性脂肪肝(nafld)(badal等人, 2017)。另外,cb1拮抗剂是治疗神经退行性疾病,如帕金森氏病的有前途的疗法 (brotchie,2003;cerri等人,2014)。
[0094]
因此,本发明的一个优选实施方式是式(i)化合物或式(i)化合物的盐,优选地选自由化合物(1)至(5)或其盐组成的组,用于治疗和/或预防:炎症性疾病,诸如神经炎症性疾病、动脉硬化、炎症性肠病或缺血;和/或疼痛性疾病,诸如慢性疼痛、神经性疼痛或糖尿病性神经病变;和/或神经退行性疾病,诸如多发性硬化症、亨廷顿氏病,阿尔茨海默病或帕金森氏病;和/或脑中风和/或肝硬化和/或骨质疏松症和/或癌症和/或肥胖症和/或糖尿病和/或肝纤维化和/或非酒精性脂肪肝疾病和/或牛皮癣,和/ 或用于治疗麻醉品、阿片类药
物、烟草或酒精的停止或戒断症状。
[0095]
优选地,用于上述治疗和/或预防的所述式(i)化合物是化合物(3)或化合物(3) 的盐。
[0096]
本发明还涉及一种药物组合物,其包含一种或多种式(i)化合物或一种或多种式 (i)化合物的盐,所述一种或多种式(i)化合物或式(i)化合物的盐优选地选自由化合物(1)至(5)或其盐组成的组。
[0097]
根据本发明的药物组合物优选地选自由固体盖伦剂型(例如片剂,有包衣或无包衣,有调释或无调释)、糖衣丸(有包衣或无包衣,有调释或无调释)、胶囊(软明胶胶囊或硬明胶胶囊,有调释或无调释)、颗粒(有调释或无调释)、粉末(有调释或无调释,例如鼻粉、耳粉)、栓剂(有包衣或无包衣,有调释或无调释)、锭剂、口香糖、半固体形式(例如疏水性软膏,其中例如碳氢化合物凝胶、脂质体凝胶、硅凝胶、油凝胶,以及水溶性如软膏,其中例如吸收基质、亲水性软膏、亲水胶(水凝胶)或糊剂、还有鼻软膏)、吸入剂(例如压力气体计量吸入器、粉末吸入器、雾化吸入器、吸入用吸入浓缩物)、可注射物和植入物(例如,基于液体或固体形式,这些形式适用于制备能够调释的可注射溶液或固体基质或用作该可注射溶液或固体基质)、含有活性成分的贴剂、耳塞剂组成的组。
[0098]
液体形式例如是溶液、悬浮液、乳液、糖浆类药品(俗称咳嗽糖浆)、漱口剂、漱口液、喉咙喷剂或鼻喷剂、滴鼻剂、鼻腔冲洗液、滴耳剂、耳喷剂和洗耳液。
[0099]
药物组合物优选包含一种或多种选自以下组的组分:填充材料(例如,纤维素、碳酸钙)、流动剂和防结块剂(例如,滑石、硬脂酸镁)、涂料(例如,聚醋酸乙烯邻苯二甲酸酯、羟丙基甲基纤维素邻苯二甲酸酯)、崩解剂(例如,淀粉、交联的聚乙烯吡咯烷酮)、增塑剂(例如,柠檬酸三乙酯、邻苯二甲酸二丁酯)、造粒用物质(乳糖、明胶)、延迟剂(例如,分散型聚甲基丙烯酸-甲基/乙基/2-三甲基氨基乙基酯共聚物、醋酸乙烯酯/巴豆酸共聚物)、压实剂(例如,微晶纤维素、乳糖)、溶剂、悬浮液或分散剂(例如,水、乙醇)、乳化剂(例如,十六烷醇、卵磷脂)、用于改变流变性能的物质 (二氧化硅、海藻酸钠)、用于微生物稳定的物质(例如,苯扎氯胺、山梨酸钾)、防腐剂和抗氧化剂(例如,dl-α-生育酚、抗坏血酸)、改变ph值的物质(乳酸、柠檬酸)、推进剂或惰性气体(例如,氟化氯化烃、二氧化碳)、着色剂(氧化铁、氧化钛)、软膏基质材料(例如,石蜡、蜂蜡),尤其它们可在技术文献中找到(例如,schmidt,p.c., christin,i.,,wirk-und hilfsstoffe f
ü
r rezeptur,defektur und groβherstellung“, 1999,wissenschaftliche verlagsgesellschaft mbh stuttgart or bauer,k.h.,k-h.,f
ü
hrer,c.,,lehrbuch der pharmazeutischen technologie“,8. auflage,2006,wissenschaftliche verlagsgesellschaft mbh stuttgart)。
[0100]
本领域技术人员可根据各制剂的种类和用途,通过简单的试错法容易地确定在一种药物组合物中的一种或多种式(i)化合物和/或其一种或多种盐的优选用量。
附图说明
[0101]
图1显示了如实施例4中评估的(+)-cbd的cb1(左)和cb2(右)结合。
[0102]
图2显示了如实施例4中评估的(+)-cbdv的cb1(左)和cb2(右)结合。
[0103]
图3显示了如实施例4中评估的(+)-cbd-me的cb1(左)和cb2(右)结合。
[0104]
图4显示了如实施例4中评估的(+)-cbd-ge的cb1(左)和cb2(右)结合。
[0105]
图5显示了如实施例4中评估的(+)-cbd-hpe的cb1(左)和cb2(右)结合。
[0106]
图6显示了如实施例5中评估的(+)-cbd对cb1功能活性(激动剂活性)的影响。
[0107]
图7显示了如实施例5中评估的(+)-cbdv对cb1功能活性(激动剂活性)的影响。
[0108]
图8显示了如实施例5中评估的(+)-cbd-me对cb1功能活性(激动剂活性)的影响。
[0109]
图9显示了如实施例5中评估的(+)-cbd-ge对cb1功能活性(激动剂活性)的影响。(+)-cbd-ge在25μm处表现出细胞毒性。
[0110]
图10显示了如实施例5中评估的(+)-cbd-hpe对cb1功能活性(激动剂活性)的影响。
[0111]
图11显示了如实施例5中评估的(+)-cbd对cb1功能活性(拮抗活性)的影响。
[0112]
图12显示了如实施例5中评估的(+)-cbdv对cb1功能活性(拮抗活性)的影响。
[0113]
图13显示了如实施例5中评估的(+)-cbd-me对cb1功能活性(拮抗活性)的影响。
[0114]
图14显示了如实施例5中评估的(+)-cbd-ge对cb1功能活性(拮抗活性)的影响。cbd-ge在25μm处表现出细胞毒性。
[0115]
图15显示了如实施例5中评估的(+)-cbd-hpe对cb1功能活性(拮抗活性)的影响。
[0116]
图16显示了如实施例5中评估的(+)-cbd对cb2功能活性(激动剂活性)的影响。
[0117]
图17显示了如实施例5中评估的(+)-cbdv对cb2功能活性(激动剂活性)的影响。
[0118]
图18显示了如实施例5中评估的(+)-cbd-me对cb2功能活性(激动剂活性)的影响。
[0119]
图19显示了如实施例5中评估的(+)-cbd-ge对cb2功能活性(激动剂活性)的影响。
[0120]
图20显示了如实施例5中评估的(+)-cbd-hpe对cb2功能活性(激动剂活性)的影响。
[0121]
图21显示了如实施例5中评估的(+)-cbd对cb2功能活性(拮抗活性)的影响。
[0122]
图22显示了如实施例5中评估的(+)-cbdv对cb2功能活性(拮抗活性)的影响。
[0123]
图23显示了如实施例5中评估的(+)-cbd-me对cb2功能活性(拮抗活性)的影响。
[0124]
图24显示了如实施例5中评估的(+)-cbd-ge对cb2功能活性(拮抗活性)的影响。
[0125]
图25显示了如实施例5中评估的(+)-cbd-hpe对cb2功能活性(拮抗活性)的影响。
[0126]
图26显示了如实施例6中评估的(+)-cbd对人单核细胞的细胞活力的影响。
[0127]
图27显示了如实施例6中评估的(+)-cbdv对人单核细胞的细胞活力的影响。
[0128]
图28显示了如实施例6中评估的(+)-cbd-me对人单核细胞的细胞活力的影响。
[0129]
图29显示了如实施例6中评估的(+)-cbd-ge对人单核细胞的细胞活力的影响。
[0130]
图30显示了如实施例6中评估的(+)-cbd-hpe对人单核细胞中细胞活力的影响。
[0131]
图31显示了如实施例6中评估的(+)-cbd对lps处理的人单核细胞炎症参数的影响。每个浓度的柱形从左到右表示:il1β、tnfα、il6、il8、mmp9、pge2和异前列腺素。
[0132]
图32显示了如实施例6中评估的(+)-cbdv对lps处理的人单核细胞炎症参数的影响。每个浓度的柱形从左到右表示:il1β、tnfα、il6、il8、mmp9、pge2和异前列腺素。
[0133]
图33显示了如实施例6中评估的(+)(+)-cbd-me对lps处理的人单核细胞炎症参数的影响。每个浓度的柱形从左到右表示:il1β、tnfα、il6、il8、mmp9、pge2 和异前列腺素。
[0134]
图34显示了如实施例6中评估的(+)-cbd-ge对lps处理的人单核细胞炎症参数的影响。每个浓度的柱形从左到右表示:il1β、tnfα、il6、il8、mmp9、pge2和异前列腺素。
[0135]
图35显示了如实施例6中评估的(+)-cbd-hpe对lps处理的人单核细胞炎症参数的
影响。每个浓度的柱形从左到右表示:il1β、tnfα、il6、il8、mmp9、pge2和异前列腺素。
[0136]
图36显示了如实施例6中评估的(+)-cbd对il-1处理的人皮肤成纤维细胞炎症参数的影响。每个浓度的柱形从左到右表示:il6、il8和pge2。
[0137]
图37显示了如实施例6中评估的(+)-cbdv对il-1处理的人皮肤成纤维细胞炎症参数的影响。每个浓度的柱形从左到右表示:il6、il8和pge2。
[0138]
图38显示了如实施例6中评估的(+)-cbd-me对il-1处理的人皮肤成纤维细胞炎症参数的影响。每个浓度的柱形从左到右表示:il6、il8和pge2。
[0139]
图39显示了如实施例6中评估的(+)-cbd-ge对il-1处理的人皮肤成纤维细胞炎症参数的影响。每个浓度的柱形从左到右表示:il6、il8和pge2。
[0140]
图40显示了如实施例6中评估的(+)-cbd-hpe对il-1处理的人皮肤成纤维细胞炎症参数的影响。每个浓度的柱形从左到右表示:il6、il8和pge2。
[0141]
图41显示了如实施例6中评估的(+)-cbd对polyic处理的人角质形成细胞(hacat) 中mmp1、mmp9和timp1的影响。每个浓度的柱形从左到右表示:mmp9、timp1和mmp1。
[0142]
图42显示了如实施例6中评估的(+)-cbdv对polyic处理的人角质形成细胞(hacat) 中mmp1、mmp9和timp1的影响。每个浓度的柱形从左到右表示:mmp9、timp1和mmp1。
[0143]
图43显示了如实施例6中评估的(+)-cbd-me对polyic处理的人角质形成细胞 (hacat)中mmp1、mmp9和timp1的影响。每个浓度的柱形从左到右表示:mmp9、timp1 和mmpl。
[0144]
图44显示了如实施例6中评估的(+)-cbd-ge对polyic处理的人角质形成细胞 (hacat)中mmp1、mmp9和timp1的影响。每个浓度的柱形从左到右表示:mmp9、timp1 和mmp1。
[0145]
图45显示了如实施例6中评估的(+)-cbd-hpe对polyic处理的人角质形成细胞(hacat)中mmpl、mmp9和timp1的影响。每个浓度的柱形从左到右表示:mmp9、timp1 和mmp1。
[0146]
将基于以下实施例对本发明进行更详细地解释。
[0147]
实施例1:合成(+)-cbd(3)
[0148][0149]
方案4:合成(+)-cbd-me(1)
[0150]
将71.4g(300mmol)橄榄醇甲酯和50g(330mmol)1r,4s-薄荷二烯醇与甲苯一起溶解以达到400ml的组合体积->溶液a。使21.3g(150mmol)bf3乙醚络合物与甲苯溶解以达到300ml的体积->溶液b。然后使两种反应溶液通过两个独立的泵系统和连续流动反应器(旋转:1200u/min,溶液a:24ml/min,溶液b:12ml/min)。溶液b在溶液a之前开始并在溶液a之后结束,以保证催化剂始终存在于反应室内。将反应混合物连续收集在装有700ml饱和nahco3溶液的2升实验室反应器(30℃炉架温度,300rpm)中。将水溶液丢弃;有机溶液在45度下用250ml 1%的naoh溶液洗涤 4次。洗涤后,将有机溶液蒸干,得到94.58g未加工的(+)-cbd甲酯(纯度=78%,收率68%)。原料化合物可进一步使用,无需纯化。
[0151]
示例性纯化(+)-cbd me(1):
[0152]
用快速色谱法(洗脱液系统环己烷/乙酸乙酯=40/1体积/体积)纯化粗产物。gc纯度:99.1%。手性gc分析:对映体过量99%(对于对映体纯起始材料)。1h nmr(400mhz, cdcl3)δ11.98(s,1h),6.50(s,1h),6.21(s,1h),5.55(s,1h),4.52 (p,j=2.4,1.4hz,1h),4.41-4.36(m,1h),4.16-4.06(m,1h),3.90 (s,3h),2.89-2.79(m,1h),2.78-2.69(m,1h),2.44-2.33(m,1h),2.29-2.15(m,1h),2.09(dq,j=17.9,4.0,2.5hz,1h),1.84
-ꢀ
1.76(m,2h),1.80-1.77(m,3h),1.72-1.68(m,3h),1.57-1.46 (m,2h),1.38-1.28(m,4h),0.89(t,j=6.8hz,3h).
13
c nmr(101mhz, cdcl3)δ172.62,163.11,159.91,147.23,145.94,140.19,124.06,114.38,111.49, 111.23,103.91,51.73,46.66,36.83,35.40,32.10,31.14,30.24,27.84,26.92, 23.71,22.55,18.83,14.10。
[0153][0154]
方案5:经(+)-cbd ge(2)合成(+)-cbd(3)
[0155]
将49.2g(103mmol)(+)-cbd-me(1)在60度下溶解于250ml乙二醇中,并倒入1l实验室反应器中。加入5.7g氢氧化钾,并在搅拌至120度和500mbar的真空时开始加热反应混合物。将累积的挥发性副产物蒸馏掉。2小时后,反应温度升高到150度,该温度保持额外3小时。在添加400ml水和130ml正庚烷之后,将反应混合物冷却到80度。在缓慢添加1.2ml硫酸(50%)直到ph值为约6时,温度进一步降低到40度。分离各层,用250ml水和250ml氢氧化钠溶液(0.05%)各洗涤有机层一次。有机层在na2so4上干燥,然后蒸干。收率:30.3g,gc纯度:53%。
[0156]
示例性分离和纯化(+)-cbd ge(2):
[0157]
在120度下2小时后取出反应混合物样品,用正庚烷和水淬灭,并用硫酸(10%重量/重量)中和。分离各层,将有机层蒸干。用快速色谱法(洗脱液系统正庚烷/乙酸乙酯=4/1体积/体积)纯化粗(+)-cbd-ge(2)。gc纯度:97.8%。手性gc分析:对映体过量99%(对映体纯起始材料)。1h nmr(400mhz,cdcl3)δ11.88(s,1h),6.53 (s,1h),6.23(s,1h),5.55(s,1h),4.54-4.50(m,1h),4.50-4.44 (m,2h),4.40-4.36(m,1h),4.14-4.06(m,1h),3.98-3.92(m, 2h),2.88(ddd,j=13.1,8.8,6.7hz,1h),2.78(ddd,j=13.1,8.7,6.8 hz,1h),2.39(q,j=8.1hz,1h),2.29-2.16(m,1h),2.10(dq,j= 17.9,3.6hz,1h),1.84-1.76(m,2h),1.80-1.77(m,3h),1.71(s, 3h),1.60-1.49(m,2h),1.36-1.29(m,4h),0.89(t,j=
6.8hz,3h). 13
c nmr(101mhz,cdcl3)δ172.39,163.27,160.12,147.20,145.86,140.31,123.97, 114.52,111.68,111.28,103.71,66.73,61.19,46.65,46.01,36.98,35.39,32.06, 31.48,30.24,27.83,23.72,22.68,18.82,14.09。
[0158]
纯化(+)-cbd(3):
[0159]
在本实例中,粗(+)-cbd通过快速色谱法(洗脱液系统环己烷/乙酸乙酯=20/1体积/体积)纯化。在由正庚烷结晶后,可以用薄层蒸馏代替快速色谱法。gc纯度:99.8%。手性gc分析:对映体过量99%(对于对映体纯起始材料和含有高达5%的4r-薄荷二烯醇对映体的起始材料)。1h nmr(400mhz,cdcl3)δ6.35-6.09(m,2h),5.97 (s,1h),5.57(dt,j=2.8,1.6hz,1h),4.66(p,j=1.6hz,2h),4.56 (d,j=2.0hz,1h),3.85(ddp,j=10.7,4.5,2.3hz,1h),2.48-2.41 (m,2h),2.38(ddd,j=10.6,3.7hz,1h),2.30-2.17(m,1h),2.09(ddt, j=17.9,5.1,2.4hz,1h),1.88-1.81(m,1h),1.79(dt,j=2.6,1.2 hz,3h),1.78-1.72(m,1h),1.65(t,j=1.1hz,3h),1.62-1.50(m, 2h),1.37-1.22(m,4h),0.88(t,j=7.0hz,3h).13c nmr(101mhz, cdcl3)δ156.07,153.90,149.41,143.06,140.07,124.12,113.76,110.84,109.84, 108.00,7.35,77.03,76.71,46.15,37.28,35.48,31.50,30.64,30.41,28.41, 23.69,22.55,20.54,14.05。
[0160]
实施例2:合成(+)-cbd hpe(4)
[0161][0162]
方案6:合成(+)-cbd hpe(4)
[0163]
使10g(24mmol)(+)-cbd-me(1)在60度下溶解于250ml 1,2-戊二醇中,并倒入1l实验室反应器中。加入1.1g氢氧化钾,并在搅拌至120度和500mbar的真空下开始加热反应混合物。将累积的挥发性副产物蒸馏掉。2小时后,在添加400ml 水和130ml正庚烷之后,将反应混合物冷却到80度。温度进一步降低到室温,并用硫酸(10%重量/重量)中和。分离各层,有机层用250ml水洗涤一次,在na2so4上干燥,然后蒸干。用快速色谱法(洗脱液系统环己烷/乙酸乙酯=10/1体积/体积)纯化粗产物(+)
ꢀ-
cbd-hpe(4)。gc纯度:98%。手性gc分析:对映体过量99%(对于对映体纯起始材料)。1h nmr(400mhz,dmso-d6)δ11.61(s,1h),9.89(s,1h),6.20(s,1h), 5.11-5.05(m,1h),4.91-4.82(m,1h),4.46(d,j=2.7hz,1h),4.42 (dd,j=2.8,1.5hz,1h),4.24-4.11(m,2h),3.95-3.86(m,1h), 3.81-3.71(m,1h),3.03(td,j=11.4,10.9,3.0hz,1h),2.74(s,2h), 2.22-2.05(m,1h),1.94(dd,j=16.7,4.1hz,1h),1.76-1.63(m, 2h),1.61(t,j=1.8hz,3h),1.58(s,3h),1.53-1.34(m,6h),1.33
ꢀ-
1.26(m,4h),0.89(t,j=7.0hz,3h),0.86(t,j=6.7hz,3h).
13
cnmr(101mhz,dmso-d6)δ171.22,162.07,160.33,148.61,144.07,130.72,125.60, 114.82,110.15,109.84,103.50,68.95,67.27,43.32,35.71,35.61,35.44,31.36, 30.91,30.13,29.12,23.13,22.00,18.88,18.12,13.86,13。
[0164]
实施例3:合成(+)-cbdv(5)
-
6.08(m,2h),5.98(s,1h),5.57(dt,j=2.8,1.6hz,1h),4.71(s, 1h),4.66(p,j=1.6hz,1h),4.55(d,j=2.1hz,1h),3.85(ddq,j= 10.5,4.5,2.4hz,1h),2.46-2.38(m,2h),2.45-2.34(m,1h),2.30
ꢀ-
2.17(m,1h),2.09(ddt,j=17.9,5.1,2.5hz,1h),1.87-1.81(m, 1h),1.79(dd,j=2.8,1.5hz,3h),1.77-1.72(m,1h),1.65(t,j= 1.2hz,3h),1.64-1.52(m,2h),0.90(t,j=7.3hz,3h).
13
c nmr(101 mhz,cdcl3)δ156.08,153.82,149.37,142.78,1140.07,124.13,113.82,110.85, 109.82,108.11,77.35,77.04,76.72,46.17,37.58,37.25,30.41,28.41,24.03, 23.69,20.51,13.81。
[0172]
实施例4:与cb1和cb2受体的体外结合
[0173]
通过竞争研究来评估作为cb1和/或cb2受体配体的具有预期性质的化合物,以确定这两种受体的化合物对经典大麻素配体的亲和力(ki值)。竞争研究是用转染cb1或cb2受体的膜进行的。对于储备溶液,化合物以50mm至100mm的浓度溶解,并在-20℃储存。
[0174]
实验步骤
[0175]
来自人类cb1或cb2受体转染细胞(分别为rbhcb1m400ua和rbxcb2m400ua)的膜由 perkin-elmer life and analytical sciences(马萨诸塞州波士顿)提供。cb1或cb2受体膜的b
max
和k
d
值是可变的。使用的批次显示以下b
max
和k
d
值,对于cb1受体膜分别为 1.9pmol/mg膜蛋白和0.16nm,对于cb2受体膜分别为5.2pmol/mg膜蛋白和0.18nm。 cb1受体膜的蛋白质浓度为8.0mg/ml,而cb2受体膜的蛋白质浓度为4.0mg/ml。商用模用结合缓冲液(对于cb1结合缓冲液:50mm triscl、5mm mgcl2.h2o、2.5mm edta、0.5mg/ml bsa且ph=7.4;对于cb2结合缓冲液:50mm triscl、5mm mgcl2.h20、2.5 mm egta、1mg/ml bsa且ph=7.5)稀释(1∶20)。放射性配体[3h]-cp55940(144ci/mmol; perkinelmer)以浓度0.10nm,最终体积200μl用于cb1结合;以浓度0.15nm,最终体积600μl用于cb2结合。用sigmacote(sigma)对实验所需的96孔板和试管进行硅化处理。将膜再次悬浮在相应的缓冲液中,并与放射性配体和每种化合物在30℃下孵育 90分钟。用10μm win55212-2测定非特异性结合,通过与膜孵育而不含任何化合物来测定放射性配体与膜的100%结合。过滤由filtermate(perkin-elmer)和用0.05%的聚乙烯亚胺预处理的filtermat a gf/c过滤器进行。过滤后,用结合缓冲液清洗过滤器九次,干燥,并在其上熔融熔化闪烁片(meltilex
tm
a,perkin elmer)。然后,用液体闪烁分光光度计(wallac microbeta trilux,perkin-elmer)对放射性进行定量。
[0176]
结果
[0177]
利用转染cb1或cb2受体的细胞膜(hek293ebna)和作为放射配体的[3h]-cp55940,用放射性配体置换分析评估新化合物的亲和力。所述化合物的评估分两个阶段进行。第一阶段包括对每种化合物进行独特且高浓度(40μm)的简单筛选。数据收集自至少三个实验,每个实验一式三次进行。第二阶段只选择能够置换[3h]-cp55940(cb1为0.10nm, cb2为0.15nm)的结合50%以上的那些化合物。这由用[3h]-cp55940(cb1为0.10nm, cb2为0.15nm)和不同浓度的所选化合物(10-4-10-11
m)进行的竞争研究构成。使用 graphpad5.01版本(graphpad软件公司,美国加利福尼亚州圣地亚哥)对数据进行分析,以计算每个点一式三次进行的至少三个实验的ki值,该值以平均值
±
sem 表示。计算出的ki值见表2。结合图显示在图1至5中。
[0178]
表2:化合物的cb1和cb2结合活性
[0179]
化合物cb
1-ki(nm)cb
2-ki(nm)cb1/cb2选择性(+)-cbd98240.524.3(+)-cbdv29433.18.9(+)-cbd-me34528.012.3(+)-cbd-ge35912.927.8(+)-cbd-hpe3.10.83.9
[0180]
实施例5:转染细胞的功能分析
[0181]
在确定这些化合物对大麻素受体表达结合亲和力后,分析了它们对大麻素受体的作用(激动作用、拮抗作用)。
[0182]
实验步骤
[0183]
hek 293t-cb1和hek 293t-cb2细胞(用cb1和cb2cdnas稳定转染)(105/ml)在 24孔板中孵育,并用0.5μg,/ml的质粒cre-luc瞬时转染,该质粒cre-luc包含6个与萤火虫荧光素酶相连的共识camp反应元件(cre)。根据制造商的说明,使用rotifect (carl roth gmbh,karlsruhe,germany)进行瞬时转染,并在转染后24小时收获。
[0184]
对于cb1激动剂活性,转染细胞在6小时内用增加浓度的受试化合物或win 55,212-2 (cb1阳性对照)刺激,然后在细胞裂解液(1-2)中测量荧光素酶活性。forskolin是一种腺苷酸环化酶激活剂,以10μm用cb1受体非依赖性机制激活的camp信号通路的阳性对照。
[0185]
对于cb1拮抗活性,cb1细胞与受试化合物预孵育15分钟,然后用win 55,212-2刺激6小时。
[0186]
为了测量cb2激动剂活性,hek293t-cb
2-cre-luc细胞用增加浓度的受试化合物或 win55,212-2(cb2阳性对照)处理15分钟,然后在6小时内用forskolin(10μm)处理。
[0187]
对于细胞中的cb2拮抗活性,分析了由化合物诱导的forskolin诱导的cre-luc抑制的潜在抑制作用。作为阳性对照,使用am630或sr144588这两种已知的cb2拮抗剂。
[0188]
刺激6小时后,按照荧光素酶检测试剂盒(promega,madison,wi)的说明,对细胞进行裂解(在25mm tris-phosphate中,ph 7.8,8mm mgcl2、1mm dtt、1%tritonx-100和7%甘油),并使用autolumat lb 9501(berthold technologies,bad wildbad, germany)测定荧光素酶活性。每个实验值中减去用裂解缓冲液获得的背景值,特异性反式激活表示为超过基础水平的双重诱导(cre-luc)。
[0189]
结果
[0190]
cb1激动剂活性
[0191]
hek 293t-cb1细胞用cre-luc质粒转染,并在24小时后用win-55,212-2(1μm,阳性对照)或受试化合物刺激6小时。阴性对照(未处理细胞,0%激活)未列出。结果表明,5种受试化合物均未显示出cb1激动剂活性(图6至10)。
[0192]
cb1拮抗活性
[0193]
hek 293t-cb1细胞用cre-luc质粒转染,并在24小时后用win 55,212-2(1μm阳性对照)在有或无受试化合物的情况下刺激6小时。阴性对照(未处理细胞,0%激活) 未列出。结果表明,全部所述受试化合物均显示出cb1拮抗活性(图11至15),(+)
ꢀ-
cbd-hpe是最强的cb1拮抗剂(图15)。
[0194]
cb2激动剂活性
[0195]
hek 293t-cb2细胞用cre-luc质粒转染,并在24小时后用forskolin(10μm,阳性对照)在存在或缺乏win 55,212-2或受试化合物的情况下,刺激6小时。阴性对照 (未处理细胞,0%激活)未列出。(+)-cbd(图16)和(+)-cbd-hpe(图20)在较高浓度下显示出cb2激动剂活性。其他受试化合物的这种活性为阴性(图17至图19)。
[0196]
cb2拮抗活性
[0197]
以下研究了所述化合物对cb2受体的潜在拮抗活性。当两种已知的cb2拮抗剂am630 或sr144588存在时,阻止了forskolin诱导的cre-luc抑制中的win 55212-2抑制。阴性对照(未处理细胞,0%激活)未列出。结果表明,受试化合物均未显示出cb2拮抗活性(图21至图25)。
[0198]
表3:受试化合物的cb1和cb2激动作用/拮抗作用
[0199][0200]
实施例6:生物活性研究
[0201]
将受试化合物溶解在dmso(10mg/ml储备溶液)中,并在用于下述实验的培养基中稀释。
[0202]
实验步骤
[0203]
细胞培养物:遵循使用完全无内毒素培养的标准化方案(梯度制剂,淋巴细胞分离培养基,pan biotech,p04-60125,德国艾登巴赫),从当地血库(德国弗莱堡大学医院)提供书面知情同意书的医学健康志愿者的全血中提取人原代单核细胞。使用50ml 的试管,25ml的pancoll装有25ml血液(血沉棕黄层)。在缓慢加速和减速下,通过以1800rpm在20℃下离心40分钟来建立梯度。小心去除间期的外周血单核细胞,并将其重新悬浮于50ml预热磷酸盐缓冲盐水(pbs)(pan biotech,p04-36500),然后以 1600rpm在20℃下离心10分钟。丢弃上清液,在50ml pbs中洗涤球粒,并如上所述离心。然后将该球粒重新悬浮在50ml添加有10%人血清(hexcell,德国柏林,sp2080) 的rpmi-1640低内毒素培养基中。在粒子计数器(euro diagnostics,德国克雷费尔德) 中计数细胞数后,将细胞接种在24孔板中进行酶联免疫吸附试验(elisa)(2.2mio. 个细胞/孔),或以2
×
104个细胞/孔的密度接种在96孔板中用于细胞活力测试,并在 37℃下用5%的co2孵育。去除培养基和非粘附细胞(淋巴细
胞),加入含有1%人血清的新鲜rpmi-1640培养基。富集的单核细胞然后准备用于实验。原代人成纤维细胞和 hacat角质形成细胞获自uniklinik freiburg。所有细胞均于37℃下5%co2的加湿气氛中,保存在含有10%fbs(bio&sell,德国feucht)和1%抗生素青霉素/链霉素(来自invitrogen,dmem完全培养基)的补充dmem(invitrogen,lifetechnologies,德国达姆施塔特)培养基中。
[0204]
细胞活力:细胞用大麻素类(3个剂量,n=4)孵育24小时。细胞毒性通过阿尔玛蓝染色(formazan)进行分析。然后用100μl pbs洗涤细胞一次,然后将100μl培养基-阿尔玛蓝混合物(90%培养基、10%阿尔玛蓝、dal1025、thermo fisher)添加到每个孔中。然后于37℃下加湿5%co2的气氛中孵育该板2小时,并使用96孔板阅读器 (berthold,德国奥芬堡,激发544nm,发射590nm)测定颜色反应。
[0205]
成纤维细胞中炎性分子的测定:原代人成纤维细胞如上所述培养,并接种在24孔板中(500000个细胞/孔)。在大麻素类(5剂量,n=3)缺乏或存在的情况下,细胞用 il-1β(roche,德国曼海姆,10u/ml)孵育24小时。非刺激细胞用作阴性对照。细胞刺激后24小时,去除上清液,离心,并根据制造商的方案使用elisas研究il-6、pge2 和il-8的浓度(pge2来自cayman/biomol,德国汉堡;il-6和il-8来自immunotools,德国弗里索伊特)。使用96孔板阅读器(berthold,德国奥芬堡)确定各自的消光。
[0206]
角质形成细胞中mmps和timps的测定:角质形成细胞(hacat)如上所述培养。将细胞接种在24孔板中,在大麻素类(5剂量,n=3)缺乏或存在的情况下用poly i:c (invivogen,美国加利福尼亚州圣地亚哥,10μg/ml)孵育24小时。非刺激细胞用作阴性对照。细胞刺激后24小时,去除上清液,离心,并根据制造商的方案(来自biotechne,德国威斯巴登)使用elisas研究mmp1、mmp9和timp1的浓度。使用96孔板阅读器 (berthold,德国奥芬堡)确定各自的消光。
[0207]
原代人单核细胞中细胞因子和pge2的测定:细胞用lps(sigma aldrich,德国陶夫基兴,10ng/ml)孵育24小时。在lps处理前30分钟加入大麻素类(5剂量)。24 小时后,去除上清液,离心,并使用制造商的方案研究eias(pge2和异前列烷,来自 cayman/biomol,德国汉堡)或elisas(il-1β,hiss,德国弗莱堡;tnfα、il-6和 il-8,immunotools,德国frysoithe;mmp9,biotechne,德国威斯巴登)中il-1beta、 il-8、il-6、tnfalpha、mmp9、异前列烷和pge2的浓度。使用96孔板阅读器(berthold,德国奥芬堡)确定各自的消光。每个剂量在两个不同献血者的两个血沉棕黄层中分析4 次(使用的2个血沉棕黄层来自2个不同健康献血者,最终n=4个值)。
[0208]
结果
[0209]
对人单核细胞细胞活力的影响
[0210]
对原代人单核细胞进行细胞毒性试验。(+)-cbd和(+)-cbdv在25μm及更高剂量下开始影响细胞活力(图26和27),另外三个大麻素类则在50μm时开始影响细胞活力(图28至图30)。为能够比较五种大麻素类的活性,25μm用作最高剂量。
[0211]
对lps诱导的人单核细胞炎症参数的影响
[0212]
如图31所示,(+)-cbd在0.1μm(tnfα)和1μm(pge2)时开始显著抑制lps 刺激的tnfα和pge2的释放,使用25μm时作用最强,这表明抑制率为约80%。lps诱导的il-6在5μm至25μm的剂量时被抑制,il-8仅在25μm的剂量时被抑制,而lps 介导的il-1β、mmp9和异前列烷不
受(+)-cbd的影响。对这3个参数的非抑制作用表明,使用25μm不会杀灭细胞因而影响了其他参数。
[0213]
在最高剂量下,(+)-cbdv除了对tnfα的影响较弱,对il-1β稍有影响外,显示出与(+)-cbd的作用相当(图32)。
[0214]
(+)-cbd-me仅轻微抑制lps诱导的il-6和tnfα,抑制率为约20%,但在5μm 至25μm剂量时增加了趋化因子il-8,在25μm剂量时增加了il-1(图33)。
[0215]
如图34所示,(+)-cbd-ge从0.1μm开始剂量依赖性地抑制lps刺激的tnfα、 il-6、il-1、异前列烷和pge2的释放,使用25μm时作用最强,这表明对il-6和pge2 的抑制率为约80%,对另外三个参数的抑制率为约40%。lps-诱导的il-8不受影响,而对lps介导的mmp9在5μm至25μm剂量时抑制作用显著增强(比lps值高20%至60%)。
[0216]
(+)-cbd-hpe在5μm至25μm的剂量时仅轻微抑制lps诱导的pge2,在10μm 和25μm的剂量时轻微抑制il-6。在剂量为25μm时,lps刺激的il-8和mmp9仅受到轻微阻止,而对lps介导的il-1β在25μm剂量时抑制作用显著增加(几乎是lps作用的两倍),而lps诱导的tnfα则不受影响(图35)。
[0217]
对il-1诱导的人皮肤成纤维细胞炎症参数的影响
[0218]
如图36所示,(+)-cbd从0.1μm开始显著且剂量依赖性地抑制il-1刺激的il-6 和il-8的释放,使用25μm时作用最强,表明抑制率超过90%。在剂量为10μm至25μm 时,il-1诱导的pge2受到强烈抑制(抑制率超过80%)。
[0219]
(+)-cbdv显示出与(+)-cbd可比的情形,但开始使用5μm时对il-6和il-8 的活性较弱。在剂量为10μm至25μm时,il-1诱导的pge2受到强烈抑制(抑制率超过80%)(图37)。
[0220]
(+)-cbd-me轻微增加了lps诱导的il-6和il-8,并轻微降低了il-1介导的pge2。 25μm的剂量似乎对成纤维细胞有毒性(图38)。
[0221]
如图39所示,(+)-cbd-ge从5μm开始剂量依赖性地抑制全部il-1刺激的参数,使用25μm时作用最强,这表明对il-6和il-8的抑制率约为95%,对p6e2的抑制率约为80%。
[0222]
(+)-cbd-hpe在剂量为10μm和25μm时抑制il-1诱导的il-6和il-8(抑制率 95%),仅在剂量为25μm时抑制pge2(抑制率50%)(图40)。
[0223]
对人hacat角质形成细胞中poly i:c诱导的蛋白酶的影响
[0224]
如图41所示,(+)-cbd从5μm开始轻微抑制poly i:c刺激的mmp9和timp1,使用25μm时作用最强,这表明其对mmp9的抑制率约为40%,对timp1的抑制率约为70%。在剂量为25μm时poly i:c诱导的mmp1仅稍微受到抑制(超过约40%的抑制率)。
[0225]
(+)-cbdv在剂量为25μm时显示出对poly i:c刺激的mmp9和timp1轻微的抑制作用,但增强了poly i:c刺激的mmp1(图42)。
[0226]
(+)-cbd-me在剂量为5μm至25μm时剂量依赖性地轻微降低poly i:c诱导的 timp1(抑制率40%),但增强了poly i:c刺激的mmp9和mmp1(图43)。
[0227]
如图44所示,(+)-cbd-ge(25μm)对poly i:c刺激的mmp9和timp1有轻微的抑制作用(抑制率为30%至50%),但对poly i:c诱导的mmp1没有影响。
[0228]
(+)-cbd-hpe对poly i:c诱导的所有参数均有抑制作用,在剂量为25μm时,对mmp9的抑制率为40%,对timp1的抑制率为60%,对mmp1的抑制率为20%(图45)。
[0229]
keferences:
central nervous system via the cb(2)receptor.british journal of pharmacology,2008, 153(2),271-276
[0244]
dourish c.t.,wilding j.p.h.,halford j.c.g.,anti-obesity drugs:from animal models to clinical efficacy.animal and translational models for cns drug discovery,2008,8,272-315
[0245]
elphick m.r.,egertov
áꢀ
m.,the neurobiology and evolution of cannabinoid signalling.biol.sc.,2001,356(1407):381-408
[0246]
guzman m.,cannabinoids:potential anticancer agents.nature reviews.cancer, 2003,3(10),745-755
[0247]
han k.h.,lim s.,ryu j.,lee c.w.,kim y.,kang j.h.,kang s.s.,ahn y.k.,park c.s.,kim j.j.,cb1 and cb2 cannabinoid receptors differentially regulate the production of reactive oxygen species by macrophages.cardiovascular research, 2009,84,378-386
[0248]
horswill j.g.,bali u.,shaaban s.,keily j.f.,jeevaratnam p.,babbs a.j., reynet c.,wong kai in p.,psncbam-1,a novel allosteric antagonist at cannabinoid cb1 receptors with hypophagic effects in rats.br.j.pharmacol., 2007,152,805-814
[0249]
izzo a.,camilleri m.,emerging role of cannabinoids in gastrointestinal and liver diseases:basic and clinical aspects.gut,2008,57(8),1140-1155 klein t.w.,newton c.,larsen k.,lu l.,perkins i.,nong l.,friedman h.,the cannabinoid system and immune modulation.j leukoc biol.,2003,74,486-496
[0250]
koob g.f.,arends m.a.,le moal m.,chapter 8-cannabinoids.drugs,addiction, and the brain,2014,261-308
[0251]
le boisselier r.,alexandre j.,lelong-boulouard v.,debruyne d.,focus on cannabinoids and synthetic cannabinoids.clinical pharmacology&therapeutics, 2017,101(2),220-229
[0252]
li s.s.,wang l.l.,liu m.,jiang s-h.,zhank m.,tian z-l.,wang m.,li j-y., zhao l.,guan d-w.,cannabinoid cb2 receptors are involved in the regulation of fibrogenesis during skin wound repair in mice.mol.med.rep.,2016,13(4), 3441-3450
[0253]
likar r.,m.,neuwersch s.,clinical use of cannabinoids.pharmakon 2017,5(2),137-141
[0254]
lotersztajn s.,teixeira-clerc f.,julien b.,deveaux v.,ichigotani y.,manin s.,tran-van-nhieu j.,karsak m.,zimmer a.,mallat a.,cb2 receptors as new therapeutic targets for liver diseases.british journal of pharmacology,2008, 153(2),286-289
[0255]
mach f.,montecucco f.,steffens s.,cannabinoid receptors in acute and chronic complications of atherosclerosis.british journal of pharmacology,
limits the development of fibrosis and autoimmunity in a mouse model of systemic sclerosis.am.j.pathol.,2010,177(1),187-196
[0267]
sharma a.,marcil w.,petty f.,xpharm:the comprehensive pharmacology reference. biomed.sc.,2007,1-6
[0268]
teixeira-clerc f.,julien b.,grenard p.,tran van nhieu j.,deveaux v.,lil., serriere-lanneau v.,ledent c.,mallat a.,lotersztajn s.,cb1 cannabinoid receptor antagonism:a new strategy for the treatment ofliver fibrosis.nat. med.,2006,12,671-676
[0269]
wagner j.d.,cann j.a.,zhang l.,harwood jr.h.j.,chapter 14-diabetes and obesity research using nonhuman primates.nonhuman primates in biomedical research,2012,699-732
[0270]
wilkinson j.d.,williamson e.m.,cannabinoids inhibit human keratinocyte proliferation through a non-cb1/cb2 mechanism and have a potential therapeutic value in the treatment of psoriasis.journal of dermatological science,2007, 45.87-92
[0271]
wright k.l.,duncan m.,sharkey k.a.,cannabinoid cb2 receptors inthe gastrointestinal tract:a regulatory system instates of inflammation.british journal of pharmacology,2008,153(2),263-270
[0272]
zhang m.,martin b.r.,adler m.w.,razdan r.k.,jallo j.i.,tuma r.f.,cannabinoid cb(2)receptor activation decreases cerebral infarction inamouse focal ischemia/reperfusion model.journal of cerebral blood flow and metabolism, 2007,27(7),1387-1396
[0273]
zheng j.l.,yu t.s.,li x.n.,fan y.y.,ma w.x.,du y.,zhao r.,guan d.w., cannabinoid receptor type 2is time-dependently expressed during skin wound healing in mice.int.j.legal med.,2012,126,807-814
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签: 大麻
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



